原电池[上学期]
图片预览





文档简介
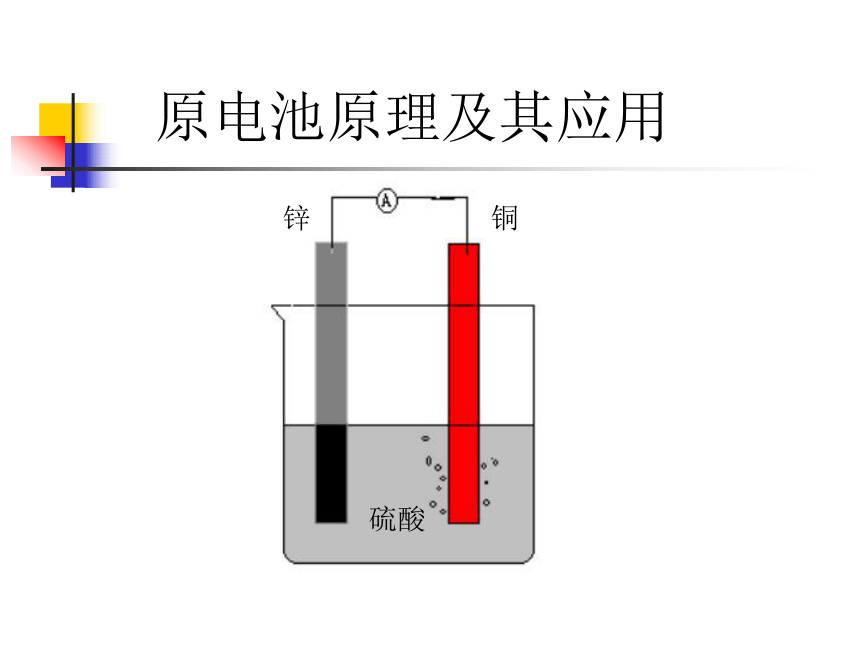
课件20张PPT。电化学基础知识原电池原理及其应用
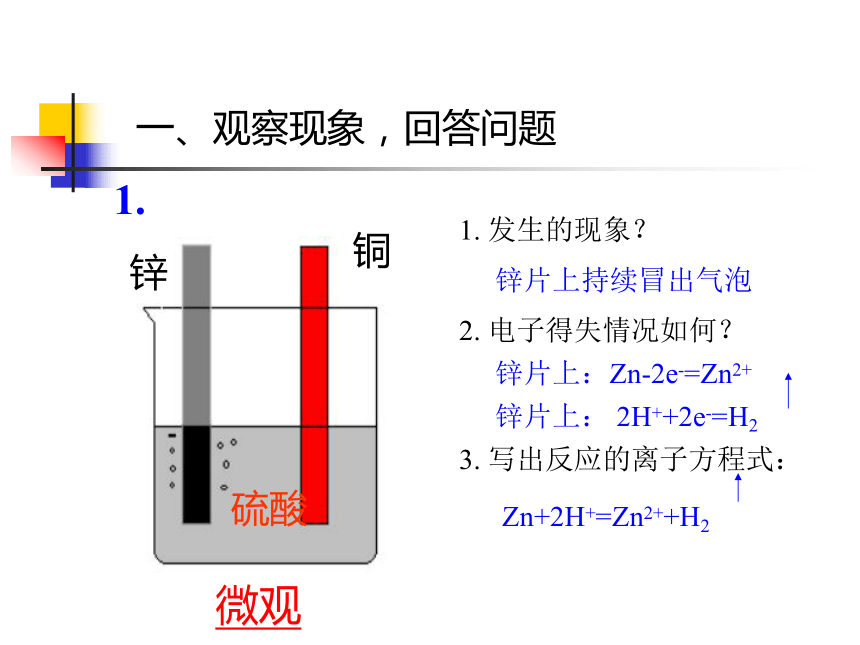
电解原理及其应用原电池原理及其应用一、观察现象,回答问题锌铜硫酸1. 发生的现象?2. 电子得失情况如何?3. 写出反应的离子方程式:锌片上持续冒出气泡锌片上:Zn-2e-=Zn2+锌片上: 2H++2e-=H2Zn+2H+=Zn2++H21.微观2.1. 发生的现象?2. 电子得失情况如何?3. 写出反应的离子方程式:铜片上持续冒出气泡
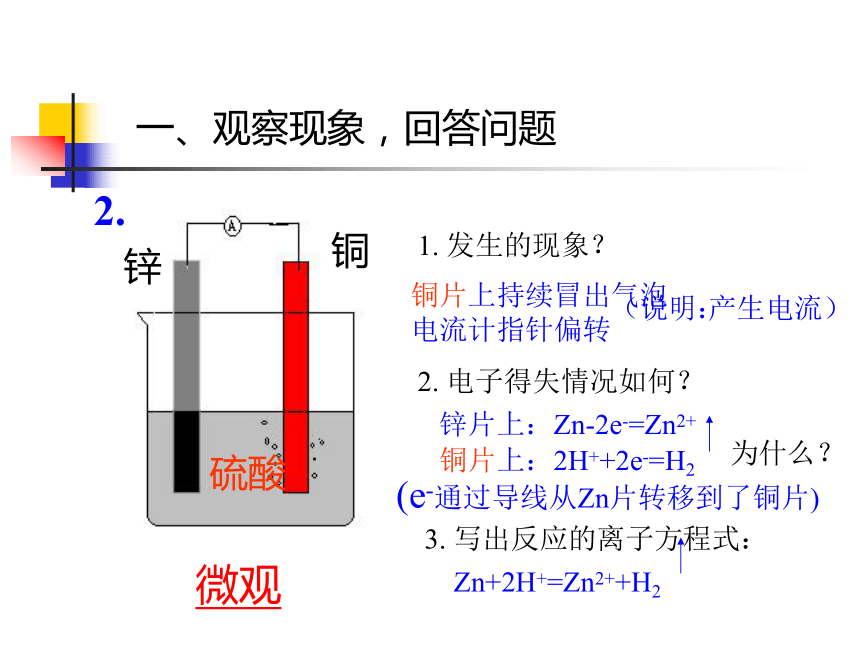
电流计指针偏转锌片上:Zn-2e-=Zn2+铜片上:2H++2e-=H2Zn+2H+=Zn2++H2为什么?(e-通过导线从Zn片转移到了铜片)(说明:产生电流)微观锌铜硫酸一、观察现象,回答问题二、原电池1. 定义:把化学能转变为电能的装置叫做原电池思考:怎样才能将化学能转变为电能?即
构成原电池的条件是什么?2. 构成条件:1)有活泼性不同的两个金属电极(或金属与
能导电的非金属)3)形成闭合回路2)有电解质溶液3电极反应:阅读思考:a. 如何定义电极?
b. 如何判断原电池的 正负极?
c. 各电极发生什么反应?向外电路提供电子的一极叫负极
从外电路得到电子的一极叫正极相对活泼金属做负极
相对不活泼的金属或非金属做正极c. 负极:Zn-2e-=Zn2+(氧化反应)正极:2H++2e-=H2(还原反应)原电池反应(总反应):Zn+2H+=Zn2++H24. 原理 综上所述:原电池原理即较活泼金属发生
氧化反应,电子从较活泼金属(负极)流向不
活泼金属或能导电的非金属(正极)。练习:思考:如何设计一个原电池,使其电池反应为:
Cu+2FeCl3=2FeCl2+CuCl2?作业:课后习题一、二小结:负极:Cu片正极:C棒或Ag片电解质溶液:FeCl3溶液CCuFeCl3图示:本节主要内容:1. 原电池的原理及构成2. 电极反应及电池反应3. 设计原电池26.(10)分熔融盐燃料电池具有高的发电效率,因而受到重视,可用和的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
电池反应式:
阳极反应式:2CO+2CO32- →4CO2+4e-
阴极反应式:___________
总电池反应:____________ 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X三 金属的电化学腐蚀(一)金属的腐蚀金属或合金与周围接触到的气体或液体
进行化学反应而腐蚀损耗的过程。1、化学腐蚀金属跟接触到的物质直接发生化学反应而引起的一种腐蚀。如:铁在高温下跟氧气直接反应化工厂里的氯气跟铁或其他金属直接反应钢管被原油中的含硫化合物腐蚀三 金属的电化学腐蚀2、电化学腐蚀不纯的金属或合金接触到电解质溶液所发生的原电池反应,
比较活泼的金属原子失去电子而被氧化而引起的腐蚀。钢铁的腐蚀钢铁在干燥的空气里长时间不易腐蚀,但在潮湿的空气里
却很快就会腐蚀,这是什么原因呢?钢铁的腐蚀1、析氢腐蚀在酸性的溶液里进行负极(Fe):
正极(C):Fe-2e-==Fe2+2H++2e-=H22、吸氧腐蚀在酸性很弱或中性溶液里进行负极(Fe):
正极(C):Fe-2e-==Fe2+2H2O+O2+4e-==4OH-析氢腐蚀和吸氧腐蚀比较水膜酸性较强水膜酸性很弱或中性2H++2e-=H22H2O+O2+4e-==4OH-Fe-2e-==Fe2+Fe2+ +2OH-==Fe(OH)2
4Fe(OH)2+O2+H2O==4Fe(OH)3化学腐蚀与电化学腐蚀比较金属与氧化剂
直接接触不纯金属或合金与
电解质溶液接触无电流产物有微弱电流产物金属被氧化过程较活泼金属被氧化过程同时发生,但电化学腐蚀更普遍,
且腐蚀速度大于化学腐蚀(二)电化学腐蚀的应用1、加快腐蚀2、金属的防护(又钢铁防护为例)(1)加保护层涂油脂、油漆等;
镀上一层不易被腐蚀的金属(锌、铬等)
把钢铁表面氧化形成一层致密的氧化膜。(2)改变金属内部结构如在普通钢里加入铬、镍等制成不锈钢。(3)牺牲阳极法应用:钢闸门、轮船。表面镀有金属层的铁片,当镀层有破损时,
比普通铁片更易腐蚀的是:
A白铁(镀锌) B马口铁(镀锡)
C镀镍铁 D镀铜铁
电解原理及其应用原电池原理及其应用一、观察现象,回答问题锌铜硫酸1. 发生的现象?2. 电子得失情况如何?3. 写出反应的离子方程式:锌片上持续冒出气泡锌片上:Zn-2e-=Zn2+锌片上: 2H++2e-=H2Zn+2H+=Zn2++H21.微观2.1. 发生的现象?2. 电子得失情况如何?3. 写出反应的离子方程式:铜片上持续冒出气泡
电流计指针偏转锌片上:Zn-2e-=Zn2+铜片上:2H++2e-=H2Zn+2H+=Zn2++H2为什么?(e-通过导线从Zn片转移到了铜片)(说明:产生电流)微观锌铜硫酸一、观察现象,回答问题二、原电池1. 定义:把化学能转变为电能的装置叫做原电池思考:怎样才能将化学能转变为电能?即
构成原电池的条件是什么?2. 构成条件:1)有活泼性不同的两个金属电极(或金属与
能导电的非金属)3)形成闭合回路2)有电解质溶液3电极反应:阅读思考:a. 如何定义电极?
b. 如何判断原电池的 正负极?
c. 各电极发生什么反应?向外电路提供电子的一极叫负极
从外电路得到电子的一极叫正极相对活泼金属做负极
相对不活泼的金属或非金属做正极c. 负极:Zn-2e-=Zn2+(氧化反应)正极:2H++2e-=H2(还原反应)原电池反应(总反应):Zn+2H+=Zn2++H24. 原理 综上所述:原电池原理即较活泼金属发生
氧化反应,电子从较活泼金属(负极)流向不
活泼金属或能导电的非金属(正极)。练习:思考:如何设计一个原电池,使其电池反应为:
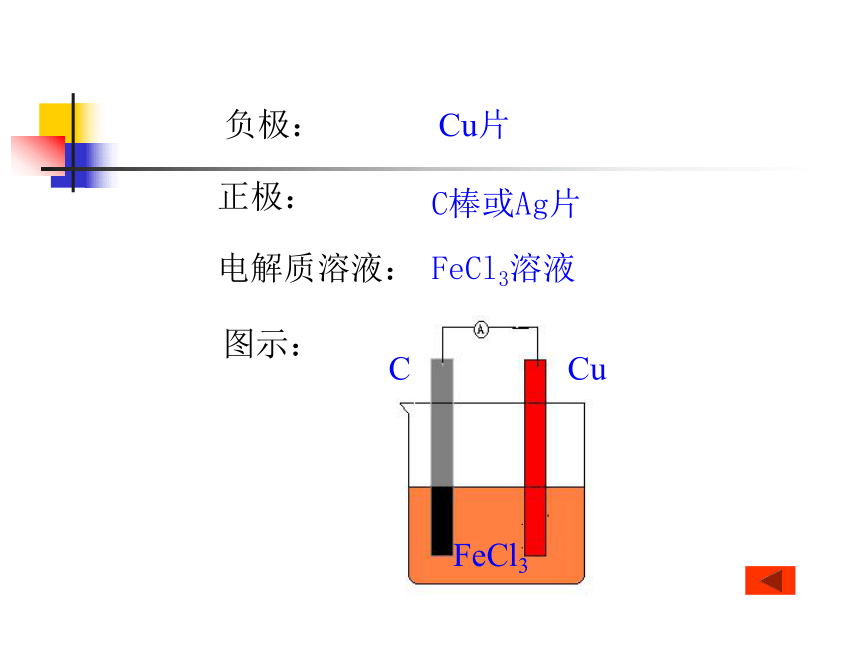
Cu+2FeCl3=2FeCl2+CuCl2?作业:课后习题一、二小结:负极:Cu片正极:C棒或Ag片电解质溶液:FeCl3溶液CCuFeCl3图示:本节主要内容:1. 原电池的原理及构成2. 电极反应及电池反应3. 设计原电池26.(10)分熔融盐燃料电池具有高的发电效率,因而受到重视,可用和的熔融盐混和物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
电池反应式:
阳极反应式:2CO+2CO32- →4CO2+4e-
阴极反应式:___________
总电池反应:____________ 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X三 金属的电化学腐蚀(一)金属的腐蚀金属或合金与周围接触到的气体或液体
进行化学反应而腐蚀损耗的过程。1、化学腐蚀金属跟接触到的物质直接发生化学反应而引起的一种腐蚀。如:铁在高温下跟氧气直接反应化工厂里的氯气跟铁或其他金属直接反应钢管被原油中的含硫化合物腐蚀三 金属的电化学腐蚀2、电化学腐蚀不纯的金属或合金接触到电解质溶液所发生的原电池反应,
比较活泼的金属原子失去电子而被氧化而引起的腐蚀。钢铁的腐蚀钢铁在干燥的空气里长时间不易腐蚀,但在潮湿的空气里
却很快就会腐蚀,这是什么原因呢?钢铁的腐蚀1、析氢腐蚀在酸性的溶液里进行负极(Fe):
正极(C):Fe-2e-==Fe2+2H++2e-=H22、吸氧腐蚀在酸性很弱或中性溶液里进行负极(Fe):
正极(C):Fe-2e-==Fe2+2H2O+O2+4e-==4OH-析氢腐蚀和吸氧腐蚀比较水膜酸性较强水膜酸性很弱或中性2H++2e-=H22H2O+O2+4e-==4OH-Fe-2e-==Fe2+Fe2+ +2OH-==Fe(OH)2
4Fe(OH)2+O2+H2O==4Fe(OH)3化学腐蚀与电化学腐蚀比较金属与氧化剂
直接接触不纯金属或合金与
电解质溶液接触无电流产物有微弱电流产物金属被氧化过程较活泼金属被氧化过程同时发生,但电化学腐蚀更普遍,
且腐蚀速度大于化学腐蚀(二)电化学腐蚀的应用1、加快腐蚀2、金属的防护(又钢铁防护为例)(1)加保护层涂油脂、油漆等;
镀上一层不易被腐蚀的金属(锌、铬等)
把钢铁表面氧化形成一层致密的氧化膜。(2)改变金属内部结构如在普通钢里加入铬、镍等制成不锈钢。(3)牺牲阳极法应用:钢闸门、轮船。表面镀有金属层的铁片,当镀层有破损时,
比普通铁片更易腐蚀的是:
A白铁(镀锌) B马口铁(镀锡)
C镀镍铁 D镀铜铁
