原电池[上学期]
图片预览



文档简介
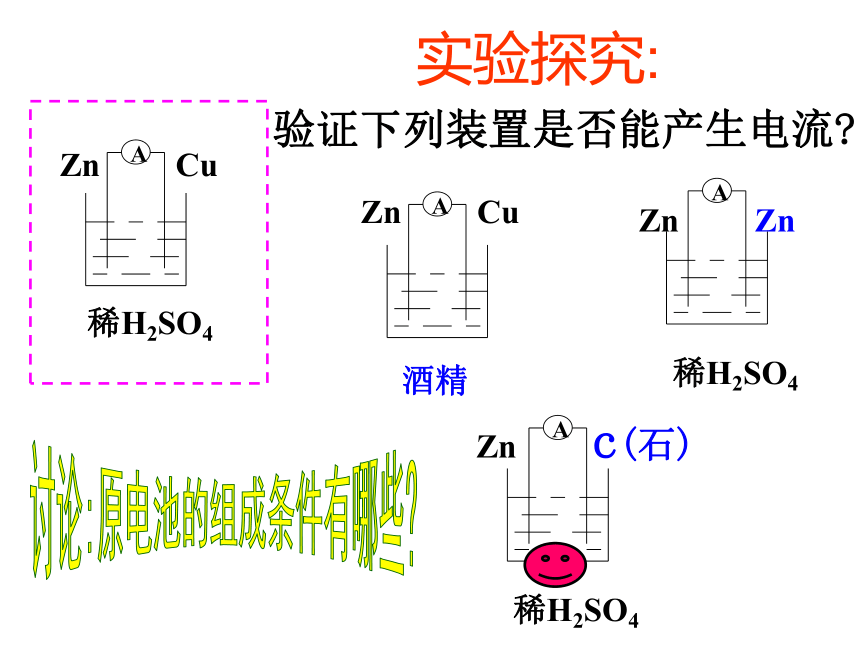
课件16张PPT。原电池实验探究锌片部分溶解,锌片上有气泡产生。铜片不溶解,铜片上
无气泡产生。铜片不溶解,但是,
铜片上有气泡产生。有一、原电池-把化学能转变为电能的装置讨论:原电池的组成条件有哪些?二、原电池的组成条件①有活泼性不同的两种金属电极(或一种是非金属电极)
②有电解质溶液
③形成闭合回路
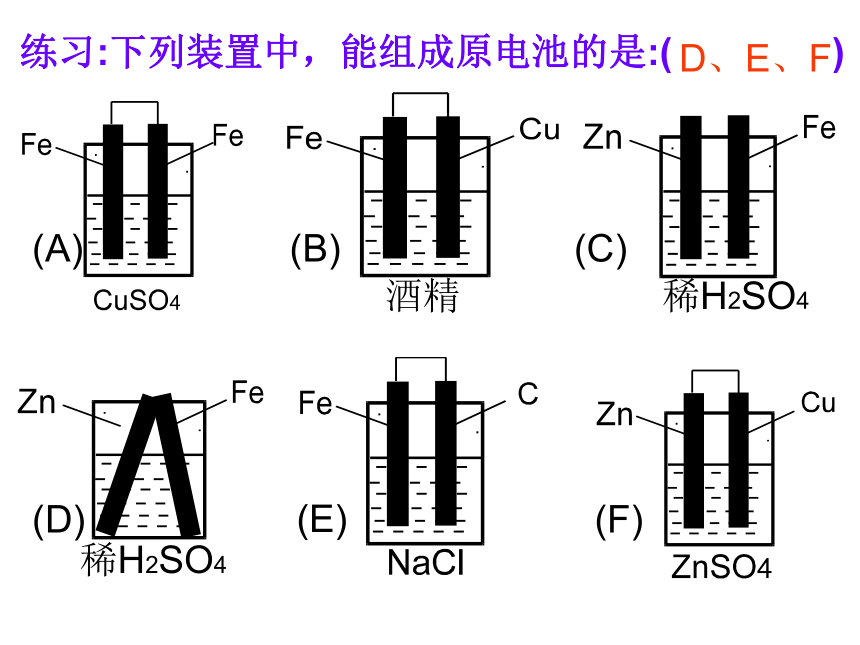
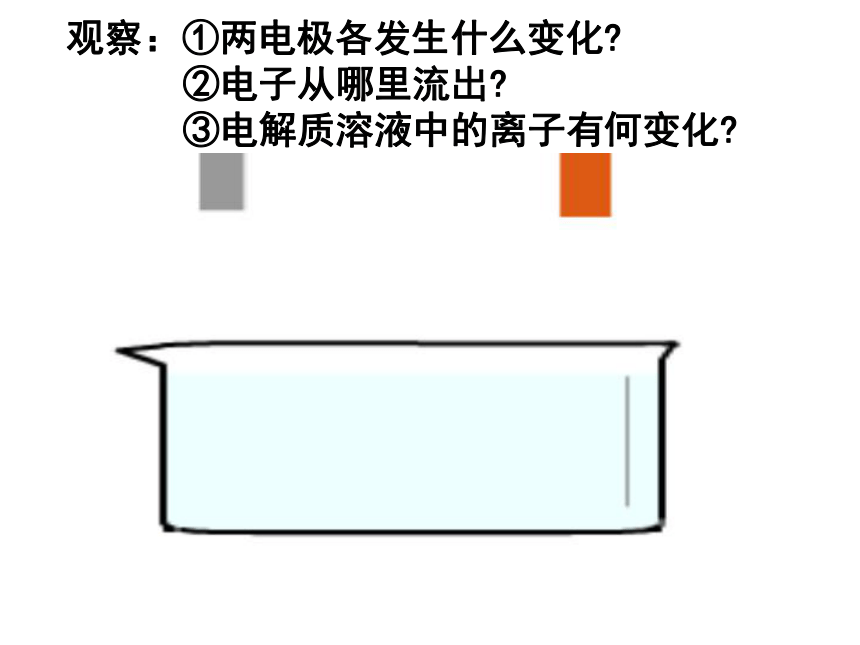
④氧化还原反应能自发进行。(某一电极能与电解质溶液发生反应) 练习:下列装置中,能组成原电池的是:( ) 酒精稀H2SO4稀H2SO4(A)(B)(C)(D)(E)(F)D、E、F—稀硫酸观察:①两电极各发生什么变化?
②电子从哪里流出?
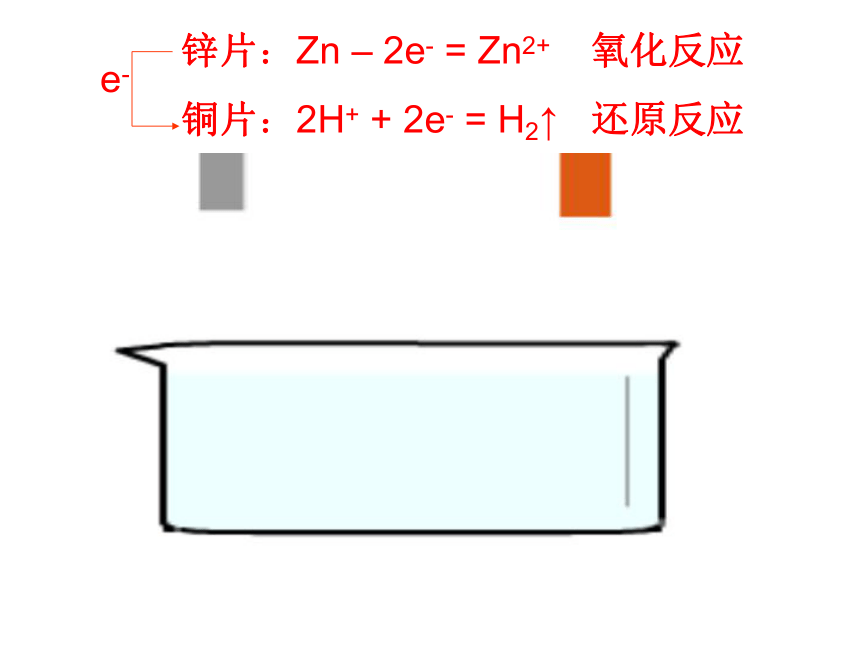
③电解质溶液中的离子有何变化?锌片:Zn – 2e- = Zn2+
铜片:2H+ + 2e- = H2↑氧化反应
还原反应—稀硫酸三、原电池工作原理①较活泼的金属失去电子,发生氧化反应.
②电子通过导线流向不活泼的金属(或非金属),形成电流。
③溶液中的阳离子得到电子被还原.根据Cu—Zn原电池原理填写下表(-)(+)ZnCu较活泼不活泼失电子得电子电子
流出电子
流入氧化
反应还原
反应负极正极四、原电池的电极判断①由两极材料判断:一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极
②根据电子流动方向判断:由负极流向正极
③根据电流方向判断:由正极流向负极
④根据电解质溶液内离子的定向移动方向:阴离子移向的极是负极,阳离子移向的极是正极,
⑤根据两极发生的变化判断:失电子发生氧化反应的总是负极,得电子发生还原反应的总是正极.
判断下列原电池的正、负极,并写出电极反应式和总反应方程式(A)(B)(C)四、原电池的电极判断①由两极材料判断:一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极
②根据电子流动方向判断:由负极流向正极
③根据电流方向判断:由正极流向负极
④根据电解质溶液内离子的定向移动方向:阴离子移向的极是负极,阳离子移向的极是正极,
⑤根据两极发生的变化判断:失电子发生氧化反应的总是负极,得电子发生还原反应的总是正极.
紧跟高考 1、100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸
B.加入数滴CuCl2溶液
C. 加入适量蒸馏水
D. 加入适量的NaCl溶液
B 2、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池:若a、 b相连时,a为负极;c、d相连,d上有气体逸出;a、c相连时,a极减轻;b、d相连,b为正极。则四种金属的活动性为( )
a ﹥ b ﹥ c ﹥ d B. a ﹥ c ﹥ b ﹥ d
C. a ﹥ c ﹥ d ﹥b D. b ﹥ d ﹥ c ﹥ a
紧跟高考C一、原电池1、概念2、构成条件3、工作原理4、正、负极的判断作 业1、家庭小实验:
制作水果电池
2、社会调查:
废弃电池的污染和危害。
无气泡产生。铜片不溶解,但是,
铜片上有气泡产生。有一、原电池-把化学能转变为电能的装置讨论:原电池的组成条件有哪些?二、原电池的组成条件①有活泼性不同的两种金属电极(或一种是非金属电极)
②有电解质溶液
③形成闭合回路
④氧化还原反应能自发进行。(某一电极能与电解质溶液发生反应) 练习:下列装置中,能组成原电池的是:( ) 酒精稀H2SO4稀H2SO4(A)(B)(C)(D)(E)(F)D、E、F—稀硫酸观察:①两电极各发生什么变化?
②电子从哪里流出?
③电解质溶液中的离子有何变化?锌片:Zn – 2e- = Zn2+
铜片:2H+ + 2e- = H2↑氧化反应
还原反应—稀硫酸三、原电池工作原理①较活泼的金属失去电子,发生氧化反应.
②电子通过导线流向不活泼的金属(或非金属),形成电流。
③溶液中的阳离子得到电子被还原.根据Cu—Zn原电池原理填写下表(-)(+)ZnCu较活泼不活泼失电子得电子电子
流出电子
流入氧化
反应还原
反应负极正极四、原电池的电极判断①由两极材料判断:一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极
②根据电子流动方向判断:由负极流向正极
③根据电流方向判断:由正极流向负极
④根据电解质溶液内离子的定向移动方向:阴离子移向的极是负极,阳离子移向的极是正极,
⑤根据两极发生的变化判断:失电子发生氧化反应的总是负极,得电子发生还原反应的总是正极.
判断下列原电池的正、负极,并写出电极反应式和总反应方程式(A)(B)(C)四、原电池的电极判断①由两极材料判断:一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极
②根据电子流动方向判断:由负极流向正极
③根据电流方向判断:由正极流向负极
④根据电解质溶液内离子的定向移动方向:阴离子移向的极是负极,阳离子移向的极是正极,
⑤根据两极发生的变化判断:失电子发生氧化反应的总是负极,得电子发生还原反应的总是正极.
紧跟高考 1、100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成H2的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸
B.加入数滴CuCl2溶液
C. 加入适量蒸馏水
D. 加入适量的NaCl溶液
B 2、把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池:若a、 b相连时,a为负极;c、d相连,d上有气体逸出;a、c相连时,a极减轻;b、d相连,b为正极。则四种金属的活动性为( )
a ﹥ b ﹥ c ﹥ d B. a ﹥ c ﹥ b ﹥ d
C. a ﹥ c ﹥ d ﹥b D. b ﹥ d ﹥ c ﹥ a
紧跟高考C一、原电池1、概念2、构成条件3、工作原理4、正、负极的判断作 业1、家庭小实验:
制作水果电池
2、社会调查:
废弃电池的污染和危害。
