原电池[上下学期通用]
图片预览



文档简介
课件14张PPT。原电池的原理及应用 梁雄欢
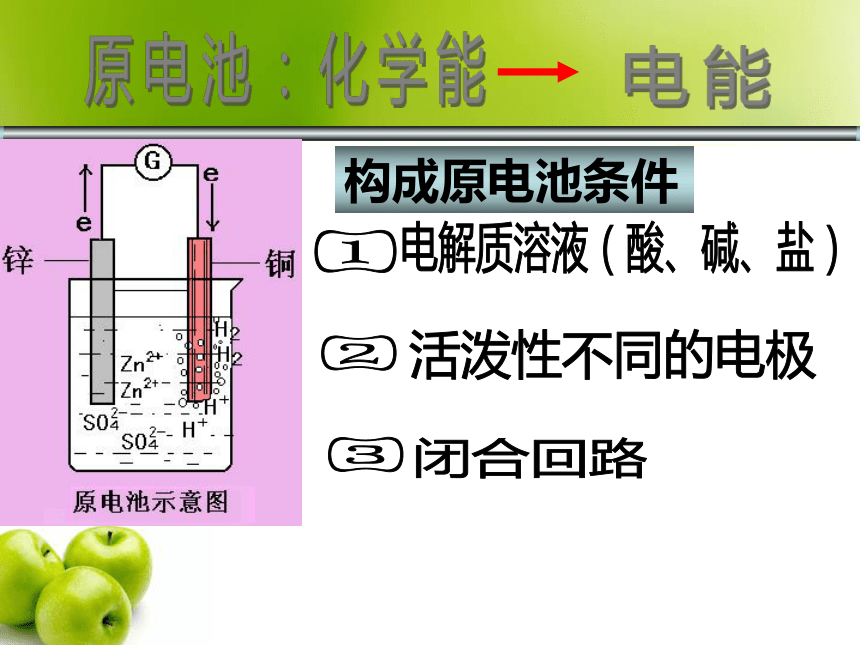
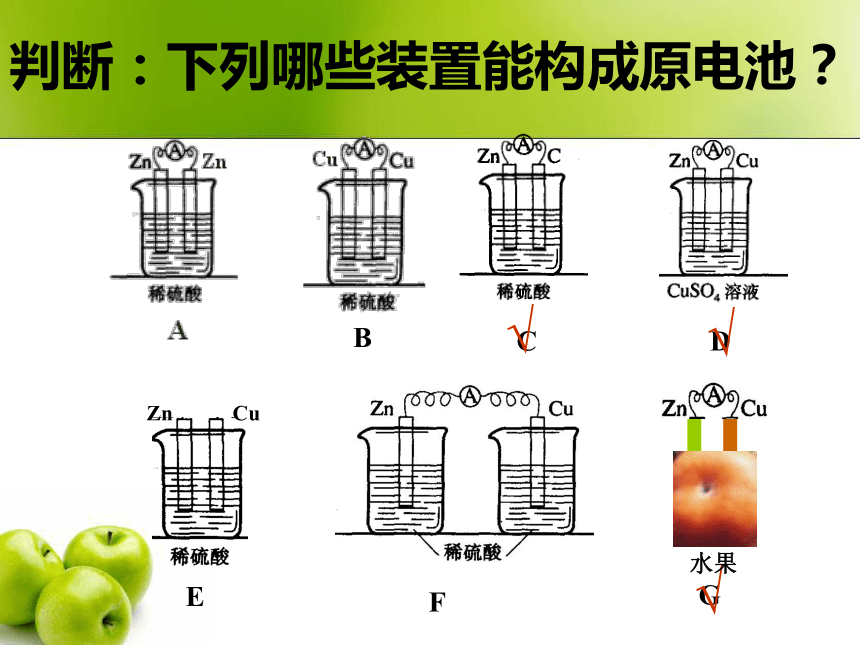
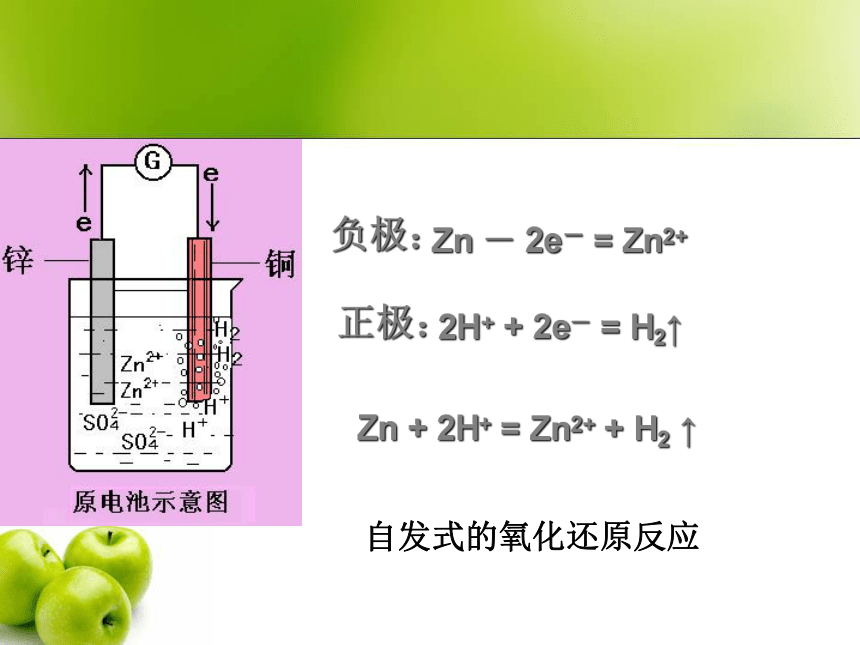
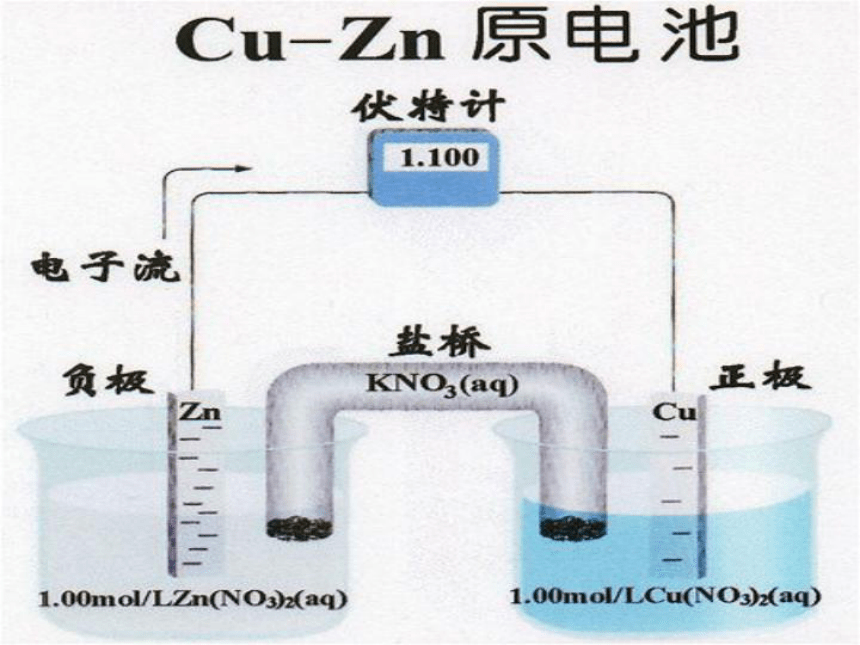
2006-11-13电化学原电池:产生电流反应的装置电解池:借助电流发生反应的装置电化学构成原电池条件电解质溶液(酸、碱、盐)①②③活泼性不同的电极闭合回路原电池:化学能 电能ZnCuBCDEF√判断:下列哪些装置能构成原电池?√G√水果负极:正极:Zn - 2e- = Zn2+2H+ + 2e- = H2↑Zn + 2H+ = Zn2+ + H2 ↑自发式的氧化还原反应过渡:氧化还原反应的本质是反应物之间电子的转移,但是在通常的氧化还原反应中并不能获得电流。Zn+CuSO4=ZnSO4+Cu盐桥通路盐桥电解质:载体:琼脂KCl、KNO3 电极反应方程式:负极:Zn - 2e- = Zn2+ 正极: Cu 2+ + 2e- = Cu电池总反应式: Zn + Cu 2+ = Zn2+ + Cu
原电池电极反应式的书写注意事项:
(1)负氧正还。
(2)要注意溶液的酸碱性,适当的在 电极方程式两边添加H+、OH—、H2O,以遵循电荷守恒和质量守恒。
(3)要注意电极反应产物是否与电解质溶液发生反应。
小结 例1、Cu、Fe作两极,稀硫酸作电解质溶液
的原电池中:①Cu作____极, ②Fe作____极
电极反应式是:负极____________
正极_____________
总反应式是___________________________
正负Fe-2e-=Fe2+2H++2e-=H2↑Fe+H2SO4=FeSO4+H2↑练习:书写电极方程式扩展:把氧化还原反应设计成原电池 负极:还原性较强的物质,向外电路提供电子。
正极:氧化性较强的物质,从外电路得到电子。
在原电池的内部,两极浸在电解质溶液中, 并通过正负离子的定向运动而形成内电路。放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路。
原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力。如何利用: Cu+2AgNO3=Cu(NO3)2+Ag 的反应原理,设计一持续产生电流的原电池装置?
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B练习:根据电子电流流向判断正负极、活泼性比较
2006-11-13电化学原电池:产生电流反应的装置电解池:借助电流发生反应的装置电化学构成原电池条件电解质溶液(酸、碱、盐)①②③活泼性不同的电极闭合回路原电池:化学能 电能ZnCuBCDEF√判断:下列哪些装置能构成原电池?√G√水果负极:正极:Zn - 2e- = Zn2+2H+ + 2e- = H2↑Zn + 2H+ = Zn2+ + H2 ↑自发式的氧化还原反应过渡:氧化还原反应的本质是反应物之间电子的转移,但是在通常的氧化还原反应中并不能获得电流。Zn+CuSO4=ZnSO4+Cu盐桥通路盐桥电解质:载体:琼脂KCl、KNO3 电极反应方程式:负极:Zn - 2e- = Zn2+ 正极: Cu 2+ + 2e- = Cu电池总反应式: Zn + Cu 2+ = Zn2+ + Cu
原电池电极反应式的书写注意事项:
(1)负氧正还。
(2)要注意溶液的酸碱性,适当的在 电极方程式两边添加H+、OH—、H2O,以遵循电荷守恒和质量守恒。
(3)要注意电极反应产物是否与电解质溶液发生反应。
小结 例1、Cu、Fe作两极,稀硫酸作电解质溶液
的原电池中:①Cu作____极, ②Fe作____极
电极反应式是:负极____________
正极_____________
总反应式是___________________________
正负Fe-2e-=Fe2+2H++2e-=H2↑Fe+H2SO4=FeSO4+H2↑练习:书写电极方程式扩展:把氧化还原反应设计成原电池 负极:还原性较强的物质,向外电路提供电子。
正极:氧化性较强的物质,从外电路得到电子。
在原电池的内部,两极浸在电解质溶液中, 并通过正负离子的定向运动而形成内电路。放电时,负极上的电子通过导线流向正极,再通过溶液中离子形成的内电路构成环路。
原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力。如何利用: Cu+2AgNO3=Cu(NO3)2+Ag 的反应原理,设计一持续产生电流的原电池装置?
把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B练习:根据电子电流流向判断正负极、活泼性比较
