原电池[上学期]
图片预览



文档简介
课件18张PPT。原 池电(第二课时)实验探究铜片表面明显有铜析出,电流计指示无电流通过。现象1:铜片表面明显有铜析出,电流计指针发生偏转,并指示电子是由锌片流向铜片。2、将Zn片和Cu片分别
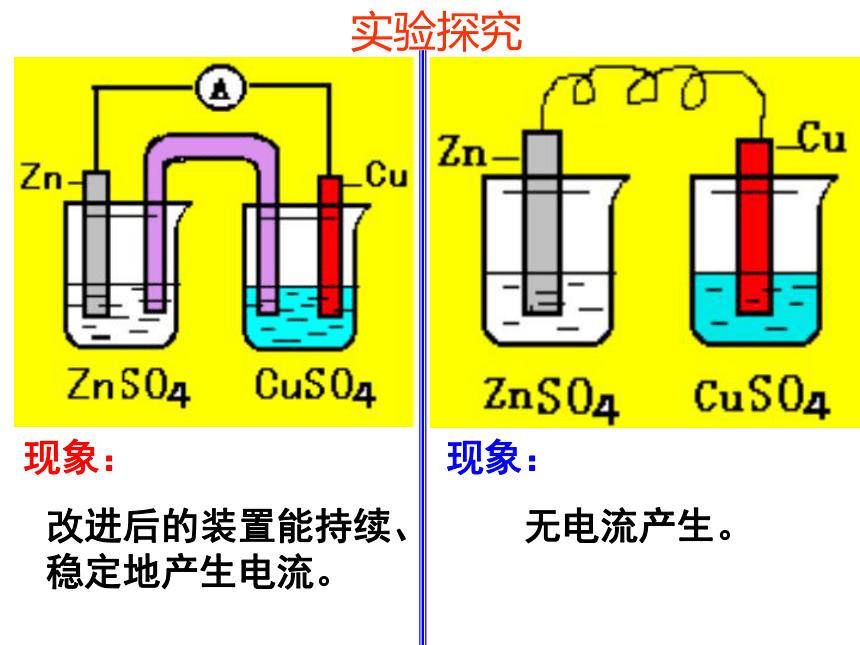
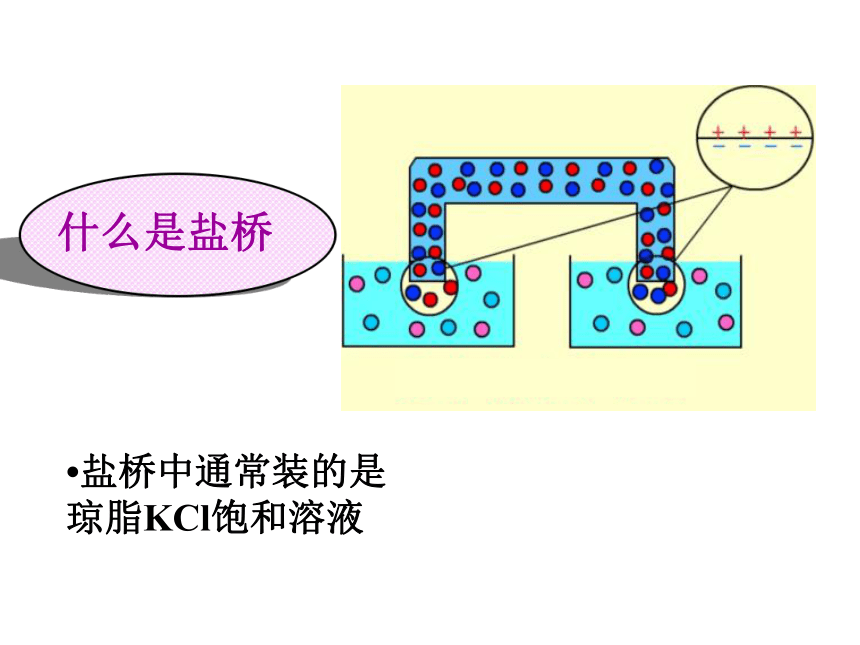
通过导线与电流计连接,并使Zn片和Cu片不直接接触,再同时浸入盛有CuSO4溶液的烧杯中。观察现象。现象2:随着上述实验时间的延续,电流计指针偏转的角度逐渐减小,最终又没有电流通过,同时锌片表面逐渐被铜全部覆盖。七嘴八舌说说产生不同实验现象的原因是什么?实验探究现象: 现象: 改进后的装置能持续、稳定地产生电流。 无电流产生。 七嘴八舌说说产生不同实验现象的原因是什么??盐桥中通常装的是琼脂KCl饱和溶液 什么是盐桥
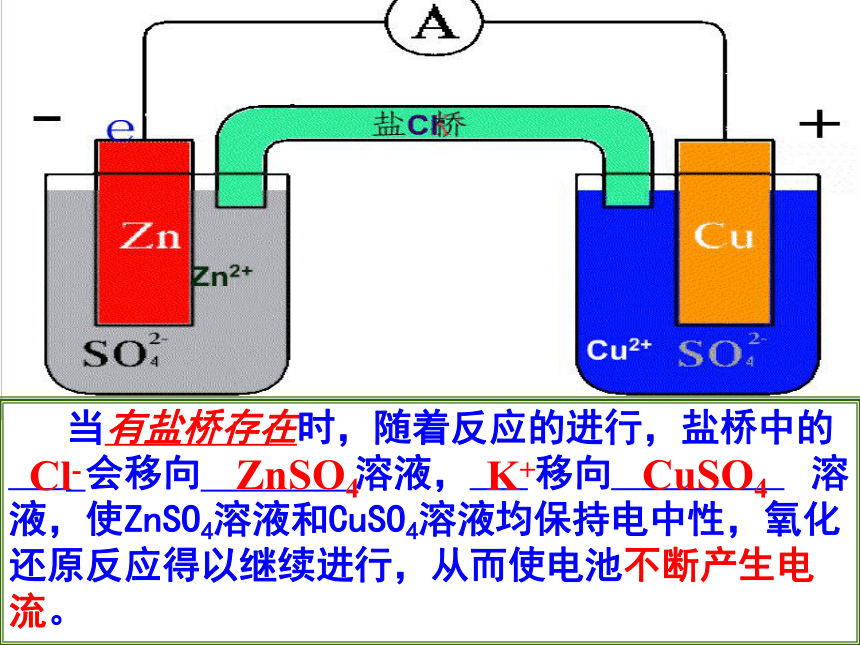
当有盐桥存在时,随着反应的进行,盐桥中的__ 会移向 溶液,__ 移向______ 溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使电池不断产生电流。Cl-ZnSO4K+CuSO4 取出盐桥,由于__原子失电子成为__ _进入溶液,使ZnSO4溶液因__ __增加而带__;同时__ __获得电子成为__ __沉淀在铜片上,使CuSO4溶液因__ __相对增加而带__电。这两种因素均会阻止电子从锌片流向铜片,而不产生电流。ZnZn2+Zn2+正电Cu2+金属铜SO42-负其作用主要是:
1、连接闭合回路;
2、保持两个半电池中溶液的电中性
盐桥的作用
(2)铜半电池(铜和铜盐溶液)(1)锌半电池(锌和锌盐溶液)(中间用盐桥连接起来)负极:正极:总反应:Zn - 2e- = Zn2+Cu2++2e- = CuZn+Cu2+=Zn2++Cu由两个半电池组成原电池的工作原理练 习1、铜锌原电池产生电流时,阳离子( )
A.移向Zn极,阴离子移向Cu极
B.移向Cu极,阴离子移向Zn极
C.和阴离子都移向Zn极
D.和阴离子都移向Cu极B练 习 2、用Cu和CuSO4溶液、Ag和AgNO3溶液设计一个原电池。
这个原电池的负极是____,电极反应式是____________;
正极是____,电极反应式是
__________。CuCu - 2e- = Cu2+Ag2Ag ++2e-=2Ag练 习 3、电子表和微电脑计时器上使用的纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液,其电极反应式是:
Zn +2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。下列说法正确的是( )
A.Zn为正极,Zn被氧化
B.Ag2O为负极,被还原
C.电流由锌极流经外电路进入Ag20极
D.总反应方程式是:Zn+Ag2O=2Ag+ZnOD走进生活 1、银制器皿日久表面会逐渐变为黑色,这是由于生成了硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制的容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会逐渐褪去而银不会损失。
试回答在此原电池中:
负极是___,
发生的反应是___ ___ ;
正极是___,
发生的反应是___ ___ ;Al2Al-6e-=2Al3+Ag3Ag2S+6e-=6Ag +3S2-小 结(1)原电池的功能:
将化学能转换成电能(2)原电池输出电能的能力:
组成原电池的反应物的氧化还原能力;
装置设计的合理性;
影响电极反应的条件。作 业 根据下式所表示的氧化还原反应
设计一个原电池:
Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)
(1)?? 若装置采用烧杯和盐桥,画出
此原电池的装置简图
(2)?? 注明原电池的正极和负极
(3)?? 注明外电路中电子的流向
(4)?? 写出两个电极上的电极反应图a图b
通过导线与电流计连接,并使Zn片和Cu片不直接接触,再同时浸入盛有CuSO4溶液的烧杯中。观察现象。现象2:随着上述实验时间的延续,电流计指针偏转的角度逐渐减小,最终又没有电流通过,同时锌片表面逐渐被铜全部覆盖。七嘴八舌说说产生不同实验现象的原因是什么?实验探究现象: 现象: 改进后的装置能持续、稳定地产生电流。 无电流产生。 七嘴八舌说说产生不同实验现象的原因是什么??盐桥中通常装的是琼脂KCl饱和溶液 什么是盐桥
当有盐桥存在时,随着反应的进行,盐桥中的__ 会移向 溶液,__ 移向______ 溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使电池不断产生电流。Cl-ZnSO4K+CuSO4 取出盐桥,由于__原子失电子成为__ _进入溶液,使ZnSO4溶液因__ __增加而带__;同时__ __获得电子成为__ __沉淀在铜片上,使CuSO4溶液因__ __相对增加而带__电。这两种因素均会阻止电子从锌片流向铜片,而不产生电流。ZnZn2+Zn2+正电Cu2+金属铜SO42-负其作用主要是:
1、连接闭合回路;
2、保持两个半电池中溶液的电中性
盐桥的作用
(2)铜半电池(铜和铜盐溶液)(1)锌半电池(锌和锌盐溶液)(中间用盐桥连接起来)负极:正极:总反应:Zn - 2e- = Zn2+Cu2++2e- = CuZn+Cu2+=Zn2++Cu由两个半电池组成原电池的工作原理练 习1、铜锌原电池产生电流时,阳离子( )
A.移向Zn极,阴离子移向Cu极
B.移向Cu极,阴离子移向Zn极
C.和阴离子都移向Zn极
D.和阴离子都移向Cu极B练 习 2、用Cu和CuSO4溶液、Ag和AgNO3溶液设计一个原电池。
这个原电池的负极是____,电极反应式是____________;
正极是____,电极反应式是
__________。CuCu - 2e- = Cu2+Ag2Ag ++2e-=2Ag练 习 3、电子表和微电脑计时器上使用的纽扣电池的电极材料为Zn和Ag2O,电解质溶液是KOH溶液,其电极反应式是:
Zn +2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。下列说法正确的是( )
A.Zn为正极,Zn被氧化
B.Ag2O为负极,被还原
C.电流由锌极流经外电路进入Ag20极
D.总反应方程式是:Zn+Ag2O=2Ag+ZnOD走进生活 1、银制器皿日久表面会逐渐变为黑色,这是由于生成了硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制的容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会逐渐褪去而银不会损失。
试回答在此原电池中:
负极是___,
发生的反应是___ ___ ;
正极是___,
发生的反应是___ ___ ;Al2Al-6e-=2Al3+Ag3Ag2S+6e-=6Ag +3S2-小 结(1)原电池的功能:
将化学能转换成电能(2)原电池输出电能的能力:
组成原电池的反应物的氧化还原能力;
装置设计的合理性;
影响电极反应的条件。作 业 根据下式所表示的氧化还原反应
设计一个原电池:
Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)
(1)?? 若装置采用烧杯和盐桥,画出
此原电池的装置简图
(2)?? 注明原电池的正极和负极
(3)?? 注明外电路中电子的流向
(4)?? 写出两个电极上的电极反应图a图b
