原电池[上学期]
图片预览


文档简介
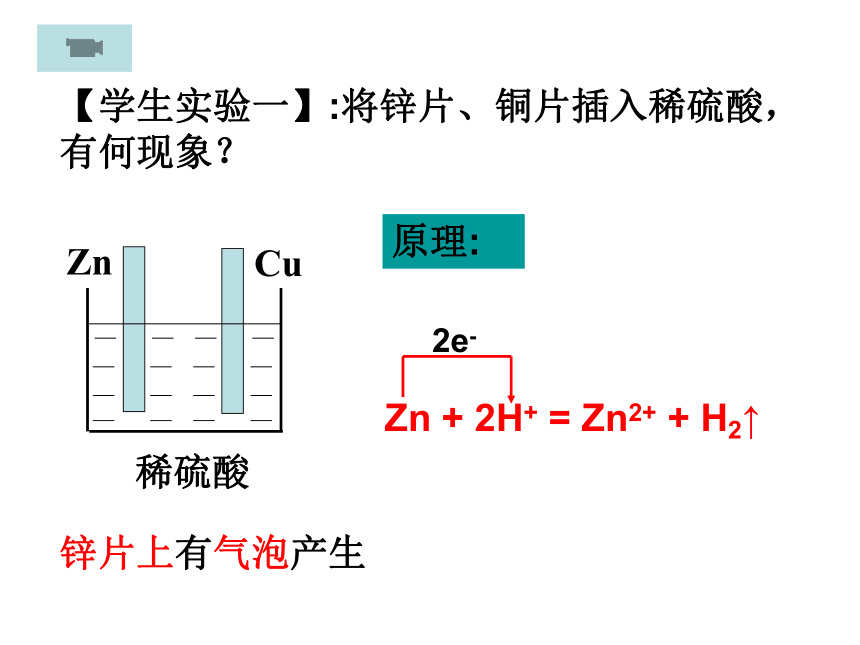
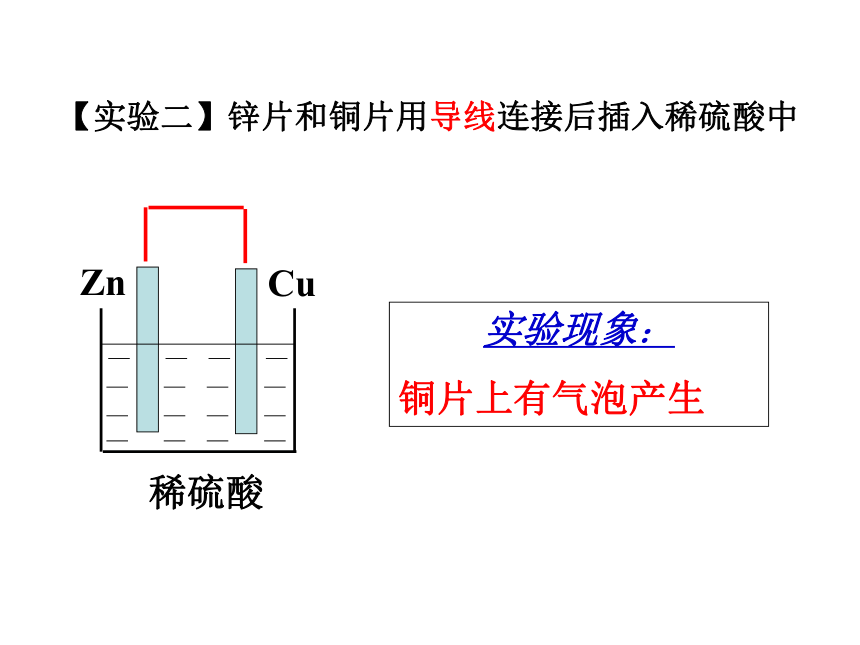
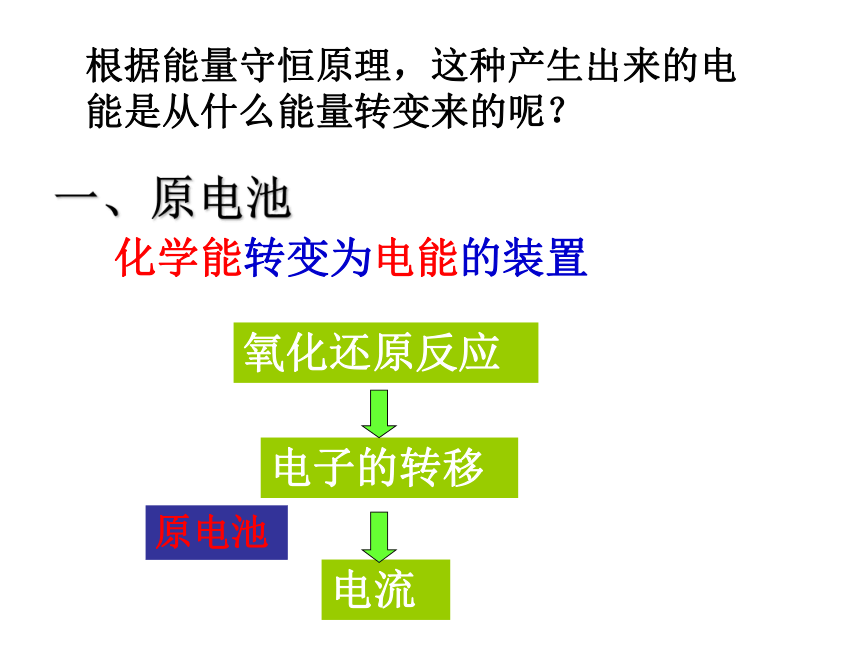
课件56张PPT。原电池原理 伏打电池的发明源于一个有趣的生物实验:在死去的青蛙腿上同时插入用导线连接着两种不同材料的电极,青蛙腿就像触电似的痉挛起来。你知道其中的奥秘吗?开 题你听说过伏打电池吗?【学生实验一】:将锌片、铜片插入稀硫酸,有何现象?锌片上有气泡产生原理:Zn + 2H+ = Zn2+ + H2↑2e-【实验二】锌片和铜片用导线连接后插入稀硫酸中实验现象:
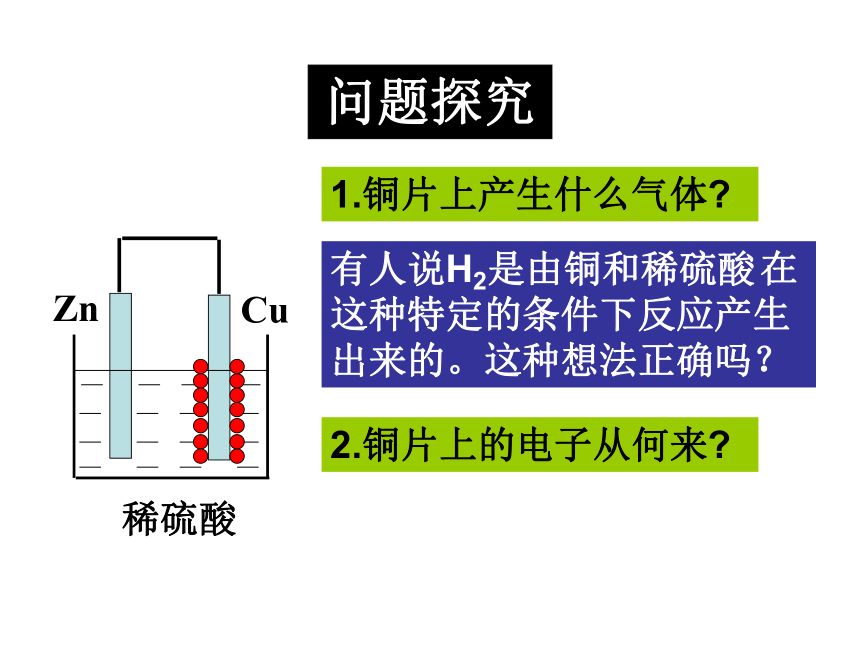
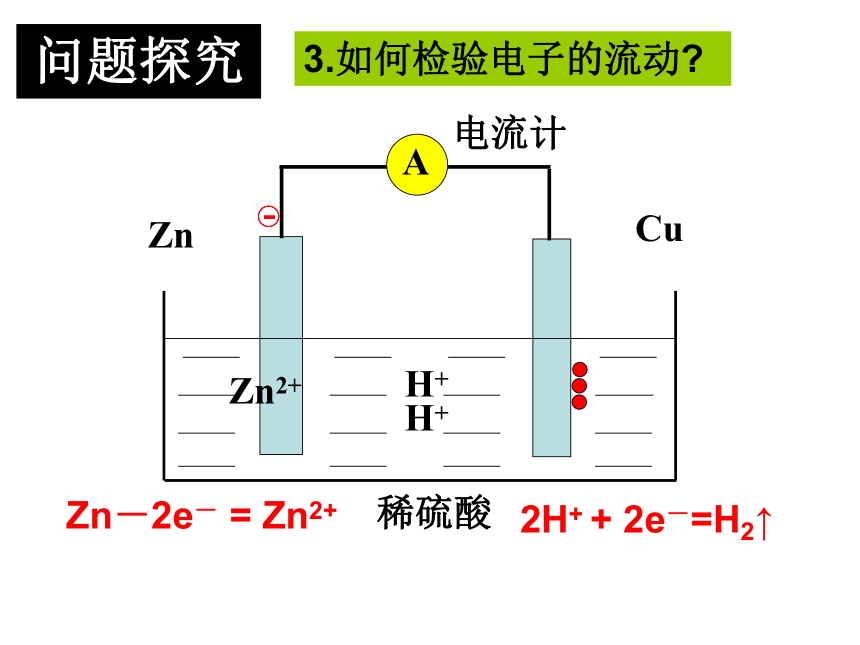
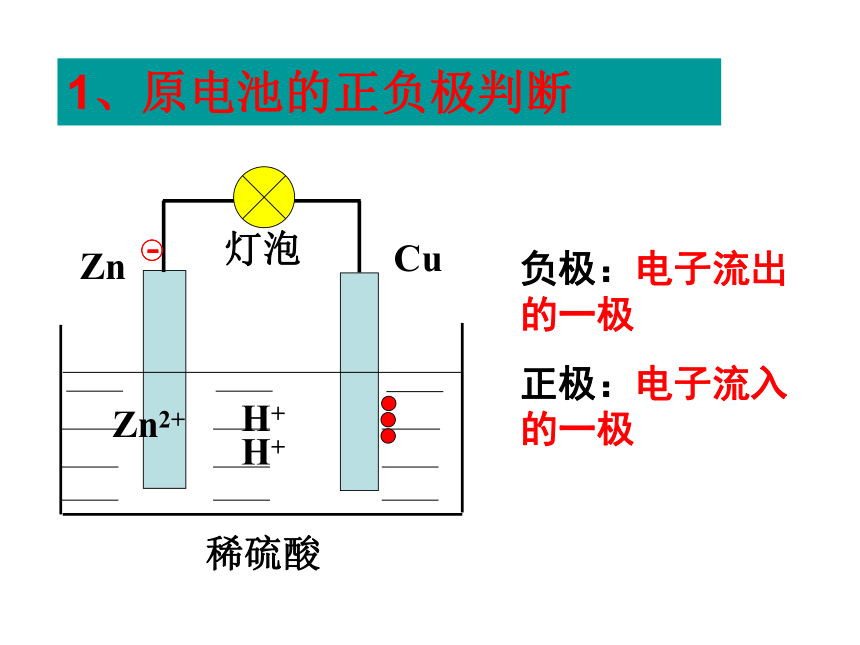
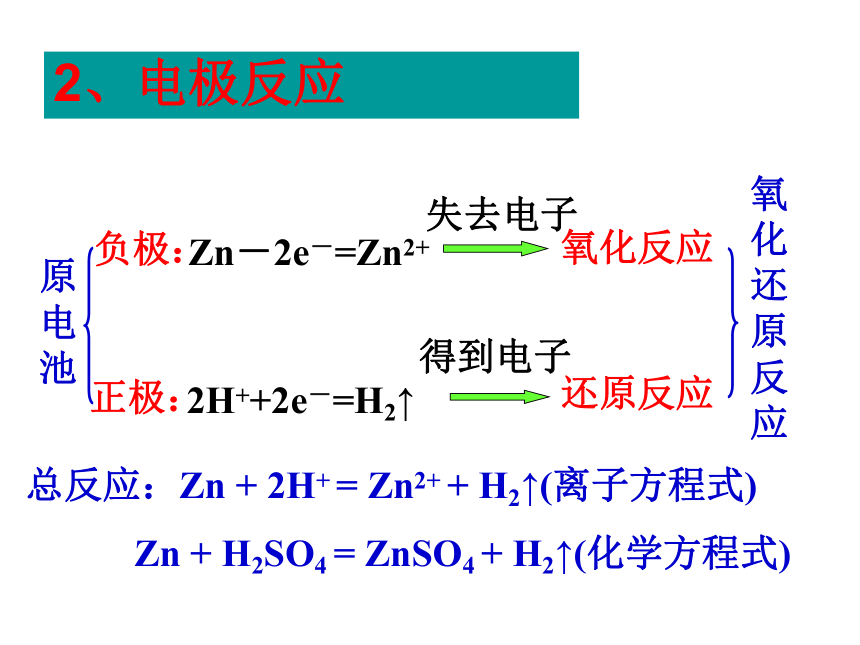
铜片上有气泡产生问题探究1.铜片上产生什么气体?有人说H2是由铜和稀硫酸 在这种特定的条件下反应产生出来的。这种想法正确吗?2.铜片上的电子从何来?CuZn 稀硫酸Zn2+H+H+电流计Zn-2e- = Zn2+2H+ + 2e-=H2↑ 3.如何检验电子的流动?问题探究 根据能量守恒原理,这种产生出来的电能是从什么能量转变来的呢?一、原电池化学能转变为电能的装置原电池电子的转移氧化还原反应电流CuZn 稀硫酸Zn2+H+H+灯泡1、原电池的正负极判断负极:电子流出的一极
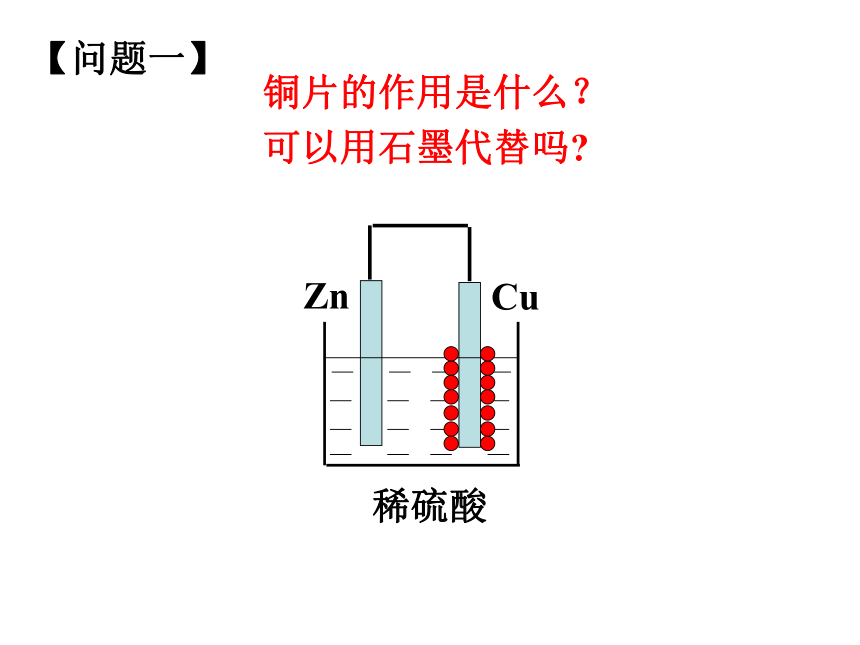
正极:电子流入的一极2、电极反应 2H++2e-=H2↑ 负极:Zn-2e-=Zn2+正极:原电池氧化反应还原反应氧化还原反应总反应:Zn + 2H+ = Zn2+ + H2↑(离子方程式)失去电子得到电子Zn + H2SO4 = ZnSO4 + H2↑(化学方程式)铜片的作用是什么?
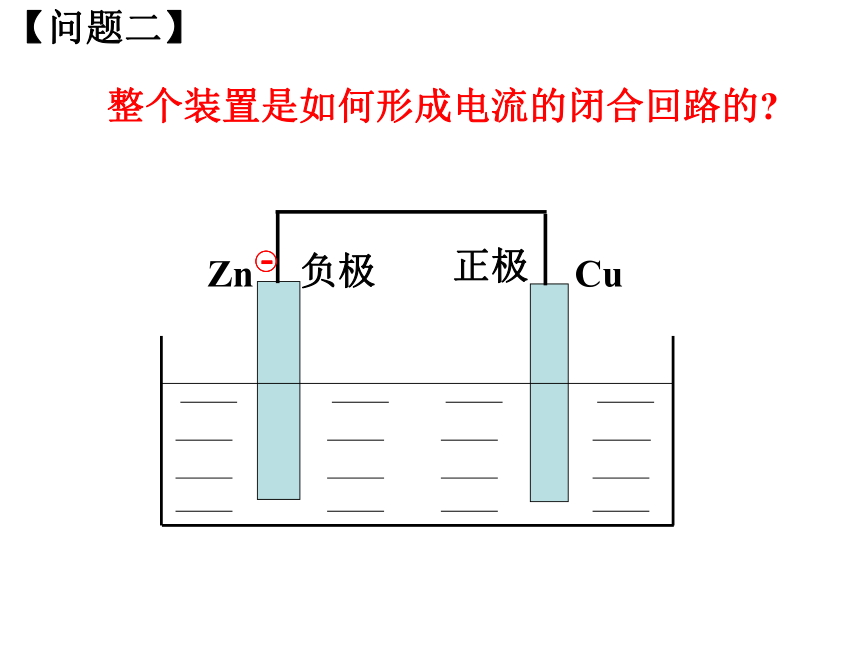
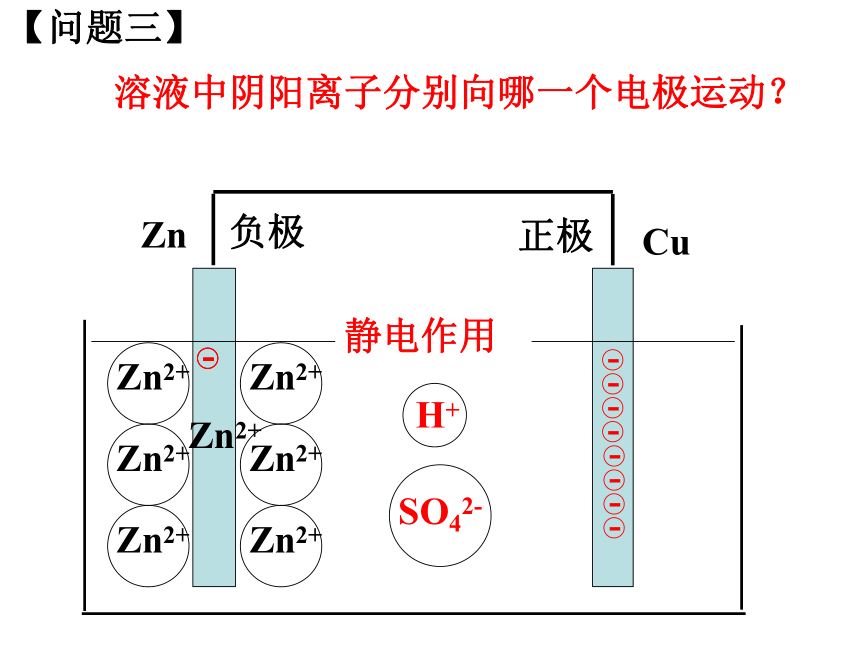
可以用石墨代替吗?【问题一】【问题二】CuZn整个装置是如何形成电流的闭合回路的?负极正极【问题三】CuZn溶液中阴阳离子分别向哪一个电极运动?Zn2+负极正极静电作用【问题四】CuZn有人说在铜锌原电池中,活泼金属失去电子,不活泼金属得到电子。这种说法正确吗?Zn2+负极正极Zn-2e-=Zn2+2H++2e-=H2↑ 【问题五】CuZn为什么H+在铜片上得到电子?Zn2+负极正极静电斥力静电引力CuZnZn2+H+H+Zn-2e-=Zn2+2H++2e-=H2↑ 氧化反应还原反应负极正极电子沿导线传递,产生电流阳离子失去电子溶液中阳离子得到电子阴离子正极负极SO42-原电池工作原理小结较活泼金属不活泼金属或石墨较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 【实验探究】:将铝片、石墨插入稀硫酸溶液中,是否可以形成原电池?石墨Al 稀硫酸(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。巩固练习1MgFe 稀硫酸(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。巩固练习2【实验探究】:将锌片、铜片插入硫酸铜溶液中,是否可以形成原电池?(1)说明两个电极质量的变化情况;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习3二、形成简单原电池的条件两种不同的金属 (或一种金属与石墨)作电极
用导线相连(或直接接触)
插入电解质溶液里,形成闭合回路
金属能与电解质溶液自动发生氧化还原反应1. 在如下图所示的8个装置中,属于原电池的有 .④ ⑥ ⑦e课堂练习:三、简单原电池的设计(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。
(2)判断正负极并写出电极反应。石墨FeFeCl3溶液负极(铁):
Fe-2e-=Fe2+
正极(石墨):
2Fe3+ + 2e-=3Fe2+干电池纽扣电池锂电池化学电源四.常见的化学电源●一次电池
●二次电池
●高能电池
●燃料电池锌-锰干电池四.常见的化学电源Ⅰ.干电池(一次电池)电极: Zn为负极,碳棒为正极电解液:NH4Cl、ZnCl2和淀粉糊另有黑色的MnO2粉末,吸收正极
产生的H2,防止产生极化现象。 负极(Zn):Zn-2e-=Zn2+
正极(C):2NH4+ + 2e-=2NH3+H2
H2 + 2MnO2 = Mn2O3+H2O 去氢
4NH3 + Zn2+ = [Zn(NH3)4]2+ 去氨电极方程式:四.常见的化学电源铅蓄电池电极:Pb为负极;PbO2为正极.电解液:30%的H2SO4溶液电极反应式:负极(Pb): Pb + SO42 -2e-=PbSO4正极(PbO2):PbO2 + 4H+ SO42- + 2e =PbSO4 +2H2O总电池反应:PbO2 + Pb +2H2SO4=2PbSO4↓+ 2H2O拓展创新Ⅱ.铅蓄电池(二次电池)(1.25~1.28g/cm-3)课堂练习:2.铅蓄电池(原电池)的电极分别是PbO2和Pb,电解质溶液为稀硫酸溶液,工作时原电池的总反应是: PbO2+Pb+2H2SO4=2PbSO4+2H2O. 根据上述反应,判断:
1)原电池的负极是(填电极材料)_______
2)工作时蓄电池负极反应式为___________
3)工作时蓄电池里电解质溶液的PH变化:______电极: Zn为负极,Ag2O为正极电解液: KOH溶液电极反应式:负极: Zn + 2OH- -2e- = Zn(OH)2正极: Ag2O + H2O + 2e- =2Ag + 2OH-总反应式: Zn + Ag2O + H2O = 2Ag + Zn(OH)2拓展创新银锌电池Ⅲ.高能电池(银锌电池、锂电池)电极: Pt制作的惰性电极电解质溶液: KOH溶液负极: 2H2 - 4e- + 4OH- =4H2O正极: O2 + 2H2O + 4e- =4OH- 总反应:2H2+ O2=2H2O拓展创新氢氧燃料电池若为酸性介质,试写出电极反应式?思考:负极:2H2 - 4e- = 4H+
正极: O2+ 4H+ + 4e- = 2H2OⅣ.新型燃料电池(氢氧燃料电池/甲烷电池/
煤气电池/海水-空气电池)铝-空气-海水电池 Ⅳ.新型燃料电池(氢氧燃料电池/甲烷电池/ 煤气电池/铝-海水-空气电池) 1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产电流。
负极:4A1-12e- = 4A13+
正极:3O2+6H2O+12e- =12OH-
电池总反应式为:4A1+3O2+6H2O=4A1(OH)3
这种海水电池比“干电池”的能量高20~50倍。甲烷-氧燃料电池 该电池用金属铂片插入KOH溶液中作电极,又在两极
上分别通甲烷和氧气:
负极:CH4 + 10OH- - 8e- = CO32- + 7H2O
正极:2O2 + 4H2O + 8e- = 8OH-
电池总反应式为:CH4+2O2+2KOH =K2CO3+3H2OⅣ.新型燃料电池(氢氧燃料电池/甲烷电池/
煤气电池/海水-空气电池)小结:①燃料电池的能量转化率很高,氢氧燃料电池 除能量转化率
高外还可持续使用,不污染环境。
②一般的可燃物均可与O2组成燃料电池,如H2、CO、CH4、乙醇等。
③燃料电池一般以碱性介质作电解液,也可用酸性介质作电
解液,二者电极上应式是有区别的。如甲烷-氧燃料电池在酸性介质中的电极反应为:
负极:CH4 + 2H2O - 8e- =CO2 + 8H+
正极:2O2 + 8H+ + 8e- = 4H2O
总反应式为:CH4 + 2O2 = CO2+2H2O五.原电池的应用(1)制作干电池、蓄电池、高能电池等。例1.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:
FeCl3+Cu=2FeCl2+CuCl2. 画出原电池的示意图并写出电极反应式.负极(铜):
Cu-2e-=Cu2+
正极(石墨):
2Fe3+ + 2e-=3Fe2+五.原电池的应用(2)比较金属活动性强弱。例2.下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极;A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;D.同价态的阳离子,甲比乙的氧化性强;(C)(3)比较反应速率
例3.下列制氢气的反应速率最快的是C.粗锌和 1mol/L 硫酸;A.纯锌和1mol/L 硫酸;B.纯锌和18 mol/L 硫酸;D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。( D )(4)比较金属腐蚀的快慢例4.下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)(5)判断溶液pH值变化例6.在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为__________ mol,溶液的pH值为_________?(溶液体积变化忽略不计)0.2解得:y =0.015 (mol)x =0.015 (mol)==3.75× 10﹣ 4(mol/L )∴pH =-lg3.75 ×10-4=4 -lg3.75 答:……-0.015根据电极反应:正极:负极:Zn-2e-=Zn2+2H++2e- =H2↑得:2 2 22.4x y 0.168解:0.2×0.125×2c(H+)余∴2H+ —— 2e——H2↑4 -lg3.750.015六.金属的腐蚀和防护(1)判断下列装置是否为原电池?若是, 指出电极名称并写出电极反应式。(2)若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?若是,电极反应是什么?长期放置,铁棒表面会有什么变化?(4)钢铁腐蚀的本质是什么?什么是钢铁的析氢腐蚀和吸氧腐蚀?为什么常以后者为主?(5)生产上常采取哪些金属防腐措施?(3)钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或浓度较大的环境里长期放置,常易生锈变红,原因是什么?钢铁表面形成的微小原电池示意图钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图知识总结1、2、金属阳离子失e-氧化反应金属腐蚀的类型化学腐蚀电化腐蚀析氢腐蚀吸氧腐蚀(常见普遍)㈠.金属腐蚀金属原子金属腐蚀的本质:3、金属腐蚀:是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。4.钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。析氢腐蚀吸氧腐蚀条件水膜呈酸性。水膜呈中性或酸性很弱。CO2+H2O?H2CO3 ? H++HCO 3- 电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2+↑2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3联系㈡钢铁腐蚀的防护:例6:改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。⒈A.C.铜的金属活动性比氢小,因此不宜被氧化;B.D.它们的表面都电镀上了一层耐腐蚀的黄金;2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;( D )它们是含一定比例金、银、锡、锌的合金;2.金属表面覆盖保护层3.电化学保护法原理:原理 :如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化
物薄膜)作保护层。隔绝金属与外界空气、电解质溶液的接触。——牺牲阳极的阴极保护法形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。牺牲阳极的阴极保护法示意图练 习1。 如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极: ; 若液面下降,则溶液呈 性,发生
腐蚀,电极反应式为:负极:
正极: 。(2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 2、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是Cd(OH)2+2Ni(OH)2放电充电A. Cd, ( D )B. NiO(OH), D. Ni(OH)2C. Cd(OH)22Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+4.盐酸与锌片反应时,若加入可溶性醋酸铜
〔(CH3COO)2Cu〕,将产生两种影响生成速率的因素,其
一是: ,
其二是:
;5.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率。Zn置换出Cu形成了原电池,从而加快了反应速率4.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)原电池小结定义形成条件正负极名称和电子流向判断工作原理(氧还反应,熟写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢判断溶液pH变化金属的腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(三点记住)
铜片上有气泡产生问题探究1.铜片上产生什么气体?有人说H2是由铜和稀硫酸 在这种特定的条件下反应产生出来的。这种想法正确吗?2.铜片上的电子从何来?CuZn 稀硫酸Zn2+H+H+电流计Zn-2e- = Zn2+2H+ + 2e-=H2↑ 3.如何检验电子的流动?问题探究 根据能量守恒原理,这种产生出来的电能是从什么能量转变来的呢?一、原电池化学能转变为电能的装置原电池电子的转移氧化还原反应电流CuZn 稀硫酸Zn2+H+H+灯泡1、原电池的正负极判断负极:电子流出的一极
正极:电子流入的一极2、电极反应 2H++2e-=H2↑ 负极:Zn-2e-=Zn2+正极:原电池氧化反应还原反应氧化还原反应总反应:Zn + 2H+ = Zn2+ + H2↑(离子方程式)失去电子得到电子Zn + H2SO4 = ZnSO4 + H2↑(化学方程式)铜片的作用是什么?
可以用石墨代替吗?【问题一】【问题二】CuZn整个装置是如何形成电流的闭合回路的?负极正极【问题三】CuZn溶液中阴阳离子分别向哪一个电极运动?Zn2+负极正极静电作用【问题四】CuZn有人说在铜锌原电池中,活泼金属失去电子,不活泼金属得到电子。这种说法正确吗?Zn2+负极正极Zn-2e-=Zn2+2H++2e-=H2↑ 【问题五】CuZn为什么H+在铜片上得到电子?Zn2+负极正极静电斥力静电引力CuZnZn2+H+H+Zn-2e-=Zn2+2H++2e-=H2↑ 氧化反应还原反应负极正极电子沿导线传递,产生电流阳离子失去电子溶液中阳离子得到电子阴离子正极负极SO42-原电池工作原理小结较活泼金属不活泼金属或石墨较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 【实验探究】:将铝片、石墨插入稀硫酸溶液中,是否可以形成原电池?石墨Al 稀硫酸(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。巩固练习1MgFe 稀硫酸(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。巩固练习2【实验探究】:将锌片、铜片插入硫酸铜溶液中,是否可以形成原电池?(1)说明两个电极质量的变化情况;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习3二、形成简单原电池的条件两种不同的金属 (或一种金属与石墨)作电极
用导线相连(或直接接触)
插入电解质溶液里,形成闭合回路
金属能与电解质溶液自动发生氧化还原反应1. 在如下图所示的8个装置中,属于原电池的有 .④ ⑥ ⑦e课堂练习:三、简单原电池的设计(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。
(2)判断正负极并写出电极反应。石墨FeFeCl3溶液负极(铁):
Fe-2e-=Fe2+
正极(石墨):
2Fe3+ + 2e-=3Fe2+干电池纽扣电池锂电池化学电源四.常见的化学电源●一次电池
●二次电池
●高能电池
●燃料电池锌-锰干电池四.常见的化学电源Ⅰ.干电池(一次电池)电极: Zn为负极,碳棒为正极电解液:NH4Cl、ZnCl2和淀粉糊另有黑色的MnO2粉末,吸收正极
产生的H2,防止产生极化现象。 负极(Zn):Zn-2e-=Zn2+
正极(C):2NH4+ + 2e-=2NH3+H2
H2 + 2MnO2 = Mn2O3+H2O 去氢
4NH3 + Zn2+ = [Zn(NH3)4]2+ 去氨电极方程式:四.常见的化学电源铅蓄电池电极:Pb为负极;PbO2为正极.电解液:30%的H2SO4溶液电极反应式:负极(Pb): Pb + SO42 -2e-=PbSO4正极(PbO2):PbO2 + 4H+ SO42- + 2e =PbSO4 +2H2O总电池反应:PbO2 + Pb +2H2SO4=2PbSO4↓+ 2H2O拓展创新Ⅱ.铅蓄电池(二次电池)(1.25~1.28g/cm-3)课堂练习:2.铅蓄电池(原电池)的电极分别是PbO2和Pb,电解质溶液为稀硫酸溶液,工作时原电池的总反应是: PbO2+Pb+2H2SO4=2PbSO4+2H2O. 根据上述反应,判断:
1)原电池的负极是(填电极材料)_______
2)工作时蓄电池负极反应式为___________
3)工作时蓄电池里电解质溶液的PH变化:______电极: Zn为负极,Ag2O为正极电解液: KOH溶液电极反应式:负极: Zn + 2OH- -2e- = Zn(OH)2正极: Ag2O + H2O + 2e- =2Ag + 2OH-总反应式: Zn + Ag2O + H2O = 2Ag + Zn(OH)2拓展创新银锌电池Ⅲ.高能电池(银锌电池、锂电池)电极: Pt制作的惰性电极电解质溶液: KOH溶液负极: 2H2 - 4e- + 4OH- =4H2O正极: O2 + 2H2O + 4e- =4OH- 总反应:2H2+ O2=2H2O拓展创新氢氧燃料电池若为酸性介质,试写出电极反应式?思考:负极:2H2 - 4e- = 4H+
正极: O2+ 4H+ + 4e- = 2H2OⅣ.新型燃料电池(氢氧燃料电池/甲烷电池/
煤气电池/海水-空气电池)铝-空气-海水电池 Ⅳ.新型燃料电池(氢氧燃料电池/甲烷电池/ 煤气电池/铝-海水-空气电池) 1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产电流。
负极:4A1-12e- = 4A13+
正极:3O2+6H2O+12e- =12OH-
电池总反应式为:4A1+3O2+6H2O=4A1(OH)3
这种海水电池比“干电池”的能量高20~50倍。甲烷-氧燃料电池 该电池用金属铂片插入KOH溶液中作电极,又在两极
上分别通甲烷和氧气:
负极:CH4 + 10OH- - 8e- = CO32- + 7H2O
正极:2O2 + 4H2O + 8e- = 8OH-
电池总反应式为:CH4+2O2+2KOH =K2CO3+3H2OⅣ.新型燃料电池(氢氧燃料电池/甲烷电池/
煤气电池/海水-空气电池)小结:①燃料电池的能量转化率很高,氢氧燃料电池 除能量转化率
高外还可持续使用,不污染环境。
②一般的可燃物均可与O2组成燃料电池,如H2、CO、CH4、乙醇等。
③燃料电池一般以碱性介质作电解液,也可用酸性介质作电
解液,二者电极上应式是有区别的。如甲烷-氧燃料电池在酸性介质中的电极反应为:
负极:CH4 + 2H2O - 8e- =CO2 + 8H+
正极:2O2 + 8H+ + 8e- = 4H2O
总反应式为:CH4 + 2O2 = CO2+2H2O五.原电池的应用(1)制作干电池、蓄电池、高能电池等。例1.选择适宜的材料和试剂设计一个原电池,以便完成下列反应:
FeCl3+Cu=2FeCl2+CuCl2. 画出原电池的示意图并写出电极反应式.负极(铜):
Cu-2e-=Cu2+
正极(石墨):
2Fe3+ + 2e-=3Fe2+五.原电池的应用(2)比较金属活动性强弱。例2.下列叙述中,可以说明金属甲比乙活泼性强的是C.将甲乙作电极组成原电池时甲是负极;A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;B.在氧化–还原反应中,甲比乙失去的电子多;D.同价态的阳离子,甲比乙的氧化性强;(C)(3)比较反应速率
例3.下列制氢气的反应速率最快的是C.粗锌和 1mol/L 硫酸;A.纯锌和1mol/L 硫酸;B.纯锌和18 mol/L 硫酸;D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。( D )(4)比较金属腐蚀的快慢例4.下列各情况,在其中Fe片腐蚀由快到慢的顺序是(5)(2)(1)(3)(4)(5)判断溶液pH值变化例6.在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间后,从装置中共收集到 0.168L升气体,则流过导线的电子为__________ mol,溶液的pH值为_________?(溶液体积变化忽略不计)0.2解得:y =0.015 (mol)x =0.015 (mol)==3.75× 10﹣ 4(mol/L )∴pH =-lg3.75 ×10-4=4 -lg3.75 答:……-0.015根据电极反应:正极:负极:Zn-2e-=Zn2+2H++2e- =H2↑得:2 2 22.4x y 0.168解:0.2×0.125×2c(H+)余∴2H+ —— 2e——H2↑4 -lg3.750.015六.金属的腐蚀和防护(1)判断下列装置是否为原电池?若是, 指出电极名称并写出电极反应式。(2)若将Fe棒C棒粉碎掺在一起制成一光亮的Fe-C合金棒,插在HCl里,则是否构成了原电池?若是,电极反应是什么?长期放置,铁棒表面会有什么变化?(4)钢铁腐蚀的本质是什么?什么是钢铁的析氢腐蚀和吸氧腐蚀?为什么常以后者为主?(5)生产上常采取哪些金属防腐措施?(3)钢铁及其制品通常为含碳的铁合金,若在潮湿的环境里或浓度较大的环境里长期放置,常易生锈变红,原因是什么?钢铁表面形成的微小原电池示意图钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图知识总结1、2、金属阳离子失e-氧化反应金属腐蚀的类型化学腐蚀电化腐蚀析氢腐蚀吸氧腐蚀(常见普遍)㈠.金属腐蚀金属原子金属腐蚀的本质:3、金属腐蚀:是指金属或合金跟接触的气体或液体发生化学反应(氧化—还原)而腐蚀损耗的过程。4.钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O(铁锈)通常两种腐蚀同时存在,但以后者更普遍。析氢腐蚀吸氧腐蚀条件水膜呈酸性。水膜呈中性或酸性很弱。CO2+H2O?H2CO3 ? H++HCO 3- 电极反应负极Fe(- )Fe-2e=Fe2+2Fe-4e=2Fe2+正极C(+)2H++2e=H2↑O2+2H2O+4e=4OH-总反应:Fe+2H+=Fe2+↑2Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3联系㈡钢铁腐蚀的防护:例6:改变金属的内部组织结构:如将Cr、Ni等金属加进钢里制成合金钢。⒈A.C.铜的金属活动性比氢小,因此不宜被氧化;B.D.它们的表面都电镀上了一层耐腐蚀的黄金;2000年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首,普通铜器时间稍久容易出现铜绿,其主要成分是[Cu2(OH)2CO3]这三件1760年铜铸的国宝在240 年后看上去仍然熠熠生辉不生锈,下列对起原因的分析,最可能的是环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去;( D )它们是含一定比例金、银、锡、锌的合金;2.金属表面覆盖保护层3.电化学保护法原理:原理 :如油漆、油脂等,电镀(Zn,Cr等易氧化形成致密的氧化
物薄膜)作保护层。隔绝金属与外界空气、电解质溶液的接触。——牺牲阳极的阴极保护法形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应受到腐蚀。牺牲阳极的阴极保护法示意图练 习1。 如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生
腐蚀,电极反应式为:负极: ,
正极: ; 若液面下降,则溶液呈 性,发生
腐蚀,电极反应式为:负极:
正极: 。(2)中性或碱性 吸氧Fe–2e-=Fe2+O2+2H2O+4e-=4OH-酸性析氢Fe–2e-=Fe2+2H++2e-=H2↑ 2、分析右图,按要求写出有关反应方程式:
(1)、铁棒上的电极反应式为:
(2)、碳棒上的电极反应式为:
(3)、溶液中发生反应的化学方程式:
3、镍—镉可充电电池可发生如下反应:Cd+2NiO(OH)+2H2O由此可知,该电池的负极材料是Cd(OH)2+2Ni(OH)2放电充电A. Cd, ( D )B. NiO(OH), D. Ni(OH)2C. Cd(OH)22Fe+2H2O+O2= 2 Fe(OH)24Fe(OH)2+2H2O+O2=4Fe(OH)3O2+2H2O+4e-=4OH-2Fe–4e-=2Fe2+4.盐酸与锌片反应时,若加入可溶性醋酸铜
〔(CH3COO)2Cu〕,将产生两种影响生成速率的因素,其
一是: ,
其二是:
;5.有M、N两种金属,分别与盐酸反应,产生H2速率相近,试设计一个实验比较M、N两种金属的活泼性。H+与CH3COO-结合生成CH3COOH,使H+浓度减小,从而减慢了反应速率。Zn置换出Cu形成了原电池,从而加快了反应速率4.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是(4)(2)(1)(3)原电池小结定义形成条件正负极名称和电子流向判断工作原理(氧还反应,熟写电极反应式)应用分析各种电池。比较金属活动性强弱比较反应速率比较金属腐蚀的快慢判断溶液pH变化金属的腐蚀和防护原电池腐蚀(定义、本质、类型)腐蚀防护(常见三种方法)(从活泼性比较、电子得失、氧还反应等多角度判断)题型(三点记住)
