原电池[上学期]
图片预览





文档简介
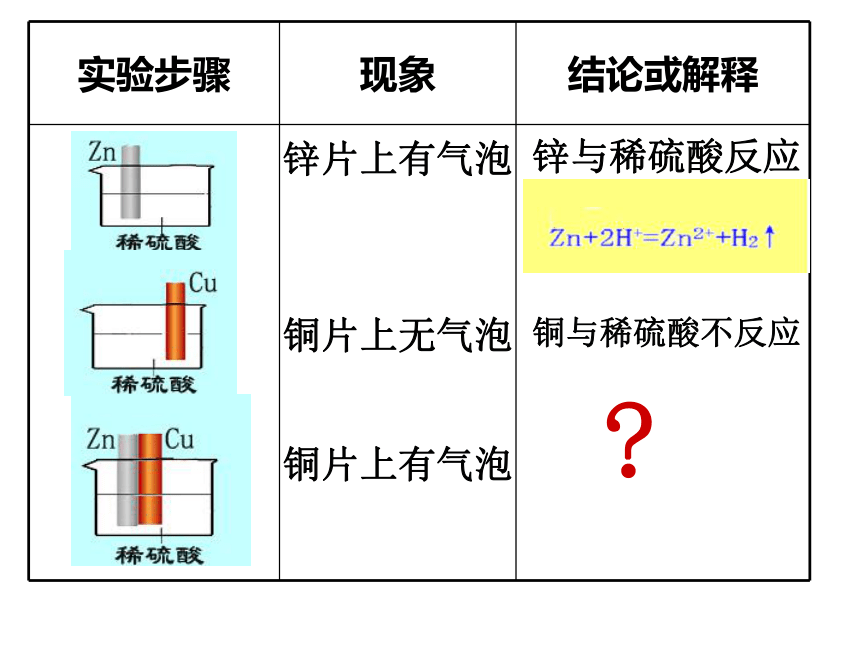
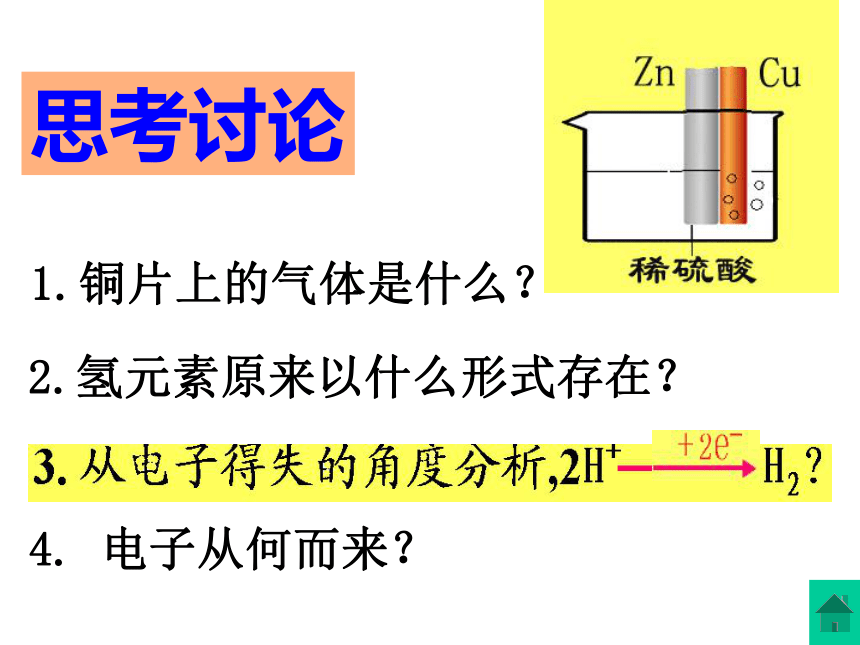
课件22张PPT。原电池原理及其应用兴化市文正实验学校 杨学军锌片上有气泡锌与稀硫酸反应铜片上有气泡铜与稀硫酸不反应?铜片上无气泡1.铜片上的气体是什么? 2.氢元素原来以什么形式存在?思考讨论 4. 电子从何而来?原电池形成的实质:
氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。Zn+2H+=Zn2++H2↑氧化反应还原反应实验探究一:原电池的电极材料负极:较活泼的金属
正极:较不活泼的金属、石墨等导体实验用品:Zn片、Fe片、石墨、电线、电流计、稀硫酸结论一:实验探究二:形成原电池的条件结论二、两极之间充入电解液试一试:若能形成原电池,请你写出总的离子方程式及两电极反式。
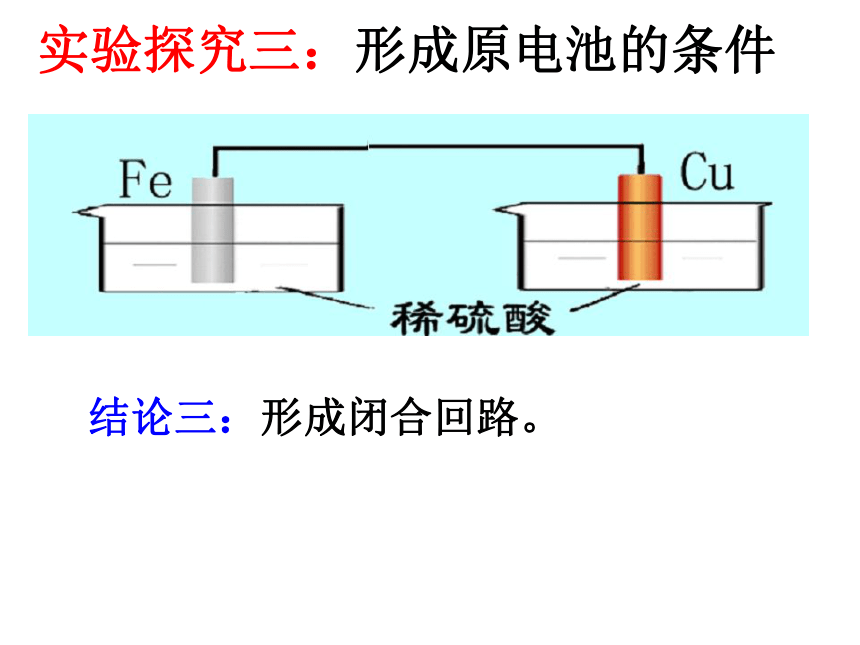
(aq)实验探究三:形成原电池的条件结论三:形成闭合回路。 思考:有下列材料: Zn片、Cu片、导线、西红柿,根据构成原电池的条件,请大家推断一下能否组成原电池?
ZnCuZnCuABCDEF√例题:下列哪些装置能构成原电池?√1、原电池的反应原理2、电极反应
式的书写找出两极放电的物质分析放电后的产物是否
与溶液中的溶质反应3、原电池电
极的判断负极--失电子发生氧化
反应的电极正极—得电子发生还原
反应的电极发生氧化还原反应原电池原理电子流出电子流入化学能转化为电能定向移动方向:电子、离子原电池“负极出电子,电子回正极”必发生
失电子
的
氧化反应必发生
得电子
的
还原反应构成原电池条件①自发的氧化还原反应
②有电解质溶液
有活性不同的两极
③有闭合回路
例1、Cu、Fe作两极,稀硫酸作电解质溶液的原电池中:①Cu作____极, ②Fe作____极
电极反应式是:负极____________
正极_____________
总反应式是___________________________
如将稀硫酸改为浓硝酸则:
①Cu作____极, ②Fe作____极
电极反应式是:负极____________
正极_____________________
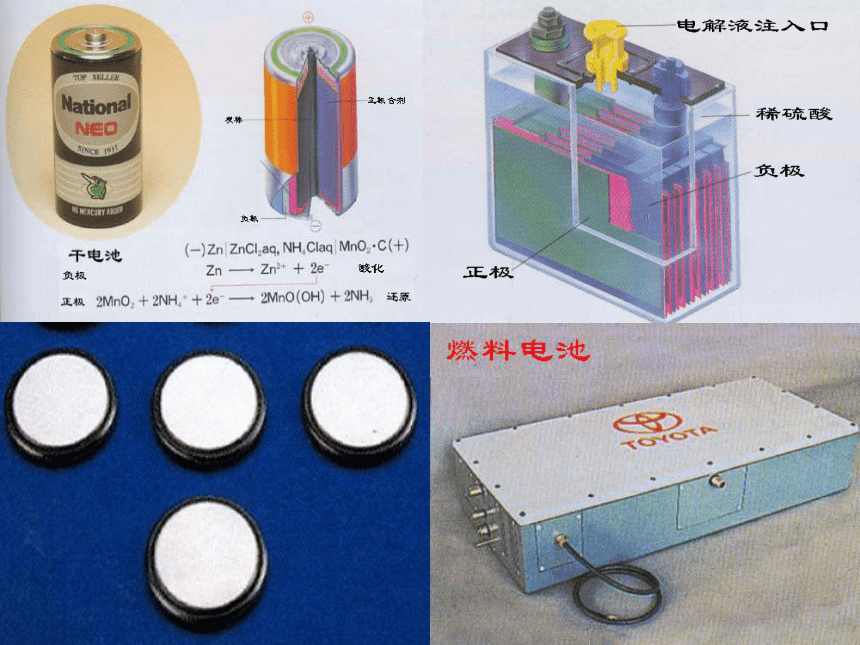
总反应式是_______________________________Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O正负Fe-2e-=Fe2+2H++2e-=H2↑Fe+H2SO4=FeSO4+H2↑负正Cu-2e-=Cu2+ 2NO3-+4H++2e-==2NO2 ↑ +2H2O常见电池和新型电池示例 化学电源负极(锌筒) :Zn-2e-=Zn 2+ 正极(石墨) : 2NH4+ +2e-= 2NH3↑+ 2H2↑ 总反应:Zn+2NH4+=Zn 2++2NH3↑+2H2↑ 1、锌-锰干电池常用电池的电极反应和电池总反应式书写2NH4++2MnO2 + 2e—=2NH3↑+Mn2O3+H2OZn+2NH4++2MnO2= Zn2++2NH3↑+Mn2O3+H2O2、铅蓄电池负极Pb: Pb+ SO42- -2e- = PbSO4正极PbO2: PbO2+4H+ + SO42- +2e- =PbSO4+2H2O总反应:钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO3、银-锌电池负极: Zn+ 2OH- -2e- =ZnO+H2O 正极: Ag2O+ H2O +2e- =2Ag+ 2OH- 总反应: Ag2O+ Zn =ZnO+ 2Ag4、锂电池(非水有机溶剂电解液)负极:2Li - 2e—=2Li+,正极:I2+2e—=2I—
总反应:2Li+I2=2LiI
跟相同质量的其它金属作负极相比,使用寿命延长,高能、质轻、电压高、工作效率高、储存寿命长。
5、燃料电池负极H2:2H2+4OH- -4e- =4H2O 正极O2:O2+2H2O +4e- =4OH- 总反应: O2+2H2 =2H2O氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。6、海水电池(电解质溶液为海水)
负极: 4Al-12e—=4Al3+,
正极: 3O2+6H2O+12e—=12OH—
总反应:4Al+3O2+6H2O=4Al(OH)3原电池电极反应式的书写注意事项:
(1)负氧正还。
(2)要注意溶液的酸碱性,适当的在电极方程式两边添加H+、OH—、H2O,以遵循电荷守恒和质量守恒。
(3)要注意电极反应产物是否与电解质溶液发生反应。
小结
氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。Zn+2H+=Zn2++H2↑氧化反应还原反应实验探究一:原电池的电极材料负极:较活泼的金属
正极:较不活泼的金属、石墨等导体实验用品:Zn片、Fe片、石墨、电线、电流计、稀硫酸结论一:实验探究二:形成原电池的条件结论二、两极之间充入电解液试一试:若能形成原电池,请你写出总的离子方程式及两电极反式。
(aq)实验探究三:形成原电池的条件结论三:形成闭合回路。 思考:有下列材料: Zn片、Cu片、导线、西红柿,根据构成原电池的条件,请大家推断一下能否组成原电池?
ZnCuZnCuABCDEF√例题:下列哪些装置能构成原电池?√1、原电池的反应原理2、电极反应
式的书写找出两极放电的物质分析放电后的产物是否
与溶液中的溶质反应3、原电池电
极的判断负极--失电子发生氧化
反应的电极正极—得电子发生还原
反应的电极发生氧化还原反应原电池原理电子流出电子流入化学能转化为电能定向移动方向:电子、离子原电池“负极出电子,电子回正极”必发生
失电子
的
氧化反应必发生
得电子
的
还原反应构成原电池条件①自发的氧化还原反应
②有电解质溶液
有活性不同的两极
③有闭合回路
例1、Cu、Fe作两极,稀硫酸作电解质溶液的原电池中:①Cu作____极, ②Fe作____极
电极反应式是:负极____________
正极_____________
总反应式是___________________________
如将稀硫酸改为浓硝酸则:
①Cu作____极, ②Fe作____极
电极反应式是:负极____________
正极_____________________
总反应式是_______________________________Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O正负Fe-2e-=Fe2+2H++2e-=H2↑Fe+H2SO4=FeSO4+H2↑负正Cu-2e-=Cu2+ 2NO3-+4H++2e-==2NO2 ↑ +2H2O常见电池和新型电池示例 化学电源负极(锌筒) :Zn-2e-=Zn 2+ 正极(石墨) : 2NH4+ +2e-= 2NH3↑+ 2H2↑ 总反应:Zn+2NH4+=Zn 2++2NH3↑+2H2↑ 1、锌-锰干电池常用电池的电极反应和电池总反应式书写2NH4++2MnO2 + 2e—=2NH3↑+Mn2O3+H2OZn+2NH4++2MnO2= Zn2++2NH3↑+Mn2O3+H2O2、铅蓄电池负极Pb: Pb+ SO42- -2e- = PbSO4正极PbO2: PbO2+4H+ + SO42- +2e- =PbSO4+2H2O总反应:钮扣电池:不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH溶液,已知电池内Zn的氧化产物为ZnO3、银-锌电池负极: Zn+ 2OH- -2e- =ZnO+H2O 正极: Ag2O+ H2O +2e- =2Ag+ 2OH- 总反应: Ag2O+ Zn =ZnO+ 2Ag4、锂电池(非水有机溶剂电解液)负极:2Li - 2e—=2Li+,正极:I2+2e—=2I—
总反应:2Li+I2=2LiI
跟相同质量的其它金属作负极相比,使用寿命延长,高能、质轻、电压高、工作效率高、储存寿命长。
5、燃料电池负极H2:2H2+4OH- -4e- =4H2O 正极O2:O2+2H2O +4e- =4OH- 总反应: O2+2H2 =2H2O氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。6、海水电池(电解质溶液为海水)
负极: 4Al-12e—=4Al3+,
正极: 3O2+6H2O+12e—=12OH—
总反应:4Al+3O2+6H2O=4Al(OH)3原电池电极反应式的书写注意事项:
(1)负氧正还。
(2)要注意溶液的酸碱性,适当的在电极方程式两边添加H+、OH—、H2O,以遵循电荷守恒和质量守恒。
(3)要注意电极反应产物是否与电解质溶液发生反应。
小结
