新课程选修4第四章《原电池》[下学期]
文档属性
| 名称 | 新课程选修4第四章《原电池》[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-06 10:18:00 | ||
图片预览








文档简介
课件32张PPT。原 电 池 从 化 中 学 祝 小 兵 1780年意大利著名生物学家伽伐尼。解剖青蛙时,已死去的青蛙竟然发生了抽搐。伽伐尼做了如下实验:
实验1: 用一枝铜钩插入死青蛙的脊髓中,再挂在铁栏杆上,当青蛙腿碰到铁栏杆时,就发生颤抖。
实验2:将青蛙放到铜制的解剖盘里,当解剖刀接触蛙腿时,蛙腿发生抽搐
他根据实验得出:青蛙自身肌肉和神经里的“生物电”是导致抽搐的原因。1791年,伽伐尼发表了《论肌肉中的生物电》论文,引起广泛关注。 阅读材料 善于质疑的意大利物理学家伏打,提出了疑问:为什么只有青蛙腿和铜器和铁器接触时才发生抽搐?实验如下:
实验1:将青蛙腿放在铜盘里,用解剖刀去接触,蛙腿抽搐
实验2:将青蛙腿放在木盘里,用解剖刀去接触,蛙腿不动
伏打用实验推翻了伽伐尼的结论,认为要有两种活泼性不同的金属同时接触蛙腿,蛙腿就会抽搐。
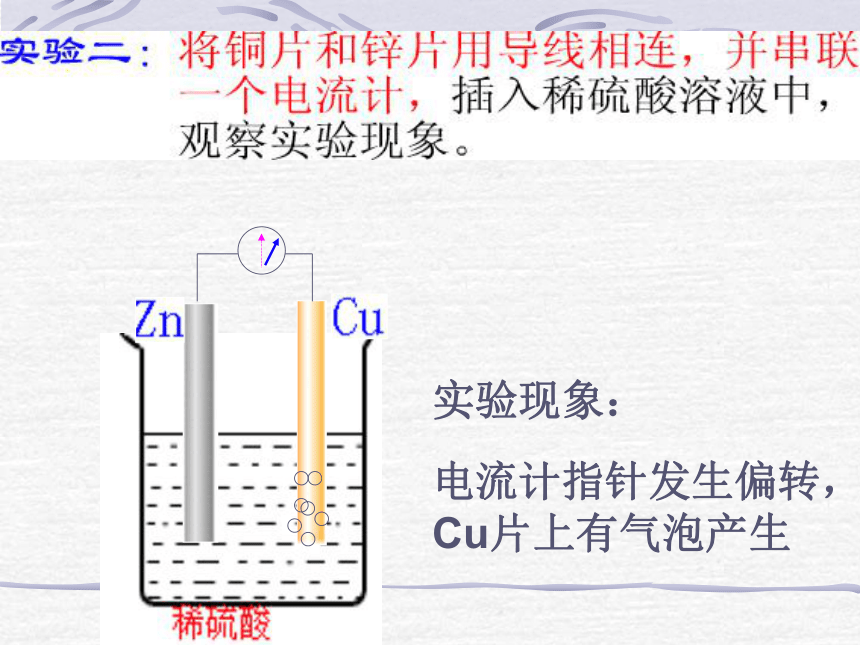
联想到肌肉、神经保存在类似生理盐水的溶液中,那么,生理盐水与活泼性不同的金属作用会不会产生电流呢?实验现象:锌片上有气泡产生
而铜片上没有实验现象:电流计指针发生偏转,
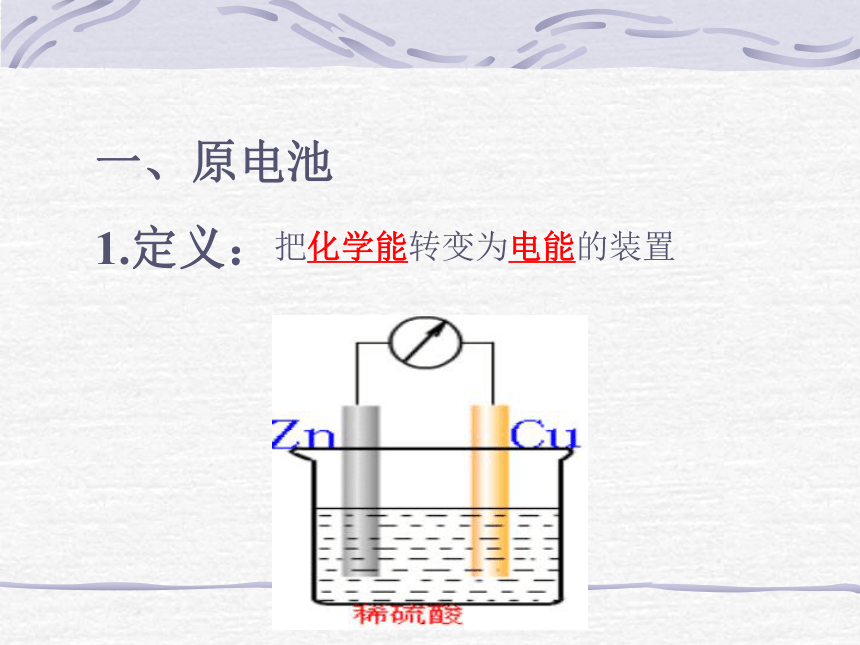
Cu片上有气泡产生一、原电池
1.定义:把化学能转变为电能的装置电极反应式:2、原电池工作原理较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电
路流向较不活泼的金属(正极) 。原电池的工作原理较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 电子流向:
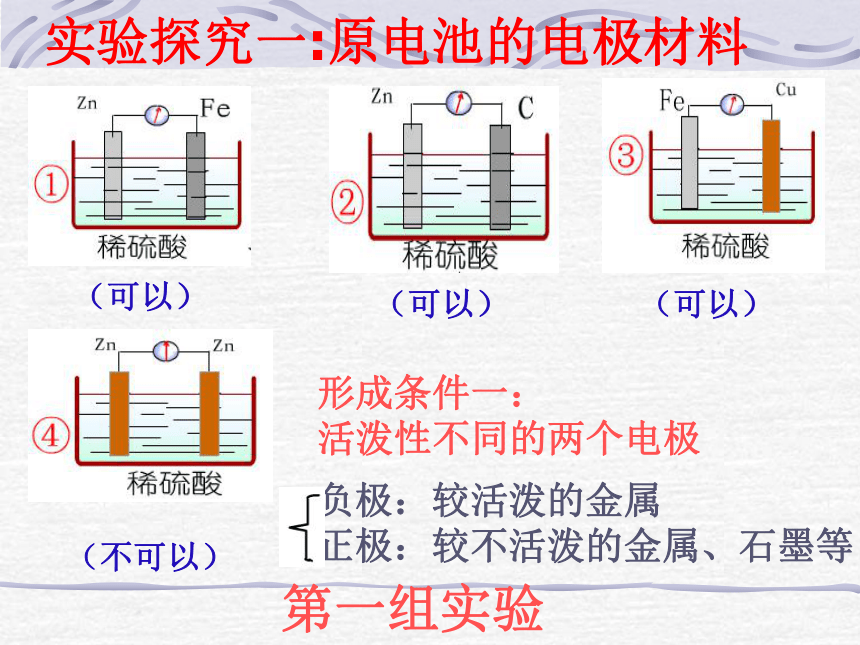
负极 正极导线(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
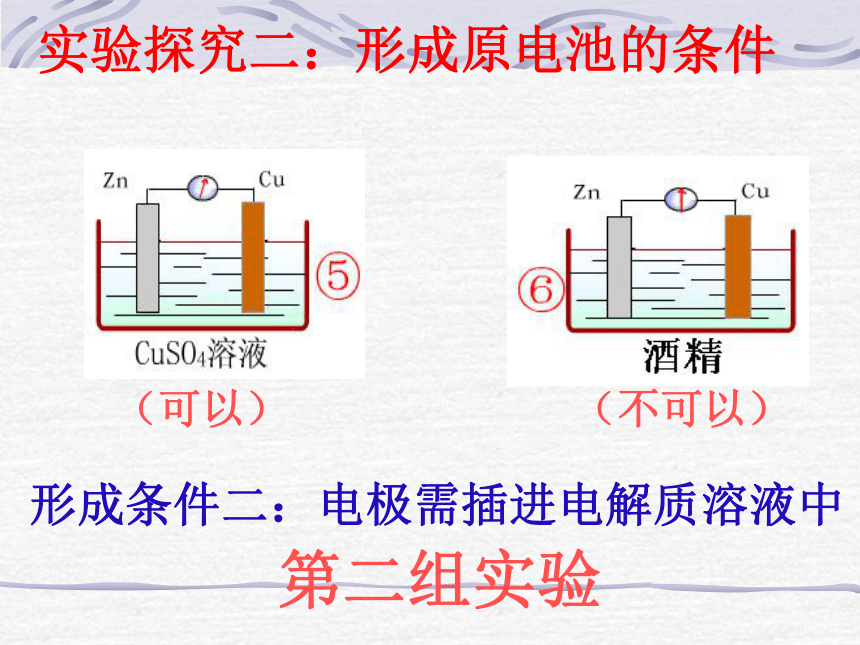
正极:较不活泼的金属、石墨等第一组实验实验探究一:原电池的电极材料(可以)(不可以)形成条件二:电极需插进电解质溶液中第二组实验实验探究二:形成原电池的条件第三组实验形成条件三:必须形成闭合回路(不可以)实验探究三:形成原电池的条件组成原电池的条件有两种活泼性不同的金属(或一种是非金属导体)作电极
电电极材料均插入电解质溶液中
两电极相连形成闭合电路原电池形成的实质:
氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。氧化反应还原反应你知道了吗
1.图中所示装置属于原电池的是( ).C D 2、把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B3.X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为_________________Z>Y>X>W答案:B: 负极: Zn-2e-=Zn2+
正极: Cu2++ 2e-=Cu3. 实验室制取氢气选用纯锌粒好还是选用粗锌好?为什么?选用粗锌较好利用锌与其中的不活泼杂质形成原电池以加速反应进行。[练习] 铅蓄电池放电时的总反应方程式为:
PbO2+Pb+2H2SO4 2PbSO4+2H2O
据此判断其正极是 ,负极是 ,电解质溶液是 ,正极反应是 ,负极反应是 。当转移0.5NA个电子,蓄电池内消耗H2SO4的物质的量为 。PbO2PbH2SO4PbO2+ SO42-+ 4H++2e- =PbSO4+2H2OPb+ SO42--2e- =PbSO40.5mol你记住了吗?
本课时重点学习了原电池的工作原理 构成原电池的三个条件。动脑动手1、有下列材料:Zn片(2片)、Cu片(2片)、
导线、水果 (西红柿、苹果等)、电流计,
请设计一个装置使电流计指针发生偏转,
并画出设计草图。
Zn2.某同学作一个原电池,电池总反应的离子方程式是:
Zn+Cu2+=Cu+Zn2+ 它的组成是:答案:A 3、请将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+设计成一个原电池Fe比Fe不活泼的金属或石墨 CuSO4 、CuCl2等负极:
正极:
电解质溶液: 如何在一个地处僻远的
小岛上设置一 座灯塔?
(从能量角度考虑)思考讨论负极:较活泼的金属(如铝等金属)
正极:较不活泼的金属或石墨等
电解质溶液:海水(NaCl、MgCl2等)
实验1: 用一枝铜钩插入死青蛙的脊髓中,再挂在铁栏杆上,当青蛙腿碰到铁栏杆时,就发生颤抖。
实验2:将青蛙放到铜制的解剖盘里,当解剖刀接触蛙腿时,蛙腿发生抽搐
他根据实验得出:青蛙自身肌肉和神经里的“生物电”是导致抽搐的原因。1791年,伽伐尼发表了《论肌肉中的生物电》论文,引起广泛关注。 阅读材料 善于质疑的意大利物理学家伏打,提出了疑问:为什么只有青蛙腿和铜器和铁器接触时才发生抽搐?实验如下:
实验1:将青蛙腿放在铜盘里,用解剖刀去接触,蛙腿抽搐
实验2:将青蛙腿放在木盘里,用解剖刀去接触,蛙腿不动
伏打用实验推翻了伽伐尼的结论,认为要有两种活泼性不同的金属同时接触蛙腿,蛙腿就会抽搐。
联想到肌肉、神经保存在类似生理盐水的溶液中,那么,生理盐水与活泼性不同的金属作用会不会产生电流呢?实验现象:锌片上有气泡产生
而铜片上没有实验现象:电流计指针发生偏转,
Cu片上有气泡产生一、原电池
1.定义:把化学能转变为电能的装置电极反应式:2、原电池工作原理较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电
路流向较不活泼的金属(正极) 。原电池的工作原理较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 电子流向:
负极 正极导线(可以)(可以)(可以)(不可以)形成条件一:
活泼性不同的两个电极负极:较活泼的金属
正极:较不活泼的金属、石墨等第一组实验实验探究一:原电池的电极材料(可以)(不可以)形成条件二:电极需插进电解质溶液中第二组实验实验探究二:形成原电池的条件第三组实验形成条件三:必须形成闭合回路(不可以)实验探究三:形成原电池的条件组成原电池的条件有两种活泼性不同的金属(或一种是非金属导体)作电极
电电极材料均插入电解质溶液中
两电极相连形成闭合电路原电池形成的实质:
氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移给氧化剂。氧化反应还原反应你知道了吗
1.图中所示装置属于原电池的是( ).C D 2、把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B3.X、Y、Z、W四种金属片进入稀盐酸中,用导线连接,可以组成原电池,实验结果如下图所示:
则四种金属的活泼性由强到弱的顺序为_________________Z>Y>X>W答案:B: 负极: Zn-2e-=Zn2+
正极: Cu2++ 2e-=Cu3. 实验室制取氢气选用纯锌粒好还是选用粗锌好?为什么?选用粗锌较好利用锌与其中的不活泼杂质形成原电池以加速反应进行。[练习] 铅蓄电池放电时的总反应方程式为:
PbO2+Pb+2H2SO4 2PbSO4+2H2O
据此判断其正极是 ,负极是 ,电解质溶液是 ,正极反应是 ,负极反应是 。当转移0.5NA个电子,蓄电池内消耗H2SO4的物质的量为 。PbO2PbH2SO4PbO2+ SO42-+ 4H++2e- =PbSO4+2H2OPb+ SO42--2e- =PbSO40.5mol你记住了吗?
本课时重点学习了原电池的工作原理 构成原电池的三个条件。动脑动手1、有下列材料:Zn片(2片)、Cu片(2片)、
导线、水果 (西红柿、苹果等)、电流计,
请设计一个装置使电流计指针发生偏转,
并画出设计草图。
Zn2.某同学作一个原电池,电池总反应的离子方程式是:
Zn+Cu2+=Cu+Zn2+ 它的组成是:答案:A 3、请将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+设计成一个原电池Fe比Fe不活泼的金属或石墨 CuSO4 、CuCl2等负极:
正极:
电解质溶液: 如何在一个地处僻远的
小岛上设置一 座灯塔?
(从能量角度考虑)思考讨论负极:较活泼的金属(如铝等金属)
正极:较不活泼的金属或石墨等
电解质溶液:海水(NaCl、MgCl2等)
