原电池[下学期]
图片预览





文档简介
课件18张PPT。1原电池原理2 原电池 原理及其应用1.
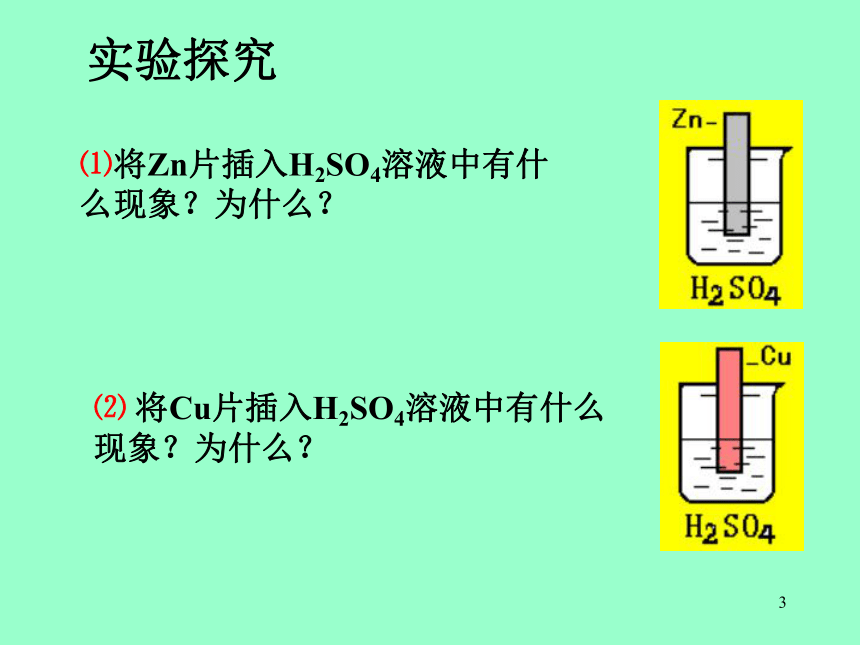
学习目标理解构成原电池的条件?3.理解原电池的工作原理?了解什么是原电池?4. 如何判断原电池的正负极和电子流向?2.3⑴将Zn片插入H2SO4溶液中有什么现象?为什么?⑵ 将Cu片插入H2SO4溶液中有什么现象?为什么?实验探究4⑷若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?
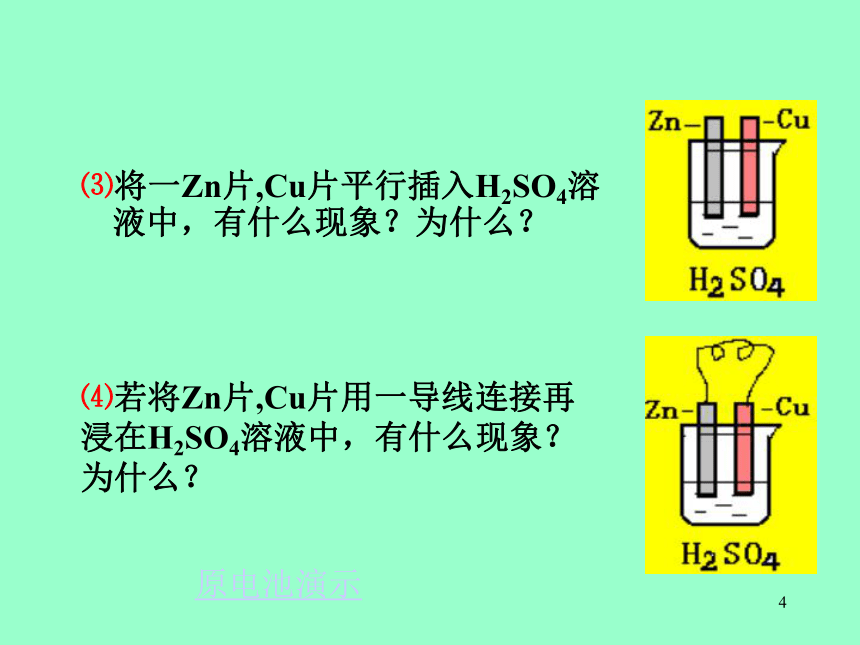
⑶将一Zn片,Cu片平行插入H2SO4溶液中,有什么现象?为什么?
原电池演示5⑸导线间接一电流计有何现象产生?为什么?
61
化学能转化为的装置就叫原电池。把电能什么是原电池?一、原电池
72.构成原电池的条件是什么?(1)两种活泼性不同的金属。
一种金属与一种非金属(如石墨)。
也可以两电极都是其它材料。
(都必须是导体)8在电极表面上能发生自发进行的氧化还原反应。(必定是放热反应)(3)正极、负极、电解质溶液构成闭合回路(2)两电极都接触电解质溶液(酸、碱、盐)把化学能转化为电能的装置。闭合电路电极相连接触电解质溶液自发的氧化还原反应分两处进行93、简单原电池的正负极和电子流向如何判断? 负极(–): 电 子电 流是不活泼金属或非金属,正极(+):是较活泼金属,一般本身失去电子,发生氧化反应。进电子 ,本身不反应,得电子发生还原反应。是溶液中的阳离子要用到金属活动性顺序表:注意:K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au…活泼性,还原性依次 减弱。104、原电池的工作原理是什么?11氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液失e,沿导线传递,有电流产生还原反应2H++2e- =H2↑阴离子阳离子总反应:负极正极 2H++2e- =H2↑Zn-2e- =Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)阳离子12 原电池的工作原理:是将氧化还原反应分在两个电极上进行,负极上失去的电子经导线流入正极,从而产生电流。 利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。13练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
14⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO4152.请你为格林太太开方3.根据氧化还原反应设计原电池
指出正极和负极及电解质溶液
Cu + 2Ag+ = 2Ag + Cu2+16课后实践:根据原电池原理
在家里自选材料设计原电池并验证是否有电流(可以放在耳机旁)17本节要点:
1,原电池概念。
2,构成原电池的条件。
3,原电池的正负极和电子流向判断。
4,原电池的工作原理。小 结18实验探索试用所给材料组成原电池:
锌、铜、铁、碳棒;稀硫酸、硫酸铜溶液、无水乙醇。
判断正负极?电极反应?电池总反应?
学习目标理解构成原电池的条件?3.理解原电池的工作原理?了解什么是原电池?4. 如何判断原电池的正负极和电子流向?2.3⑴将Zn片插入H2SO4溶液中有什么现象?为什么?⑵ 将Cu片插入H2SO4溶液中有什么现象?为什么?实验探究4⑷若将Zn片,Cu片用一导线连接再浸在H2SO4溶液中,有什么现象?为什么?
⑶将一Zn片,Cu片平行插入H2SO4溶液中,有什么现象?为什么?
原电池演示5⑸导线间接一电流计有何现象产生?为什么?
61
化学能转化为的装置就叫原电池。把电能什么是原电池?一、原电池
72.构成原电池的条件是什么?(1)两种活泼性不同的金属。
一种金属与一种非金属(如石墨)。
也可以两电极都是其它材料。
(都必须是导体)8在电极表面上能发生自发进行的氧化还原反应。(必定是放热反应)(3)正极、负极、电解质溶液构成闭合回路(2)两电极都接触电解质溶液(酸、碱、盐)把化学能转化为电能的装置。闭合电路电极相连接触电解质溶液自发的氧化还原反应分两处进行93、简单原电池的正负极和电子流向如何判断? 负极(–): 电 子电 流是不活泼金属或非金属,正极(+):是较活泼金属,一般本身失去电子,发生氧化反应。进电子 ,本身不反应,得电子发生还原反应。是溶液中的阳离子要用到金属活动性顺序表:注意:K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au…活泼性,还原性依次 减弱。104、原电池的工作原理是什么?11氧化反应Zn-2e=Zn2+ 铜锌原电池电解质溶液失e,沿导线传递,有电流产生还原反应2H++2e- =H2↑阴离子阳离子总反应:负极正极 2H++2e- =H2↑Zn-2e- =Zn2+Zn+2H+=Zn2++H2↑Zn+H2SO4=ZnSO4+H2↑(离子方程式)(化学方程式)电极反应正极:负极:(氧化反应)(还原反应)阳离子12 原电池的工作原理:是将氧化还原反应分在两个电极上进行,负极上失去的电子经导线流入正极,从而产生电流。 利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。13练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e-=H2↑负极:总反应:正极:Zn-2e-=Zn2+Zn+2H+=Zn2++H2↑
14⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn-2e- =Zn2+2H++2e- =H2↑Zn+2H+=Zn2++H2↑Fe-2e - =Fe2+Cu2++2e- =CuFe+Cu2+=Fe2++CuFe+CuSO4=Cu+FeSO4152.请你为格林太太开方3.根据氧化还原反应设计原电池
指出正极和负极及电解质溶液
Cu + 2Ag+ = 2Ag + Cu2+16课后实践:根据原电池原理
在家里自选材料设计原电池并验证是否有电流(可以放在耳机旁)17本节要点:
1,原电池概念。
2,构成原电池的条件。
3,原电池的正负极和电子流向判断。
4,原电池的工作原理。小 结18实验探索试用所给材料组成原电池:
锌、铜、铁、碳棒;稀硫酸、硫酸铜溶液、无水乙醇。
判断正负极?电极反应?电池总反应?
