电解池的工作原理[上学期]
图片预览



文档简介
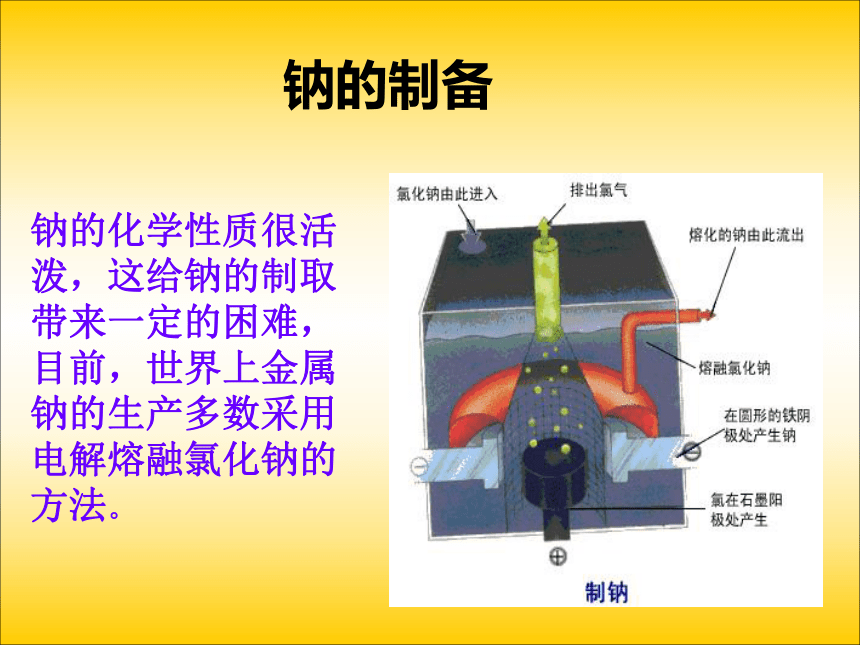
课件19张PPT。氢气氧气电解池的工作原理钠的制备钠的化学性质很活泼,这给钠的制取带来一定的困难,目前,世界上金属钠的生产多数采用电解熔融氯化钠的方法。电解法制钠用惰性(石墨)电极电解熔融的氯化钠现象:
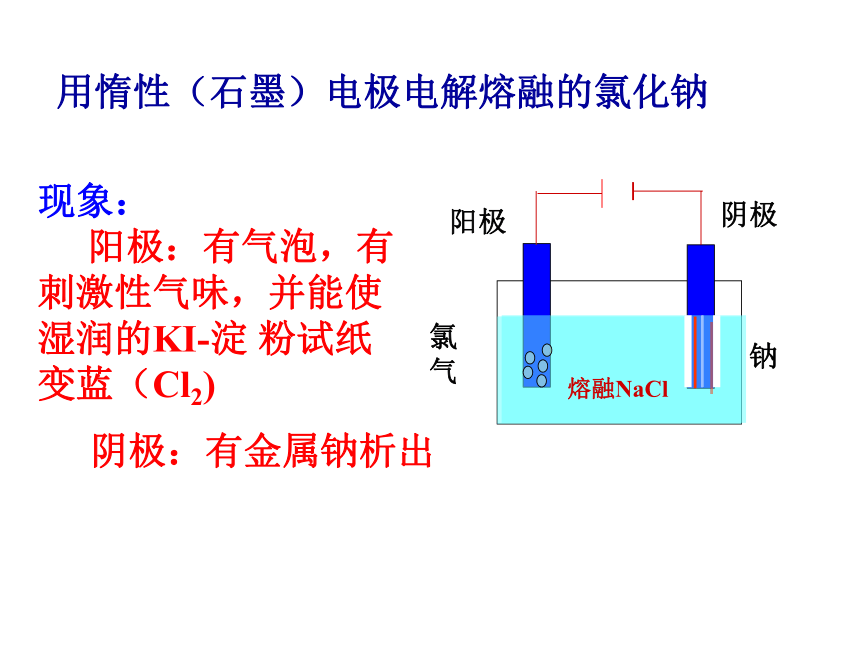
阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2) 阴极:有金属钠析出阴极阳极氯
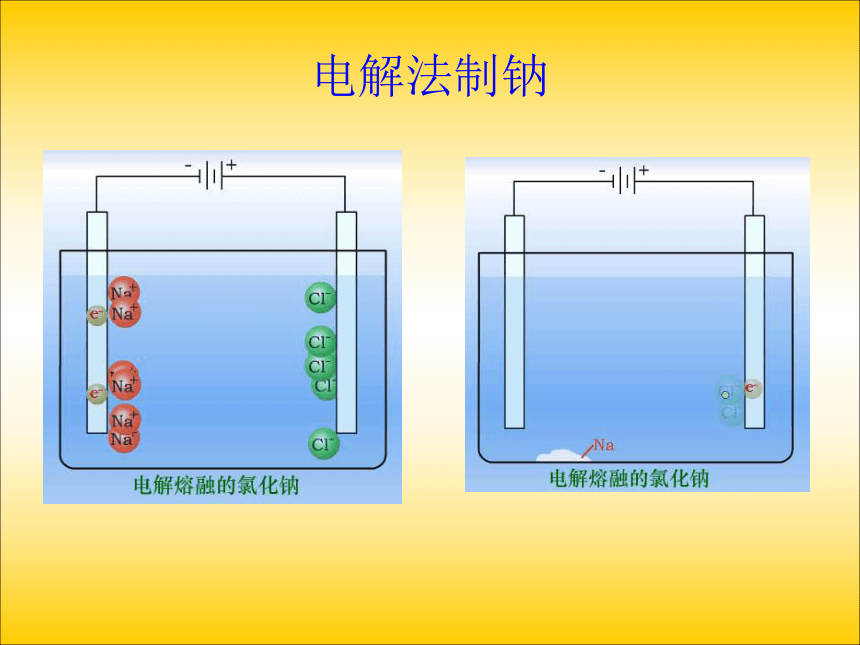
气钠熔融NaCl 分析:通电前:分析熔融电解质中的离子情况
阳离子:
阴离子:
做无规则运动通电后:(直流电)
(1)确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Na+Cl-(2)判断电极产物并书写电极反应:
阳离子移向阴极放电,阴离子移向阳极放电
阳极:2Cl- _2e- →Cl2↑ 氧化反应
阴极:2Na+ +2e-→2Na 还原反应
总式:
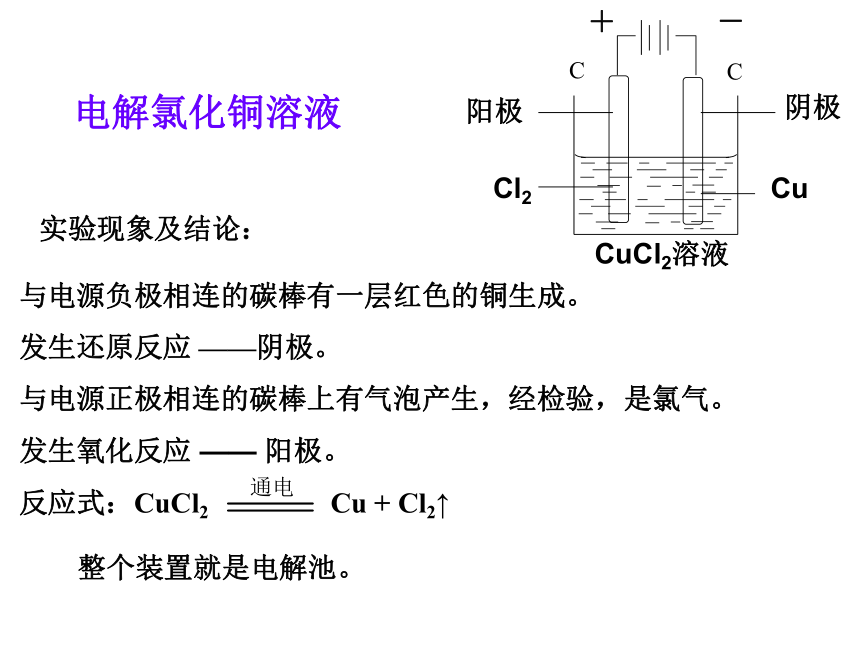
电解氯化铜溶液实验现象及结论:与电源负极相连的碳棒有一层红色的铜生成。
发生还原反应 ——阴极。
与电源正极相连的碳棒上有气泡产生,经检验,是氯气。
发生氧化反应 —— 阳极。反应式:CuCl2 Cu + Cl2↑ CuCl2溶液CuCl2+-阴极阳极整个装置就是电解池。分析:①通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;③电极反应:阳极:2Cl- - 2e- = Cl2↑(氧化反应)阴极:Cu2+ + 2e- = Cu(还原反应)Ⅰ通电前 电解:CuCl2 Cu+Cl2 ↑2Cl--2 e- =Cl2阴离子移向阳离子移向电子流向阳极阴极CuCl2溶液e-e-氧化反应还原反应Cu2++ 2e-=2Cu原理分析电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;构成闭合回路.电解池:把电能转变为化学能的装置。一、电解原理放电顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子氧化性越强,越容易得电子。金属 > S2->I->Br->Cl->OH- >NO3->SO42->F- 阳极:还原性强的离子先失电子Ag+>Hg2+>Cu2+>H+>Pb2+>Fe2+>… >Na+>Ca 2+ > K+ 以碳棒为电极,电解下列物质的水溶液时,在阴、阳两极上分别是什么离子放电?总结有什么特点或规律?动脑筋HCl、CuCl2、H2O
2. NaCl、AgNO3、CuSO4
3. Na2SO4、H2SO4、NaOH实质电解的只是溶质本身实质电解的是溶质和H2O实质电解的就是H2O电解质溶液电解规律(惰性电极) 阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F- Ⅰ与Ⅲ区:电解本身型 如CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+ 电离与电解的比较电解质溶于水
或熔化状态下电解质电离后,
再通以直流电电解质电离成为
自由移动的离子阴阳离子定向移动,
在两极上放电CuCl2 = Cu2++2Cl— CuCl2 = Cu+Cl2电解电解必须建立在电离的基础上正极 负极原电池与电解池的比较还原反应氧化反应还原反应氧化反应先从负极→导线→正极 先负极→导线→阴极
II 阳极→导线→正极将化学能转化为电能将电能转化为化学能反应能够自发进行反应不能自发进行,要在
外电场作用下才能发生阴极阳极以石墨作电极,电解下列溶液,写出电极反应及电解总反应式。
(1)HCl溶液
(2)Na2SO4溶液
(3)NaCl溶液 练习 在相同条件下,以石墨作为电极,通以相同的电量,分别电解足量的CuCl2溶液和AgNO3溶液,如果析出64g铜,则析出银的质量为
A.108g B.54g
C.216g D.64g练习:小结电解池
将电能转化为化学能的装置
阳极:与外接电源的正极相联
阴极:与外接电源的负极相联
惰性电极
阳极:阴离子放电(S2-、I-、Br-、Cl-、OH-)
阴极:阳离子放电(Fe3+、Ag+、Cu2+、Fe2+、Zn2+)
非惰性电极
阳极自身放电再见
阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀 粉试纸变蓝(Cl2) 阴极:有金属钠析出阴极阳极氯
气钠熔融NaCl 分析:通电前:分析熔融电解质中的离子情况
阳离子:
阴离子:
做无规则运动通电后:(直流电)
(1)确定电极名称:
阳极(接电源正极)
阴极(接电源负极)
与电极材料无关
Na+Cl-(2)判断电极产物并书写电极反应:
阳离子移向阴极放电,阴离子移向阳极放电
阳极:2Cl- _2e- →Cl2↑ 氧化反应
阴极:2Na+ +2e-→2Na 还原反应
总式:
电解氯化铜溶液实验现象及结论:与电源负极相连的碳棒有一层红色的铜生成。
发生还原反应 ——阴极。
与电源正极相连的碳棒上有气泡产生,经检验,是氯气。
发生氧化反应 —— 阳极。反应式:CuCl2 Cu + Cl2↑ CuCl2溶液CuCl2+-阴极阳极整个装置就是电解池。分析:①通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;③电极反应:阳极:2Cl- - 2e- = Cl2↑(氧化反应)阴极:Cu2+ + 2e- = Cu(还原反应)Ⅰ通电前 电解:CuCl2 Cu+Cl2 ↑2Cl--2 e- =Cl2阴离子移向阳离子移向电子流向阳极阴极CuCl2溶液e-e-氧化反应还原反应Cu2++ 2e-=2Cu原理分析电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;构成闭合回路.电解池:把电能转变为化学能的装置。一、电解原理放电顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子氧化性越强,越容易得电子。金属 > S2->I->Br->Cl->OH- >NO3->SO42->F- 阳极:还原性强的离子先失电子Ag+>Hg2+>Cu2+>H+>Pb2+>Fe2+>… >Na+>Ca 2+ > K+ 以碳棒为电极,电解下列物质的水溶液时,在阴、阳两极上分别是什么离子放电?总结有什么特点或规律?动脑筋HCl、CuCl2、H2O
2. NaCl、AgNO3、CuSO4
3. Na2SO4、H2SO4、NaOH实质电解的只是溶质本身实质电解的是溶质和H2O实质电解的就是H2O电解质溶液电解规律(惰性电极) 阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F- Ⅰ与Ⅲ区:电解本身型 如CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+ 电离与电解的比较电解质溶于水
或熔化状态下电解质电离后,
再通以直流电电解质电离成为
自由移动的离子阴阳离子定向移动,
在两极上放电CuCl2 = Cu2++2Cl— CuCl2 = Cu+Cl2电解电解必须建立在电离的基础上正极 负极原电池与电解池的比较还原反应氧化反应还原反应氧化反应先从负极→导线→正极 先负极→导线→阴极
II 阳极→导线→正极将化学能转化为电能将电能转化为化学能反应能够自发进行反应不能自发进行,要在
外电场作用下才能发生阴极阳极以石墨作电极,电解下列溶液,写出电极反应及电解总反应式。
(1)HCl溶液
(2)Na2SO4溶液
(3)NaCl溶液 练习 在相同条件下,以石墨作为电极,通以相同的电量,分别电解足量的CuCl2溶液和AgNO3溶液,如果析出64g铜,则析出银的质量为
A.108g B.54g
C.216g D.64g练习:小结电解池
将电能转化为化学能的装置
阳极:与外接电源的正极相联
阴极:与外接电源的负极相联
惰性电极
阳极:阴离子放电(S2-、I-、Br-、Cl-、OH-)
阴极:阳离子放电(Fe3+、Ag+、Cu2+、Fe2+、Zn2+)
非惰性电极
阳极自身放电再见
