电解池[上学期]
图片预览


文档简介
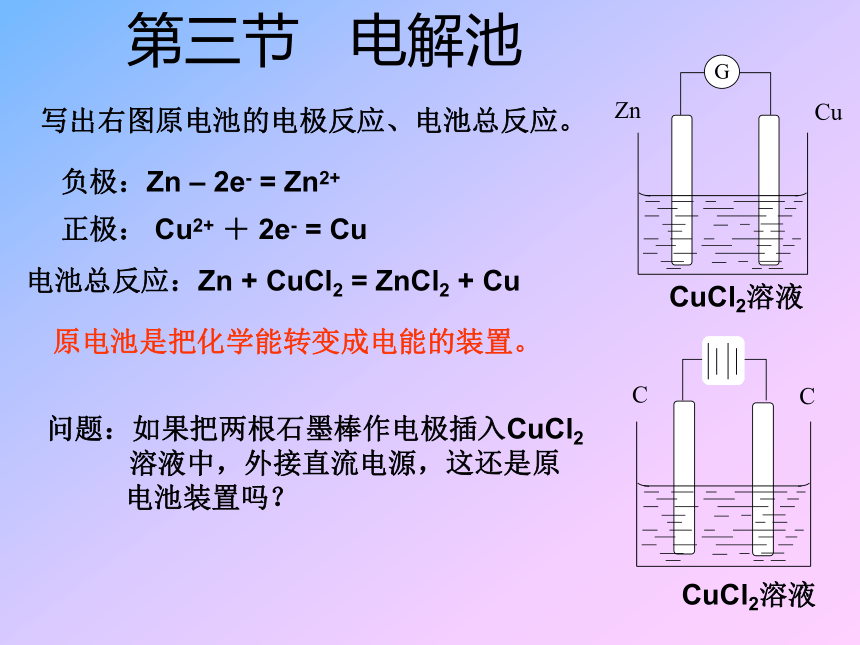
课件8张PPT。第三节 电解池CuCl2溶液写出右图原电池的电极反应、电池总反应。负极:Zn – 2e- = Zn2+正极: Cu2+ + 2e- = Cu电池总反应:Zn + CuCl2 = ZnCl2 + CuCuCl2溶液问题:如果把两根石墨棒作电极插入CuCl2 溶液中,外接直流电源,这还是原 电池装置吗?原电池是把化学能转变成电能的装置。【实验4—2】实验现象及结论:与电源负极相连的碳棒有一层红色的铜生成。
发生还原反应 ——阴极。
与电源正极相连的碳棒上有气泡产生,经检验,是氯气。
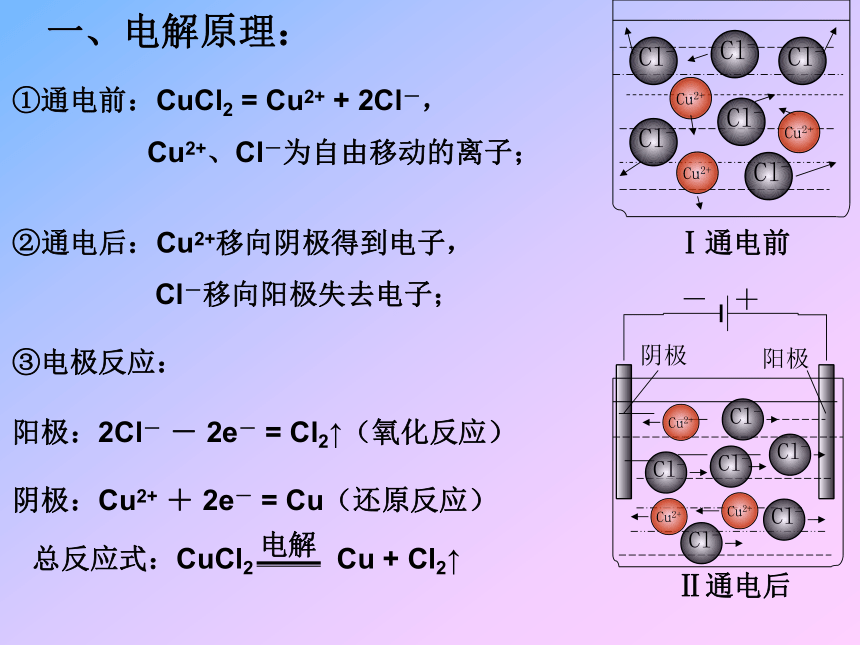
发生氧化反应 —— 阳极。反应式:CuCl2 Cu + Cl2↑ CuCl2溶液CuCl2+-阴极阳极整个装置就是电解池。一、电解原理:①通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;③电极反应:阳极:2Cl- - 2e- = Cl2↑(氧化反应)阴极:Cu2+ + 2e- = Cu(还原反应)Ⅰ通电前电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的程,叫做电解。构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;电解池:电能转变为化学能的装置。放电顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子氧化性越强,越容易得电子。金属 > S2->I->Br->Cl->OH-(水) >NO3->SO42->F- 阳极:还原性强的离子先失电子Ag+>Hg2+>Cu2+>H+(水)>Pb2+>Fe2+>… >Na+>Ca 2+ > K+ 练习:试写出电解饱和 NaCl 溶液的电极方程式。二、电解原理的应用1、电解饱和食盐水以制造烧碱、氯气和氢气。2、电镀把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层
金属离子的溶液作电镀液。在直流的作用下,镀层表面就覆
盖一层均匀光洁而致密的镀层。3、电冶金制取金属钠电解熔融状态的氯化钠。通直流电后,阳极:2Cl - -2e- == Cl2↑阴极:2Na+ + 2e- == 2Na总反应:2NaCl(熔融) 2Na + Cl2 ↑Cu2+oooooooooooooooooooo? - +- +阴极阳极CuCl2电解氯化铜溶液实验装置e-e-单击电子流动2、电解精炼铜原理:①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+
阴极(纯铜): Cu2+ + 2e- = Cu②比铜活泼的金属:Zn.Fe.Ni只溶解,不析出;③比铜不活泼的金属:Au.Pt.不溶解,而以单质沉积
形成阳极泥;④电解质溶液中CuSO4的浓度基本不变;
发生还原反应 ——阴极。
与电源正极相连的碳棒上有气泡产生,经检验,是氯气。
发生氧化反应 —— 阳极。反应式:CuCl2 Cu + Cl2↑ CuCl2溶液CuCl2+-阴极阳极整个装置就是电解池。一、电解原理:①通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;③电极反应:阳极:2Cl- - 2e- = Cl2↑(氧化反应)阴极:Cu2+ + 2e- = Cu(还原反应)Ⅰ通电前电解: 使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的程,叫做电解。构成电解池的条件:是电能转变为化学能的装置!①直流电源;与电源负极相连的电极为阴极与电源正极相连的电极为阳极②阴、阳电极③电解质溶液或熔融电解质;电解池:电能转变为化学能的装置。放电顺序:阴极:氧化性强的离子先得电子金属越不活泼的对应阳离子氧化性越强,越容易得电子。金属 > S2->I->Br->Cl->OH-(水) >NO3->SO42->F- 阳极:还原性强的离子先失电子Ag+>Hg2+>Cu2+>H+(水)>Pb2+>Fe2+>… >Na+>Ca 2+ > K+ 练习:试写出电解饱和 NaCl 溶液的电极方程式。二、电解原理的应用1、电解饱和食盐水以制造烧碱、氯气和氢气。2、电镀把待镀的金属制品作阴极,把镀层金属作阳极,用含有镀层
金属离子的溶液作电镀液。在直流的作用下,镀层表面就覆
盖一层均匀光洁而致密的镀层。3、电冶金制取金属钠电解熔融状态的氯化钠。通直流电后,阳极:2Cl - -2e- == Cl2↑阴极:2Na+ + 2e- == 2Na总反应:2NaCl(熔融) 2Na + Cl2 ↑Cu2+oooooooooooooooooooo? - +- +阴极阳极CuCl2电解氯化铜溶液实验装置e-e-单击电子流动2、电解精炼铜原理:①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu -2e- = Cu2+
阴极(纯铜): Cu2+ + 2e- = Cu②比铜活泼的金属:Zn.Fe.Ni只溶解,不析出;③比铜不活泼的金属:Au.Pt.不溶解,而以单质沉积
形成阳极泥;④电解质溶液中CuSO4的浓度基本不变;
