水的电离[下学期]
图片预览



文档简介
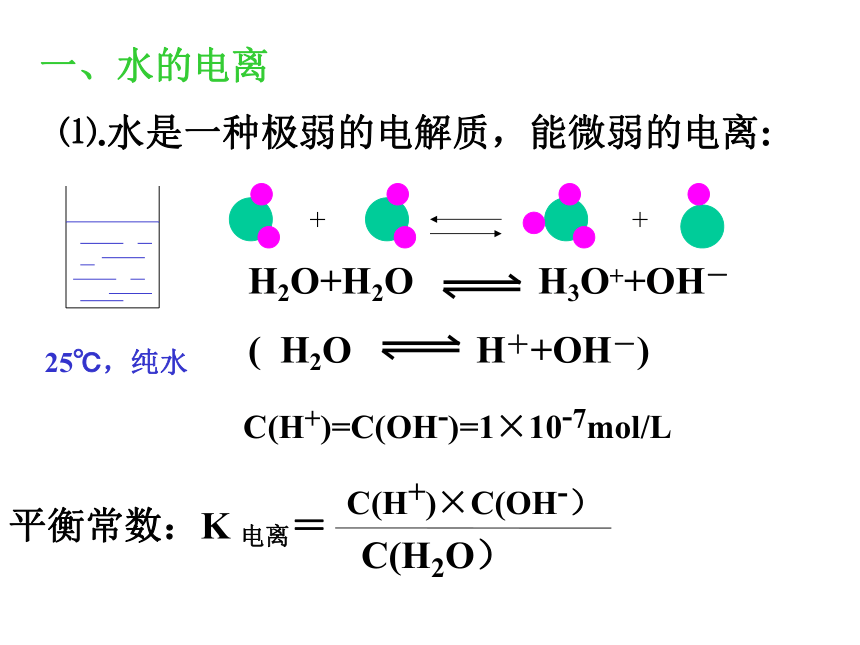
课件9张PPT。水的电离潮州华侨中学 黄汉钦一、水的电离⑴.水是一种极弱的电解质,能微弱的电离:C(H+)=C(OH-)=1×10-7mol/L在一定温度时:
C(H+)×C(OH-)=Kw,叫水的离子积
25℃时,Kw=1×10-142、水的离子积水的浓度为常数,所以 K W= C(H+)×C(OH-)提问:根据前面所学知识,水的离子积会受什么外界条件影响?分析下表中的数据有何规律,并解释之 讨论:讨论:对常温下的纯水进行下列操作,完成下表: 中性→↑↑=↑酸性←↑↓>不变碱性←↓↑<不变小结:加入酸或碱都抑制水的电离3、影响水电离的因素
(1)加入酸或碱,抑制水的电离,
Kw不变;
(2)升高温度,电离过程是一个
吸热过程,促进水的电离,水
的离子积增大,在100℃时,
KW=1×10-12。新课的延伸:
1、C(H+)=1×10-7mol/L,溶液一定呈中性吗?
说明:溶液或纯水呈中性,是因为溶液中
C(H+)=C(OH-)
2、纯水中溶液C(H +)、C(OH-)浓度的计算方法:
C(H +)=C(OH-)=④根据Kw=C(H+)×C(OH-) 在特定温度下为
定值,C(H+) 和C(OH-) 可以互求.③不论是在中性溶液还是在酸碱性溶液,水电离出的C(H+)=C(OH-)②常温下,任何稀的水溶液中
C(H+)×C(OH-)===1×10-14 练习
⑴﹑0.1mol/L的盐酸溶液中水电离出的C(H+ )和C(OH-)是多少? ⑵﹑0.1mol/L的NaOH溶液中水电离出的C(H+)和C(OH-)是多少?水电离出的C(OH-)=1×10-14/0.1=1×10-13mol/L
= C(H+ )
C(H+)×C(OH-)=Kw,叫水的离子积
25℃时,Kw=1×10-142、水的离子积水的浓度为常数,所以 K W= C(H+)×C(OH-)提问:根据前面所学知识,水的离子积会受什么外界条件影响?分析下表中的数据有何规律,并解释之 讨论:讨论:对常温下的纯水进行下列操作,完成下表: 中性→↑↑=↑酸性←↑↓>不变碱性←↓↑<不变小结:加入酸或碱都抑制水的电离3、影响水电离的因素
(1)加入酸或碱,抑制水的电离,
Kw不变;
(2)升高温度,电离过程是一个
吸热过程,促进水的电离,水
的离子积增大,在100℃时,
KW=1×10-12。新课的延伸:
1、C(H+)=1×10-7mol/L,溶液一定呈中性吗?
说明:溶液或纯水呈中性,是因为溶液中
C(H+)=C(OH-)
2、纯水中溶液C(H +)、C(OH-)浓度的计算方法:
C(H +)=C(OH-)=④根据Kw=C(H+)×C(OH-) 在特定温度下为
定值,C(H+) 和C(OH-) 可以互求.③不论是在中性溶液还是在酸碱性溶液,水电离出的C(H+)=C(OH-)②常温下,任何稀的水溶液中
C(H+)×C(OH-)===1×10-14 练习
⑴﹑0.1mol/L的盐酸溶液中水电离出的C(H+ )和C(OH-)是多少? ⑵﹑0.1mol/L的NaOH溶液中水电离出的C(H+)和C(OH-)是多少?水电离出的C(OH-)=1×10-14/0.1=1×10-13mol/L
= C(H+ )
