水的电离[上学期]
图片预览






文档简介
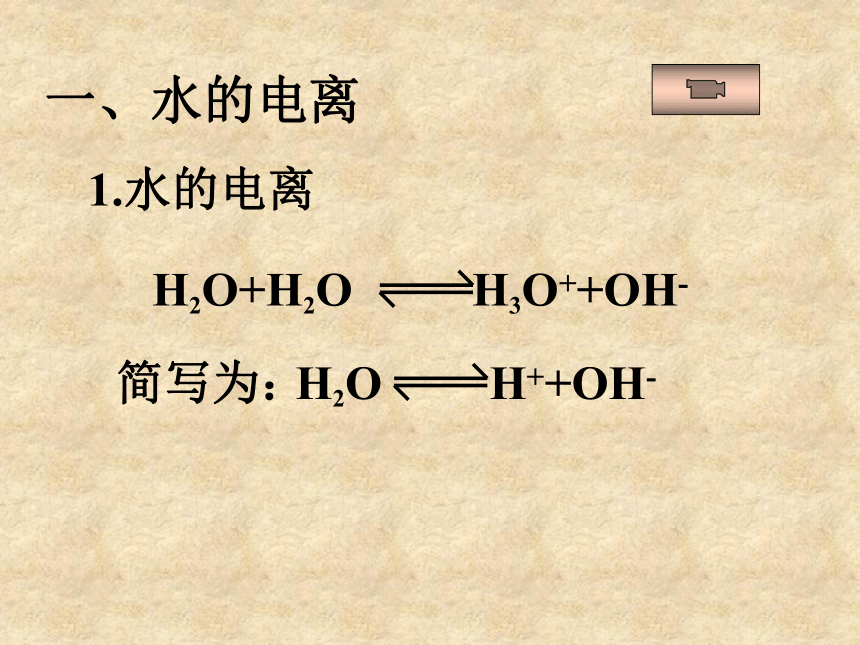
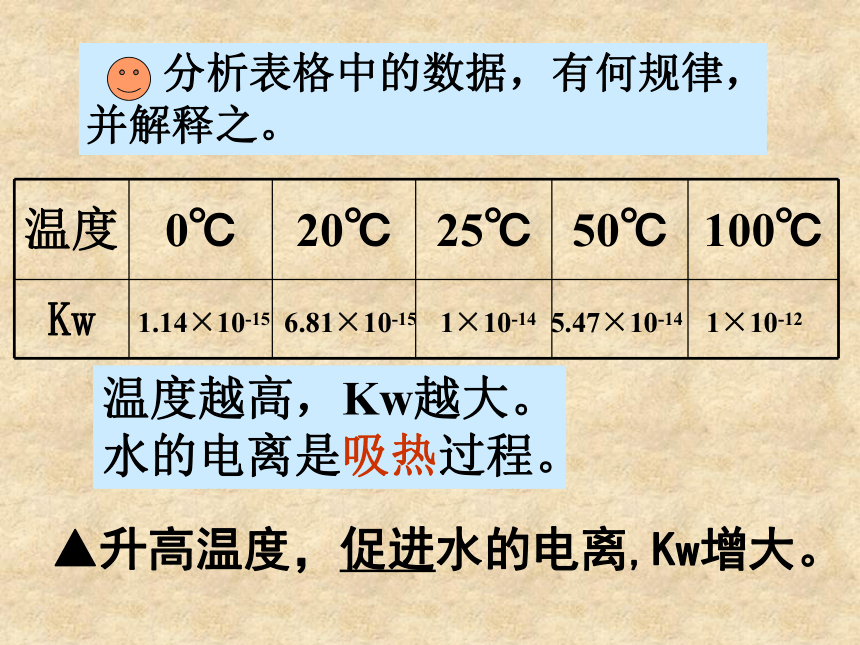
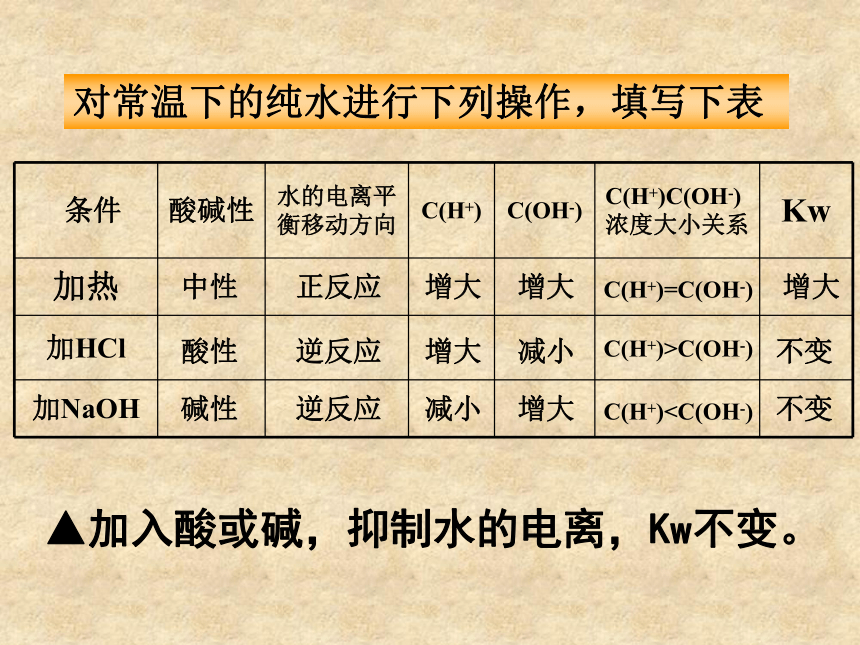
课件20张PPT。水是一种宝贵的资源,也是与我们日常生活密切相关的物质。极弱的电解质,微弱电离思考存在电离平衡你对水的了解有多深呢?第二节 水的电离和溶液的PH一、水的电离1.水的电离简写为:问题与研究:水的电离程度如何?实验证明,在25℃时,1L水中只有1×10-7mol的水分子发生电离,那么,纯水电离出的H+及OH-浓度是多少?C(H+)=1×10-7 mol/LC(OH-) =1×10-7 mol/L2.水的离子积常数Kw=C(H+)?C(OH-)25℃时,Kw=1×10-14 分析表格中的数据,有何规律,并解释之。1.14×10-15 6.81×10-15 1×10-14 5.47×10-14 1×10-12温度越高,Kw越大。水的电离是吸热过程。▲升高温度,促进水的电离,Kw增大。2.水的离子积Kw=C(H+)?C(OH-)25℃时,Kw=1×10-14(Kw决定于温度)Kw是水电离平衡时的性质,它不仅适用于纯水,也适用于任何酸、碱或盐的稀溶液。即溶液中C(H+)?C(OH-)= 1×10-14对常温下的纯水进行下列操作,填写下表中性正反应增大增大C(H+)=C(OH-)增大酸性逆反应增大减小C(H+)>C(OH-)不变碱性逆反应减小增大C(H+)C(OH-)C(H+)>1×10-7碱性C(H+)1×10-7mol/L,则该溶液一定呈酸性,此说法是否正确,为什么?呈酸性本质C(H+)>C(OH-)意义:用PH值来表示溶液酸碱性:表示:PH=-lg{C(H+)}常温中性溶液:PH=7酸性溶液:PH<7(PH越小,酸性越强)碱性溶液:PH>7(PH越大,碱性越强)PH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 中 性酸性碱性2.溶液的酸碱性和PH问题与讨论:1.已知100℃时,纯水的离子积为 1×10-12,那么此时纯水的PH等于几?2.此时的水是酸性的吗?3.100 ℃时,PH=7的溶液酸性还是碱性的?3.溶液PH的计算方法:Ⅰ.单一溶液的PH计算例:0.4gNaOH固体溶于水配制成 1000ml溶液,求所得溶液的PH.Ⅱ.溶液稀释后求PH酸的稀释例题:在25℃时,pH值等于5的盐酸溶液稀释到原来的10倍,pH 值等于多少?稀释到1000倍后, pH值等于多少?解:pH=-lg[H+]=-lg(10—5+999×10—7)/1000=-lg1.1×10—7=7- lg1.1=6.96关键:抓住氢离子进行计算!无论稀释多少倍,酸溶液的PH不能等于或大于7,只能趋进于7.这是因为当PH接近6时,再加水稀释,由水电离提供的H+不能再忽略!例题:在25℃时,pH值等于9的强碱溶液稀释到原来的10倍,pH值等于多少?稀释到1000倍后, pH值等于多少?碱的稀释关键:抓住氢氧根离子进行计算! 碱溶液的稀释是对C(OH-)进行稀释,先求稀释后C(OH-),然后求稀释后C(H+),再求PH!Ⅲ.溶液混合后求PH强酸与强酸混合例题:在25℃时,pH值等于1的盐酸溶液1L和pH值等于4的硫酸溶液1000L混合pH值等于多少?关键:抓住氢离子进行计算!例题:在25℃时,pH值等于1的盐酸溶液和pH值等于4的硫酸溶液等体积混合pH值等于多少?两强酸等体积混合:速算pH混= pH小+0.3强碱与强碱混合例题:在25℃时,pH值等于9和pH值等于11的两种氢氧化钠溶液等体积混合pH值等于多少?关键:抓住氢氧根离子进行计算! 两强碱等体积混合:速算pH混= pH大-0.3强酸与强碱混合(实为中和)例题:在25℃时,100mlO.4mol/L的盐酸与等体积0.6mol/L的氢氧化钠溶液混合后,溶液的pH值等于多少?例题:在25℃时,100mlO.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液的pH值等于多少?①若恰好中和,PH=7②若剩余酸,先求剩余C(H+),再求PH.③若剩余碱,先求中和后剩余的C(OH-),再通过Kw求C(H+),最后求PH.
