强电解质和弱电解质[上学期]
图片预览






文档简介
(共15张PPT)
地球是个“水球”,海洋、
江河和地下水成了离子反应广
泛存在的条件。
地球化学
酸、碱和盐在水溶液中的
反应,以离子反应为特征。是
一类不需要用活化能来引发的
反应。
本专题的学习以化学平衡理论
为基础,进一步探讨酸、碱、盐
在水中的离子反应,深入了解离
子反应的本质;探究化学平衡、
电离程度和溶解度之间的关系及
其应用。
专题3 溶液中的离子反应
(1)什么叫电解质?举例说明。
(2)什么叫非电解质?举例说明。
(3)电解质和非电解质的物质类属
是什么 两者的区分标准是什么
知识回顾:
强电解质和弱电解质
电解质和非电解质比较
电解质 非电解质
概念:在水溶液中或熔化状态下 在水溶液和熔化状态
能够导电的化合物。 下都不能导电的化合物。
和结构关系:大多数离子化合物 极性键或非极性键构成
强极性键共价化合物 的共价化合物
实例: 酸、碱 、盐,H2O 大多数有机物,SO3、CO2 等
1.石墨能导电,所以是电解质。
2.由于BaSO4不溶于水,所以不是电解质。
3.盐酸能导电,所以盐酸是电解质。
4.SO2、NH3、Na2O溶于水可导电,所以均为
电解质。
讨论以下几种说法是否正确,并说明原因。
1)单质
混合物
既不是电解质也不是非电解质
2) CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电的物质不是其本身
3)难溶的盐(BaSO4等)虽然水溶液不能导电
但是在融化时能导电,也是电解质。
注意
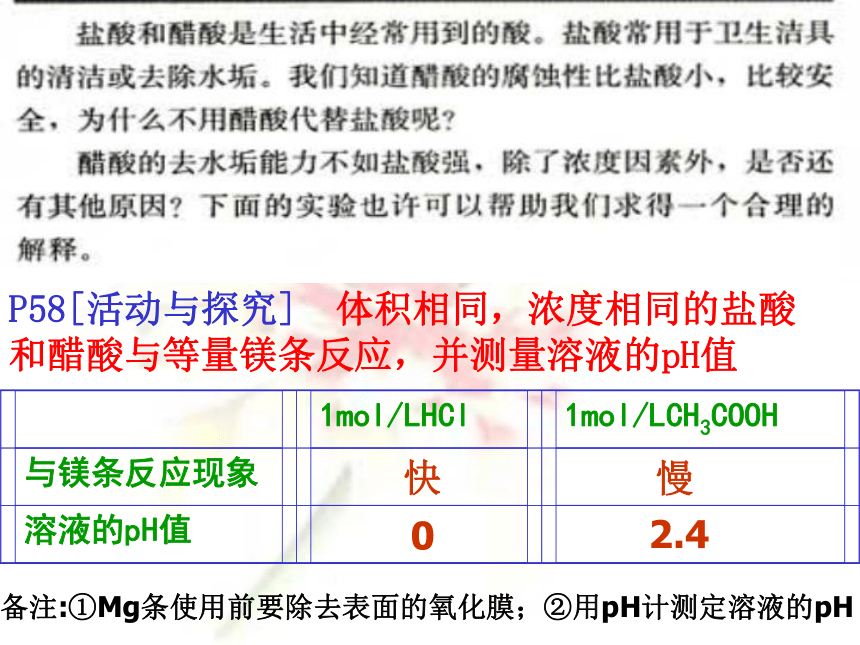
P58[活动与探究] 体积相同,浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH值
1mol/LHCl
1mol/LCH3COOH
与镁条反应现象
溶液的pH值
快
慢
0
2.4
备注:①Mg条使用前要除去表面的氧化膜;②用pH计测定溶液的pH
开始1mol/L HCl与镁条反应剧烈,说明1mol/L HCl中氢离子浓度大,即氢离子浓度为1mol/L,说明HCl完全电离;而开始1mol/L CH3COOH与镁条反应较慢,说明其氢离子浓度较盐酸小,即小于1mol/L,说明醋酸在水中部分电离。HCl是强电解质,CH3COOH是弱电解质。
探究结果:
强电解质:
弱电解质:
在水溶液里或熔融状态下全部电离成离子的电解质(其离子无 分子化倾向)。包括大多数盐类、强酸、强碱、部分金属氧化物。
在水溶液里部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水、极少数盐[如HgCl2、(CH3COO)2Pb]。
NaCl = Na++Cl-
HAc H++Ac-
电解质强弱的区分标准:电解质在水溶液中的电离程度
CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。电解质的强弱与其溶解性有何关系?怎样区分强弱电解质?
强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离.
问题探讨
练1.下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______。
a.铜丝 b.金刚石 c.石墨 d.NaCl e.盐酸 f.蔗糖 g.CO2 h.Na2O i.硬脂酸 j.醋酸 l.碳酸氢铵 m.氢氧化铝 n.氯气 o. BaSO4
a c e
d h l o
i j m
f g
化
合
物
电解质
非电解质
强电解质
弱电解质
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI、HMnO4
强碱:NaOH、Ca(OH)2、Ba(OH)2、KOH、RbOH…
大部分盐:
活泼金属的氧化物:
弱酸:HF、HClO、H2CO3、H2SO3、H3PO4、CH3COOH
弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……
少部分盐:Pb(AC) 2
水
大部分有机物:除有机酸、碱、盐之外
非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……
小结:
强、弱电解质的比较:
项目 强电解质 弱电解质
相同点 都是电解质、都是化合物,熔融或在溶液中能电离
不
同
点 化合物类型 离子化合物、极性共价化合物 极性共价化合物
化学键 离子键、极性键 极性键
电离程度 完全电离 部分电离
电离过程 不可逆、不存在电离平衡 可逆、存在电离平衡
溶液中的微粒 水合离子 分子、水合离子
物质种类 强酸、强碱、大部分盐 弱酸、弱碱、水
再见
祝同学们学习进步!
地球是个“水球”,海洋、
江河和地下水成了离子反应广
泛存在的条件。
地球化学
酸、碱和盐在水溶液中的
反应,以离子反应为特征。是
一类不需要用活化能来引发的
反应。
本专题的学习以化学平衡理论
为基础,进一步探讨酸、碱、盐
在水中的离子反应,深入了解离
子反应的本质;探究化学平衡、
电离程度和溶解度之间的关系及
其应用。
专题3 溶液中的离子反应
(1)什么叫电解质?举例说明。
(2)什么叫非电解质?举例说明。
(3)电解质和非电解质的物质类属
是什么 两者的区分标准是什么
知识回顾:
强电解质和弱电解质
电解质和非电解质比较
电解质 非电解质
概念:在水溶液中或熔化状态下 在水溶液和熔化状态
能够导电的化合物。 下都不能导电的化合物。
和结构关系:大多数离子化合物 极性键或非极性键构成
强极性键共价化合物 的共价化合物
实例: 酸、碱 、盐,H2O 大多数有机物,SO3、CO2 等
1.石墨能导电,所以是电解质。
2.由于BaSO4不溶于水,所以不是电解质。
3.盐酸能导电,所以盐酸是电解质。
4.SO2、NH3、Na2O溶于水可导电,所以均为
电解质。
讨论以下几种说法是否正确,并说明原因。
1)单质
混合物
既不是电解质也不是非电解质
2) CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电的物质不是其本身
3)难溶的盐(BaSO4等)虽然水溶液不能导电
但是在融化时能导电,也是电解质。
注意
P58[活动与探究] 体积相同,浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH值
1mol/LHCl
1mol/LCH3COOH
与镁条反应现象
溶液的pH值
快
慢
0
2.4
备注:①Mg条使用前要除去表面的氧化膜;②用pH计测定溶液的pH
开始1mol/L HCl与镁条反应剧烈,说明1mol/L HCl中氢离子浓度大,即氢离子浓度为1mol/L,说明HCl完全电离;而开始1mol/L CH3COOH与镁条反应较慢,说明其氢离子浓度较盐酸小,即小于1mol/L,说明醋酸在水中部分电离。HCl是强电解质,CH3COOH是弱电解质。
探究结果:
强电解质:
弱电解质:
在水溶液里或熔融状态下全部电离成离子的电解质(其离子无 分子化倾向)。包括大多数盐类、强酸、强碱、部分金属氧化物。
在水溶液里部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc、H2S)、弱碱(如NH3·H2O)、水、极少数盐[如HgCl2、(CH3COO)2Pb]。
NaCl = Na++Cl-
HAc H++Ac-
电解质强弱的区分标准:电解质在水溶液中的电离程度
CaCO3、Fe(OH)3的溶解度都很小,CaCO3属于强电解质,而Fe(OH)3属于弱电解质;CH3COOH、HCl的溶解度都很大,HCl属于强电解质,而CH3COOH 属于弱电解质。电解质的强弱与其溶解性有何关系?怎样区分强弱电解质?
强弱电解质的区分依据不是看该物质溶解度的大小,也不是看其水溶液导电能力的强弱,而是看溶于水的部分是否完全电离.
问题探讨
练1.下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______。
a.铜丝 b.金刚石 c.石墨 d.NaCl e.盐酸 f.蔗糖 g.CO2 h.Na2O i.硬脂酸 j.醋酸 l.碳酸氢铵 m.氢氧化铝 n.氯气 o. BaSO4
a c e
d h l o
i j m
f g
化
合
物
电解质
非电解质
强电解质
弱电解质
强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI、HMnO4
强碱:NaOH、Ca(OH)2、Ba(OH)2、KOH、RbOH…
大部分盐:
活泼金属的氧化物:
弱酸:HF、HClO、H2CO3、H2SO3、H3PO4、CH3COOH
弱碱:NH3·H2O、Fe(OH)2、Fe(OH)3、……
少部分盐:Pb(AC) 2
水
大部分有机物:除有机酸、碱、盐之外
非金属的氧化物:CO、CO2、SO2、SO3、NO、NO2……
小结:
强、弱电解质的比较:
项目 强电解质 弱电解质
相同点 都是电解质、都是化合物,熔融或在溶液中能电离
不
同
点 化合物类型 离子化合物、极性共价化合物 极性共价化合物
化学键 离子键、极性键 极性键
电离程度 完全电离 部分电离
电离过程 不可逆、不存在电离平衡 可逆、存在电离平衡
溶液中的微粒 水合离子 分子、水合离子
物质种类 强酸、强碱、大部分盐 弱酸、弱碱、水
再见
祝同学们学习进步!
