强弱电解质[上学期]
图片预览






文档简介
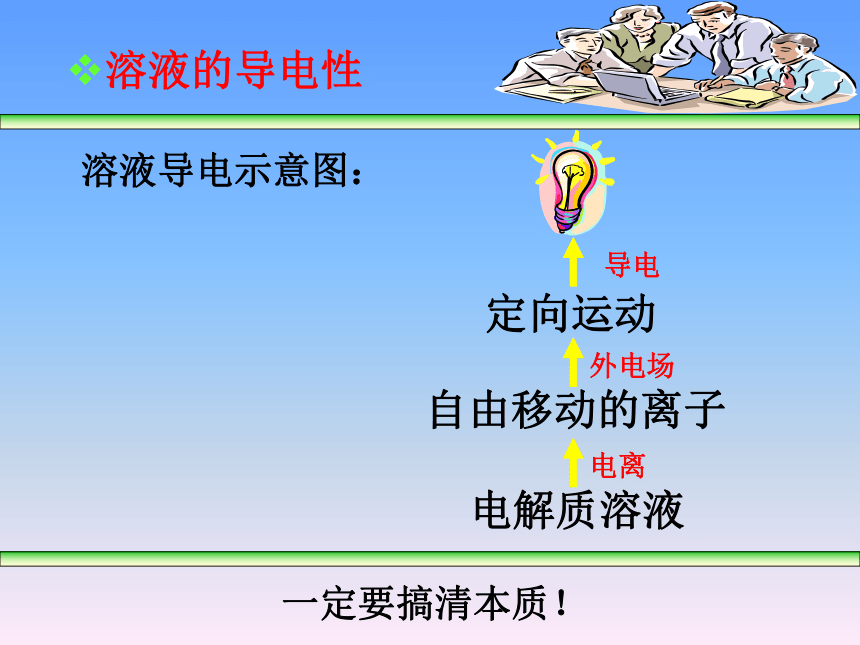
课件16张PPT。第二节 离子反应化学反应的分类化学反应据是否有电子转移可分为据是否有离子参加可分为据反应前后能量的变化据反应物、生成物类别及种类其它反应一、电解质和非电解质电解质:在水溶液或熔融状态下能导电的化合物非电解质:在水溶液和熔融状态下都不能导电的化合物(4)电解质溶液导电的原因:——存在自由移动的阴阳离子1、电解质和非电解质铜、CO2、氯化钠晶体、蔗糖、盐酸溶液是电解质吗?注意:化合物酸、碱、盐、活泼金属氧化物和水酒精、蔗糖、NH3 、非金属氧化物(2)电解质有:非电解质有:(3)单质既不是电解质也不是非电解质!(1)电解质和非电解质的研究范畴:SO2、NH3电解质和非电解质电解质:凡是在水溶液中或熔融状态下,能导电的化合物。非电解质:凡是在水溶液中和熔融状态下,都不能导电的化合物。凡是在水溶液中或熔融状态下,本身能电离出离子而导电的化合物。凡是在水溶液中和熔融状态下,本身不能电离出离子而导电的化合物。一定要搞清本质!电解质和非电解质讨论一:判断一个物质是否是电解质的依据是什么?问题与讨论讨论四:电解质在水溶液中和熔融状态下都能导电?讨论二:化合物不是电解质就是非电解质?讨论三:固体氯化钠不导电,所以它不是电解质?熔融状态下:离子化合物能电离成离子,能导电;
共价化合物不能电离,不能导电。(H2SO4)溶液的导电性溶液导电示意图:定向运动自由移动的离子电解质溶液一定要搞清本质!电离外电场导电问题与讨论溶液的导电性讨论一:不同的电解质溶液导电能力为什么不同?讨论二:离子数目越多导电能力越强?讨论三:同条件下的电解质溶液导电能力不同,说明什
么问题?如盐酸和醋酸。单位体积内离子个数不一样多——强 少——弱强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中部分电离成离子的电解质强酸 如
强碱 如
大多数盐 如 弱酸 如
弱碱 如
水二、强电解质和弱电解质强电解质和弱电解质问题与讨论讨论一:强电解质溶液的导电能力一定强?讨论二:难溶物一定是弱电解质?讨论三:同浓度的强电解质溶液的导电能力一定强于弱
电解质溶液的导电能力?离子化合物,
某些共价化合物某些共价化合物完全部分水分子、
阴阳离子水分子、分子、阴阳离子强弱大多数盐、强酸、
强碱弱酸、弱碱、水三、电离方程式:
1.左边用化学式表示,右边用离子符号:
2.强电解质用“=”连接,弱电解质用“ ”连接。
3.阴离子电荷总数等于阳离子电荷总数。NaCl=Na++Cl-练习:书写电离方程式
CH3COOH:
Ba(OH)2:
Al2(SO4) 3CH3COOH CH3COO-+H+Ba(OH)2= Ba2++2OH-Al2(SO4) 3 = 2Al3+ +3SO42-我是弱电解质我是强电解质,我更亮!?同学们再见练习:
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁(MgCl2)
B、液态氯化镁(MgCl2)
C、氨水 D、液态H3PO4
2、NaHSO4溶于水的电离方程式_________,
NaHSO4受热熔化的电离方程式_______。
判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质
5、BaSO4难溶于水,所以BaSO4是非电解质
6、电解质都能够导电,能导电的物质都是电解质
7、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXXXX
共价化合物不能电离,不能导电。(H2SO4)溶液的导电性溶液导电示意图:定向运动自由移动的离子电解质溶液一定要搞清本质!电离外电场导电问题与讨论溶液的导电性讨论一:不同的电解质溶液导电能力为什么不同?讨论二:离子数目越多导电能力越强?讨论三:同条件下的电解质溶液导电能力不同,说明什
么问题?如盐酸和醋酸。单位体积内离子个数不一样多——强 少——弱强电解质:在水溶液中全部电离成离子的电解质弱电解质:在水溶液中部分电离成离子的电解质强酸 如
强碱 如
大多数盐 如 弱酸 如
弱碱 如
水二、强电解质和弱电解质强电解质和弱电解质问题与讨论讨论一:强电解质溶液的导电能力一定强?讨论二:难溶物一定是弱电解质?讨论三:同浓度的强电解质溶液的导电能力一定强于弱
电解质溶液的导电能力?离子化合物,
某些共价化合物某些共价化合物完全部分水分子、
阴阳离子水分子、分子、阴阳离子强弱大多数盐、强酸、
强碱弱酸、弱碱、水三、电离方程式:
1.左边用化学式表示,右边用离子符号:
2.强电解质用“=”连接,弱电解质用“ ”连接。
3.阴离子电荷总数等于阳离子电荷总数。NaCl=Na++Cl-练习:书写电离方程式
CH3COOH:
Ba(OH)2:
Al2(SO4) 3CH3COOH CH3COO-+H+Ba(OH)2= Ba2++2OH-Al2(SO4) 3 = 2Al3+ +3SO42-我是弱电解质我是强电解质,我更亮!?同学们再见练习:
1、下列各项中的物质能导电且属于强电解质的是( )
A、固态氯化镁(MgCl2)
B、液态氯化镁(MgCl2)
C、氨水 D、液态H3PO4
2、NaHSO4溶于水的电离方程式_________,
NaHSO4受热熔化的电离方程式_______。
判断正误:
1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质
2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质
3、硝酸钾晶体不导电,硝酸钾溶液能导电,所以硝酸钾溶液是电解质,硝酸钾晶体是非电解质
4、把SO3溶于水所得的溶液能导电,所以SO3是电解质
5、BaSO4难溶于水,所以BaSO4是非电解质
6、电解质都能够导电,能导电的物质都是电解质
7、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXXXX
