难溶电解质的溶解平衡[下学期]
文档属性
| 名称 | 难溶电解质的溶解平衡[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 90.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-21 13:31:00 | ||
图片预览





文档简介
课件13张PPT。2019/2/27§3.4 难溶电解质的溶解平衡2019/2/27学习目标1.理解难溶电解质的溶解平衡。
2.溶度积和溶度积规则.
3.利用平衡移动原理分析沉淀的生成、溶解、转化。2019/2/271、盐类的水解实质:2、水解规律:3、影响因素有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
越弱越水解,都弱双水解。盐电离出来的离子与水电离出来的H + 或OH –
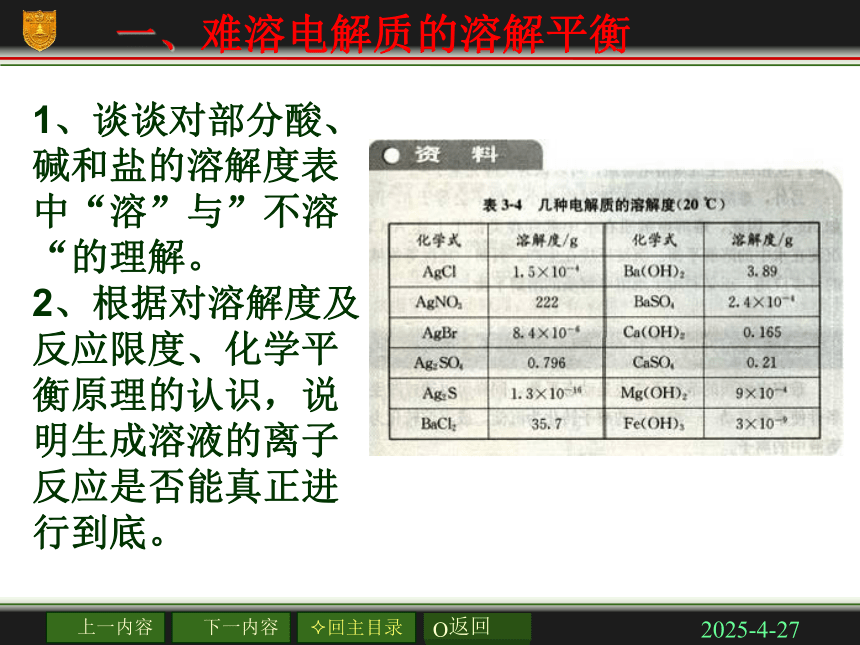
结合,从而使水的电离平衡发生移动的过程。课前复习2019/2/27一、难溶电解质的溶解平衡1、谈谈对部分酸、碱和盐的溶解度表中“溶”与”不溶“的理解。
2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成溶液的离子反应是否能真正进行到底。2019/2/27生成沉淀的离子反应反应之所以能够发生,在于生成物的溶解度小。
难溶电解质的溶解度尽管很小,但不会等于0(生成AgCl沉淀后的溶液中三种有关反应的粒子在反应体系中共存)。
习惯上,将溶解度小于0.01克的电解质称为难溶电解质
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。2019/2/27溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
MmAn的饱和溶液: Ksp=[Mn+]m·[Am-]n
溶度积规则:离子积Qc=c(Mn+)m·c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.二.溶度积和溶度积规则2019/2/271、沉淀的生成二、沉淀反应的应用2019/2/272、沉淀的溶解 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:CaCO3 Ca2+ + CO32-+H+HCO3- H2CO3 → H2O+CO2↑ 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:[实验3-3]2019/2/27 3、沉淀的转化 对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀.锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。CaSO4 SO42- + Ca2+ +
CO32-CaCO3[实验3-4]2019/2/27课堂练习1、下列说法中正确的是( )
A.不溶于不的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.物质的溶解性为难溶,则该物质不溶于水
2、下列各组离子,在水溶液中能以较高浓度大量共存的是( )
①I- ClO- NO3- H+ ②K+ NH4+ HCO3- OH-
③ SO42- SO32- Cl- OH- ④Fe3+ Cu2+ SO42- Cl -
⑤H+ K+ AlO2- HSO3- ⑥Ca2+ Na+ SO42- CO32-
A.①⑥ B.③④ C.②⑤ D.①④BB2019/2/27课堂练习3、以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性
B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS
D.溶解度小于CuS、PbS、CdSC2019/2/27课堂练习4、试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤
BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量2019/2/27
2.溶度积和溶度积规则.
3.利用平衡移动原理分析沉淀的生成、溶解、转化。2019/2/271、盐类的水解实质:2、水解规律:3、影响因素有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
越弱越水解,都弱双水解。盐电离出来的离子与水电离出来的H + 或OH –
结合,从而使水的电离平衡发生移动的过程。课前复习2019/2/27一、难溶电解质的溶解平衡1、谈谈对部分酸、碱和盐的溶解度表中“溶”与”不溶“的理解。
2、根据对溶解度及反应限度、化学平衡原理的认识,说明生成溶液的离子反应是否能真正进行到底。2019/2/27生成沉淀的离子反应反应之所以能够发生,在于生成物的溶解度小。
难溶电解质的溶解度尽管很小,但不会等于0(生成AgCl沉淀后的溶液中三种有关反应的粒子在反应体系中共存)。
习惯上,将溶解度小于0.01克的电解质称为难溶电解质
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。2019/2/27溶度积(Ksp):在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之乘积为一常数.
MmAn的饱和溶液: Ksp=[Mn+]m·[Am-]n
溶度积规则:离子积Qc=c(Mn+)m·c(Am-)n
Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀.
Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液.
Qc < Ksp,溶液未达饱和,沉淀发生溶解.二.溶度积和溶度积规则2019/2/271、沉淀的生成二、沉淀反应的应用2019/2/272、沉淀的溶解 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:CaCO3 Ca2+ + CO32-+H+HCO3- H2CO3 → H2O+CO2↑ 根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断移去溶解平衡体系中的相应离子,使平衡向沉淀溶解的方向移动,就可以使沉淀溶解。例如难溶于水的CaCO3沉淀可以溶于盐酸中:[实验3-3]2019/2/27 3、沉淀的转化 对于一些用酸或其他方法也不能溶解的沉淀,可以先将其转化为另一种用酸或其他方法能溶解的沉淀.锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。CaSO4 SO42- + Ca2+ +
CO32-CaCO3[实验3-4]2019/2/27课堂练习1、下列说法中正确的是( )
A.不溶于不的物质溶解度为0
B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.物质的溶解性为难溶,则该物质不溶于水
2、下列各组离子,在水溶液中能以较高浓度大量共存的是( )
①I- ClO- NO3- H+ ②K+ NH4+ HCO3- OH-
③ SO42- SO32- Cl- OH- ④Fe3+ Cu2+ SO42- Cl -
⑤H+ K+ AlO2- HSO3- ⑥Ca2+ Na+ SO42- CO32-
A.①⑥ B.③④ C.②⑤ D.①④BB2019/2/27课堂练习3、以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性
B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS
D.溶解度小于CuS、PbS、CdSC2019/2/27课堂练习4、试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤
BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量2019/2/27
