化学能转化为电能--电池(第一课时)[上学期]
文档属性
| 名称 | 化学能转化为电能--电池(第一课时)[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 388.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-09-30 22:00:00 | ||
图片预览




文档简介
课件18张PPT。2019/2/271第3节 化学能转化为电能——电池2019/2/272一、原电池的工作原理1.
知识回顾构成原电池的条件?3.什么是原电池?原电池的正负极和电子流向如何判断?2.2019/2/273原电池
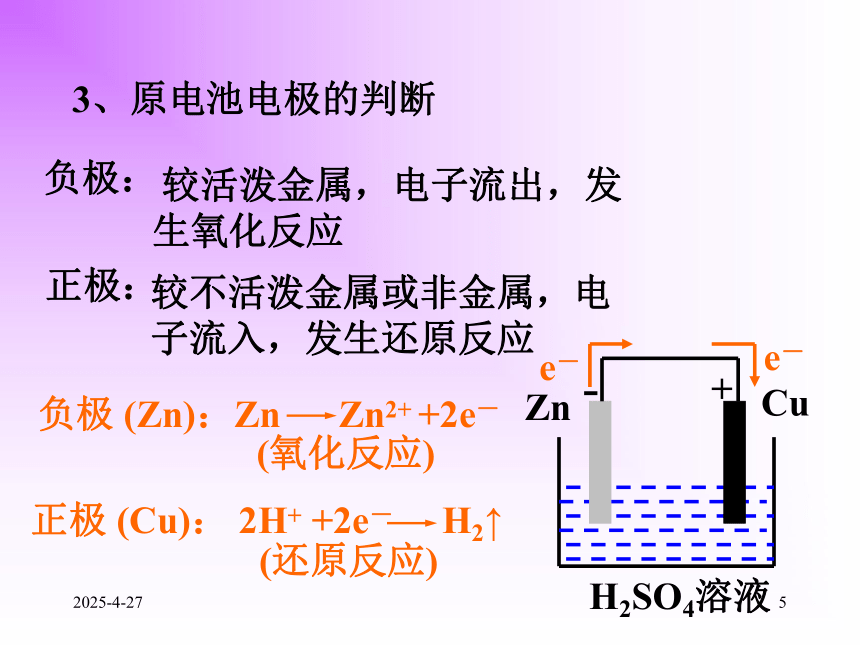
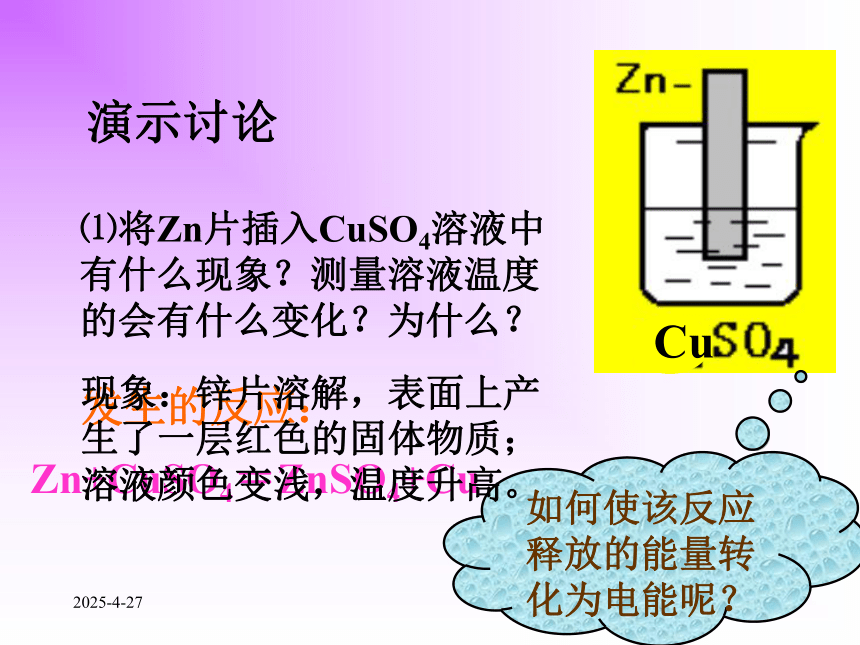
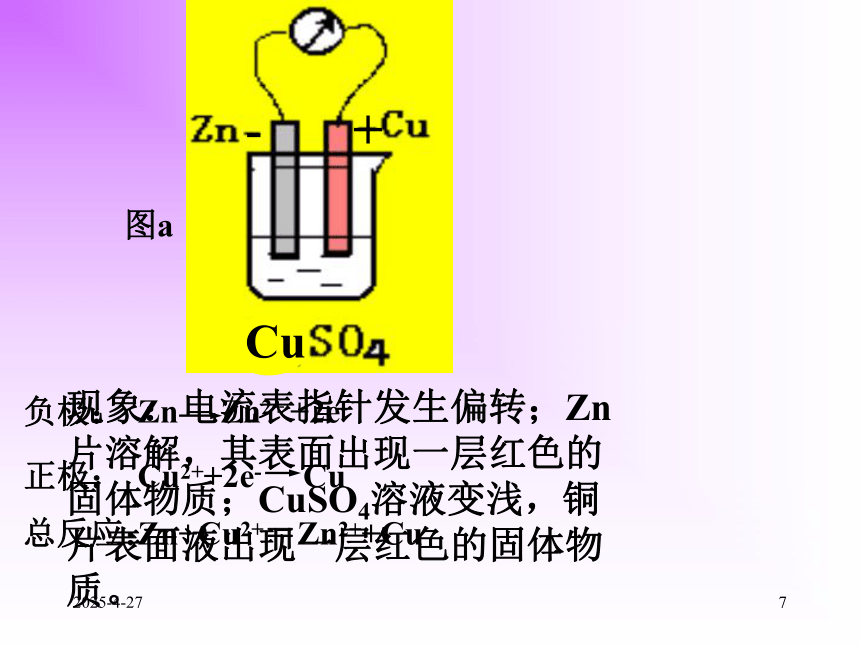
1、什么是原电池?化学能转化为的装置就叫原电池。将氧化还原反应的电能2019/2/2742.构成原电池的条件是什么? (1)有两个活泼性不同的电极(2)两电极都接触电解质溶液(3)在电极表面上能发生自发进行的氧化还原反应。(正极、负极、电解质溶液构成闭合回路)2019/2/2753、原电池电极的判断 较活泼金属,电子流出,发生氧化反应负极:正极:较不活泼金属或非金属,电子流入,发生还原反应负极 (Zn):Zn Zn2+ +2e-正极 (Cu): 2H+ +2e- H2↑ (氧化反应)(还原反应)-+2019/2/276⑴将Zn片插入CuSO4溶液中有什么现象?测量溶液温度的会有什么变化?为什么?演示讨论Cu Zn+CuSO4=ZnSO4+Cu发生的反应:如何使该反应释放的能量转化为电能呢?现象:锌片溶解,表面上产生了一层红色的固体物质;溶液颜色变浅,温度升高。2019/2/277负极:正极:总反应:Zn Zn2+ +2e-Cu2++2e- CuZn+Cu2+=Zn2++Cu图a-+现象:电流表指针发生偏转;Zn片溶解,其表面出现一层红色的固体物质;CuSO4溶液变浅,铜片表面液出现一层红色的固体物质。2019/2/278负极:正极:总反应:Zn Zn2+ +2e-Cu2++2e- CuZn+Cu2+=Zn2++Cu图b阳极阴极+-2019/2/279?如果取出盐桥还有电流通过吗?取出盐桥,由于Zn原子失电子成为Zn2+进入溶液,使ZnSO4溶液因Zn2+增加而带正电;同时Cu2+获得电子成为金属铜沉淀在铜片上,使CuSO4溶液因SO42-相对增加而带负电。这两种因素均会阻止电子从锌片流向铜片,而不产生电流。 没有,盐桥中的盐溶液是电解质溶液,能使两个烧杯中的溶液连成一个通路。当有盐桥存在时,随着反应的进行,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使电池不断产生电流。2019/2/2710图a图b原电池的两个电极反应组成电池的总反应称电池反应。(-)Zn| CuSO4|Cu(+)(-)Zn|ZnSO4|| CuSO4|Cu(+)2019/2/2711练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e- H2↑负极:总反应:正极:Zn Zn2+ +2e-Zn+2H+=Zn2++H2↑
2019/2/2712⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn Zn2+ +2e- 2H+ +2e- H2↑Zn+2H+=Zn2++H2↑Fe Fe2++ 2e - Cu2+ +2e- CuFe+Cu2+=Fe2++Cu或Fe+CuSO4=Cu+FeSO42019/2/2713⑥(×)(∨)负极:正极:总反应:Zn Zn2+ +2e-Cu2++2e- CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu⑦2019/2/2714⑧(×)(∨)负极:正极:总反应:Fe Fe2++ 2e- 2H++2e- H2↑Fe+2H+= Fe2++H2↑或 Fe+H2SO4=FeSO4+H2↑⑨2019/2/2715 ②正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。 ③原电池反应跟直接反应差别:
反应速率加快;一般只有一个电极直接参加反应。 ①原电池的工作原理是将氧化还原反应分在正(氧化)、负(还原)两极进行,负极上失去的电子流入正极,从而产生电流。明确以下几点 ④利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。2019/2/2716本节要点:
1,原电池概念。
2,构成原电池的条件。
3,原电池的正负极和电子流向判断。
4,原电池的工作原理。小 结2019/2/27171.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是2.试将下列两个氧化还原反应分别设计成两个原电池⑴Zn + 2AgNO3=Zn(NO3)2+2Ag⑵2Fe3++Fe=3Fe2+( D )(-)Zn∣AgNO3∣C (+)(-) Fe∣Fe2(SO4)3∣C (+)A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;作业:2019/2/2718?盐桥中通常装的是琼脂KCl饱和溶液
其作用主要是:连接闭合回路;以及保持两个半电池中溶液的电中性
什么是盐桥
知识回顾构成原电池的条件?3.什么是原电池?原电池的正负极和电子流向如何判断?2.2019/2/273原电池
1、什么是原电池?化学能转化为的装置就叫原电池。将氧化还原反应的电能2019/2/2742.构成原电池的条件是什么? (1)有两个活泼性不同的电极(2)两电极都接触电解质溶液(3)在电极表面上能发生自发进行的氧化还原反应。(正极、负极、电解质溶液构成闭合回路)2019/2/2753、原电池电极的判断 较活泼金属,电子流出,发生氧化反应负极:正极:较不活泼金属或非金属,电子流入,发生还原反应负极 (Zn):Zn Zn2+ +2e-正极 (Cu): 2H+ +2e- H2↑ (氧化反应)(还原反应)-+2019/2/276⑴将Zn片插入CuSO4溶液中有什么现象?测量溶液温度的会有什么变化?为什么?演示讨论Cu Zn+CuSO4=ZnSO4+Cu发生的反应:如何使该反应释放的能量转化为电能呢?现象:锌片溶解,表面上产生了一层红色的固体物质;溶液颜色变浅,温度升高。2019/2/277负极:正极:总反应:Zn Zn2+ +2e-Cu2++2e- CuZn+Cu2+=Zn2++Cu图a-+现象:电流表指针发生偏转;Zn片溶解,其表面出现一层红色的固体物质;CuSO4溶液变浅,铜片表面液出现一层红色的固体物质。2019/2/278负极:正极:总反应:Zn Zn2+ +2e-Cu2++2e- CuZn+Cu2+=Zn2++Cu图b阳极阴极+-2019/2/279?如果取出盐桥还有电流通过吗?取出盐桥,由于Zn原子失电子成为Zn2+进入溶液,使ZnSO4溶液因Zn2+增加而带正电;同时Cu2+获得电子成为金属铜沉淀在铜片上,使CuSO4溶液因SO42-相对增加而带负电。这两种因素均会阻止电子从锌片流向铜片,而不产生电流。 没有,盐桥中的盐溶液是电解质溶液,能使两个烧杯中的溶液连成一个通路。当有盐桥存在时,随着反应的进行,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使电池不断产生电流。2019/2/2710图a图b原电池的两个电极反应组成电池的总反应称电池反应。(-)Zn| CuSO4|Cu(+)(-)Zn|ZnSO4|| CuSO4|Cu(+)2019/2/2711练习⒈判断下列哪些装置构成了原电池?若不是,请说明理由;若是,请指出正负极名称,并写出电极反应式.①②③(×)(×)(∨)2H++2e- H2↑负极:总反应:正极:Zn Zn2+ +2e-Zn+2H+=Zn2++H2↑
2019/2/2712⑤④(∨)(∨)负极:正极:总反应:正极:负极:总反应:Zn Zn2+ +2e- 2H+ +2e- H2↑Zn+2H+=Zn2++H2↑Fe Fe2++ 2e - Cu2+ +2e- CuFe+Cu2+=Fe2++Cu或Fe+CuSO4=Cu+FeSO42019/2/2713⑥(×)(∨)负极:正极:总反应:Zn Zn2+ +2e-Cu2++2e- CuZn+Cu2+=Zn2++Cu或 Zn+CuSO4=ZnSO4+Cu⑦2019/2/2714⑧(×)(∨)负极:正极:总反应:Fe Fe2++ 2e- 2H++2e- H2↑Fe+2H+= Fe2++H2↑或 Fe+H2SO4=FeSO4+H2↑⑨2019/2/2715 ②正负两极上进出电子总数相等,根据电子守恒原理可进行许多有关电极反应的计算。 ③原电池反应跟直接反应差别:
反应速率加快;一般只有一个电极直接参加反应。 ①原电池的工作原理是将氧化还原反应分在正(氧化)、负(还原)两极进行,负极上失去的电子流入正极,从而产生电流。明确以下几点 ④利用原电池原理 可制作各种电池,如干电池、铅蓄电池、银锌电池、锂电池、氢氧燃料电池……。2019/2/2716本节要点:
1,原电池概念。
2,构成原电池的条件。
3,原电池的正负极和电子流向判断。
4,原电池的工作原理。小 结2019/2/27171.如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是2.试将下列两个氧化还原反应分别设计成两个原电池⑴Zn + 2AgNO3=Zn(NO3)2+2Ag⑵2Fe3++Fe=3Fe2+( D )(-)Zn∣AgNO3∣C (+)(-) Fe∣Fe2(SO4)3∣C (+)A. 铁圈和银圈左右摇摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;作业:2019/2/2718?盐桥中通常装的是琼脂KCl饱和溶液
其作用主要是:连接闭合回路;以及保持两个半电池中溶液的电中性
什么是盐桥
