第一章 第3节 化学能转化为电能-电解[下学期]
文档属性
| 名称 | 第一章 第3节 化学能转化为电能-电解[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 93.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-24 00:35:00 | ||
图片预览






文档简介
课件15张PPT。第3节 化学能转化为电能---电池澳头中学
聂思良知识回顾1,什么是氧化还原反应?它的特征和本质是?
2,金属还原性的强弱判断方法有?
化学反应中有元素的化合价发生变化的反应叫~,氧化还原反应的特征:元素化合价有变化.氧化还原反应本质:电子的转移(电子得失或电子对的偏向与偏离)①按其在周期表中的位置:同一周期,从左到右,金属还原性减弱.同一主族从上到下,金属还原性增强.②金属活动顺序表:从左到右,金属还原性减弱.③实验事实:与水(或酸)反应越容易,金属还原性越强.④从金属最高价氧化物对应的水化物的碱性:碱性越强,金属的还
原性越强.知识回顾3,日常生活中使用的几种电池:如手机电池,干电池等,你知道它们的的工作原理吗?
原电池的工作原理,原电池工作时把化学能转
化为电能。一、原电池的工作原理[活动·探究]
1、把锌片和铜片插入稀硫酸中,观察现象
2、导线把锌、铜片、电流计依次连起来,观察现象现象:锌片产生气泡,且锌片质量不断减少,
铜片上无明显变化。原因:锌能与稀硫酸反应生成氢气,且不断消
耗,而铜与稀硫酸反应反应。现象:Cu片上气泡放出,Zn片不断溶解,电流计偏转。原因: Zn比Cu活泼,容易失去电子,被氧
化为锌离子进入溶液。锌片上的电子通过导
线流向铜片;溶液中氢离子从Cu片上获得
电子被还原为氢气。电子在导线中定向移
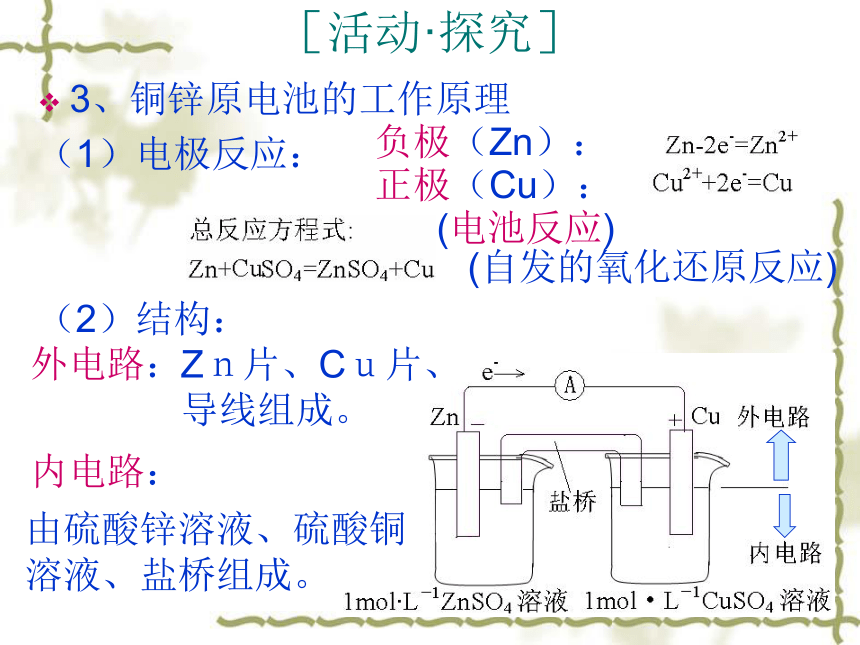
动形成电流。负极:正极:总反应式:(自发的氧化还原反应)[活动·探究]3、铜锌原电池的工作原理
(1)电极反应:
(2)结构:
负极(Zn):正极(Cu):(电池反应)(自发的氧化还原反应)外电路:内电路:Zn片、Cu片、
导线组成。由硫酸锌溶液、硫酸铜
溶液、盐桥组成。归纳:原电池1、概念:
2、组成条件:
3、电极反应、电池反应
电化学上将化学能转化为电能的装置叫~①电解质溶液②两个不同的电极,用导线连接起来(或直接接
触)同时插入电解质溶液中。③形成闭合回路。④有一个自发的氧化还原反应。外电路:负极是相对活泼的金属(失去电子),发生氧
化反应。正极是相对不活泼的金属(氧化物)(电子流
入),发生还原反应。归纳:原电池(续)3、电极反应、电池反应
4、电荷的流向:
5、电池的表示方法:内电路:阳极是发生氧化反应的一极,阴极是发生
还原反应的一极。电池反应:正极和负极电极反应的总和。技巧是消去得失电子数相加即可。①电子流动方向:②电流方向:外电路中,电子由负极经导线流向正极。电子不能通过电解质溶液。外电路中是电子的反方向。内电路为阳离子的定向移动方向。负极在左,正极在右。作业课本P34,1二、化学电源(1)种类
(2)重要的电池:构造,电极反应。
三、金属的腐蚀与防护1、金属的腐蚀:(1)概念
(2)金属腐蚀的类型:
(3)结论:金属电化学腐蚀的本质化学腐蚀:电化学腐蚀吸氧腐蚀:析氢腐蚀:当水膜为弱酸性或中性当水膜酸度较高时金属腐蚀被腐蚀的金属作为原电池的负极,金属原子变成
阳离子,阳极消耗。金属越活泼,越易电化学腐
蚀。2、金属的防护(1)概念:
(2)方法:①改变金属的内部结构,使金属性质改变,成为耐腐蚀的金属。如不锈钢。金属的防护就是防止金属的腐蚀。②覆盖保护层:③牺牲阳极保护法:④阴极电保护法
(外加电流阴极保护法):⑤使金属表面钝化,形成一层致密氧化物保护膜。例题11,下列试管中的铁钉腐蚀最快的是 ( )D例题22,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为
(2)B中Sn极上的电极反应为
Sn极附近溶液的PH (增大、减少、不变)
(3)C中被腐蚀的金属是 ,电池反应为
比较A、B、
C中铁被腐蚀的速率,由快到慢的顺序是
增大ZnB>A>c例题33,下图各容器中盛有海水,铁在其中的腐蚀由快到慢的顺序是( )
小结:
A金属被腐蚀的速率快慢规律电解原理引起的腐蚀>原电池引起的腐蚀>
化学腐蚀>有防腐措施的腐蚀作业(课外)P35 2,3,4,5,7
聂思良知识回顾1,什么是氧化还原反应?它的特征和本质是?
2,金属还原性的强弱判断方法有?
化学反应中有元素的化合价发生变化的反应叫~,氧化还原反应的特征:元素化合价有变化.氧化还原反应本质:电子的转移(电子得失或电子对的偏向与偏离)①按其在周期表中的位置:同一周期,从左到右,金属还原性减弱.同一主族从上到下,金属还原性增强.②金属活动顺序表:从左到右,金属还原性减弱.③实验事实:与水(或酸)反应越容易,金属还原性越强.④从金属最高价氧化物对应的水化物的碱性:碱性越强,金属的还
原性越强.知识回顾3,日常生活中使用的几种电池:如手机电池,干电池等,你知道它们的的工作原理吗?
原电池的工作原理,原电池工作时把化学能转
化为电能。一、原电池的工作原理[活动·探究]
1、把锌片和铜片插入稀硫酸中,观察现象
2、导线把锌、铜片、电流计依次连起来,观察现象现象:锌片产生气泡,且锌片质量不断减少,
铜片上无明显变化。原因:锌能与稀硫酸反应生成氢气,且不断消
耗,而铜与稀硫酸反应反应。现象:Cu片上气泡放出,Zn片不断溶解,电流计偏转。原因: Zn比Cu活泼,容易失去电子,被氧
化为锌离子进入溶液。锌片上的电子通过导
线流向铜片;溶液中氢离子从Cu片上获得
电子被还原为氢气。电子在导线中定向移
动形成电流。负极:正极:总反应式:(自发的氧化还原反应)[活动·探究]3、铜锌原电池的工作原理
(1)电极反应:
(2)结构:
负极(Zn):正极(Cu):(电池反应)(自发的氧化还原反应)外电路:内电路:Zn片、Cu片、
导线组成。由硫酸锌溶液、硫酸铜
溶液、盐桥组成。归纳:原电池1、概念:
2、组成条件:
3、电极反应、电池反应
电化学上将化学能转化为电能的装置叫~①电解质溶液②两个不同的电极,用导线连接起来(或直接接
触)同时插入电解质溶液中。③形成闭合回路。④有一个自发的氧化还原反应。外电路:负极是相对活泼的金属(失去电子),发生氧
化反应。正极是相对不活泼的金属(氧化物)(电子流
入),发生还原反应。归纳:原电池(续)3、电极反应、电池反应
4、电荷的流向:
5、电池的表示方法:内电路:阳极是发生氧化反应的一极,阴极是发生
还原反应的一极。电池反应:正极和负极电极反应的总和。技巧是消去得失电子数相加即可。①电子流动方向:②电流方向:外电路中,电子由负极经导线流向正极。电子不能通过电解质溶液。外电路中是电子的反方向。内电路为阳离子的定向移动方向。负极在左,正极在右。作业课本P34,1二、化学电源(1)种类
(2)重要的电池:构造,电极反应。
三、金属的腐蚀与防护1、金属的腐蚀:(1)概念
(2)金属腐蚀的类型:
(3)结论:金属电化学腐蚀的本质化学腐蚀:电化学腐蚀吸氧腐蚀:析氢腐蚀:当水膜为弱酸性或中性当水膜酸度较高时金属腐蚀被腐蚀的金属作为原电池的负极,金属原子变成
阳离子,阳极消耗。金属越活泼,越易电化学腐
蚀。2、金属的防护(1)概念:
(2)方法:①改变金属的内部结构,使金属性质改变,成为耐腐蚀的金属。如不锈钢。金属的防护就是防止金属的腐蚀。②覆盖保护层:③牺牲阳极保护法:④阴极电保护法
(外加电流阴极保护法):⑤使金属表面钝化,形成一层致密氧化物保护膜。例题11,下列试管中的铁钉腐蚀最快的是 ( )D例题22,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)A中反应的离子方程式为
(2)B中Sn极上的电极反应为
Sn极附近溶液的PH (增大、减少、不变)
(3)C中被腐蚀的金属是 ,电池反应为
比较A、B、
C中铁被腐蚀的速率,由快到慢的顺序是
增大ZnB>A>c例题33,下图各容器中盛有海水,铁在其中的腐蚀由快到慢的顺序是( )
小结:
A金属被腐蚀的速率快慢规律电解原理引起的腐蚀>原电池引起的腐蚀>
化学腐蚀>有防腐措施的腐蚀作业(课外)P35 2,3,4,5,7
