化学能与电能[上学期]
图片预览

文档简介
《化学能转化为电能》教案
江苏省扬州中学高一化学备课组
教学目标:
知识目标:通过实验探究, 使学生认识化学能可以转化为电能,初步认识原电池的结构和工作原理。学会判断原电池的正、负极,初步认识电极反应式及原电池反应方程式的书写。
情感目标:培养学生的探究精神和依据实验事实得出结论的科学态度,训练科学的学习方法,渗透环境保护意识
能力目标:培养学生探究式的思维能力、自学能力和动手能力及发现问题、分析问题和解决问题的能力。
教学重点、难点:原电池原理,构成原电池的一般条件。
教学方法:1、实验探究法——通过实验、分析、讨论、总结应用等过程,引导学生观察、思考、推理、探究。
2、利用多媒体将微观、抽象的理论转为具体、直观的形象。
学习方法:实验——观察——思考——讨论——结论——应用。
教学用品:铁丝、铜丝、锌片、铜片、镁条、铅笔芯、火柴梗、西红柿、稀硫酸、无水乙醇、导线、烧杯、电流计、实物展台、投影仪。
教学过程:
『导入』1、火电厂的基本原理
2、伽伐尼的青蛙抽搐实验及伏打电堆
『实验探究』
实物投影实验:
实 验 步 骤 现 象 或 结 论
1.锌片插入稀硫酸(投影实验)
2.铜片插入稀硫酸(投影实验)
3.锌片和铜片上端连接在一起插入稀硫酸(投影实验)
4.锌片和铜片之间连电流表一起插入稀硫酸
5.用电流计判断电极名称
6.能量转化
『学生讨论』
1、铜与稀硫酸不反应,但与锌片相连后,铜片上有气泡产生,是如何生成的
2、电流计指针偏转方向如何 和干电池对比确定电极名称。
3、试从能量角度分析此装置和锌单独与稀硫酸的反应有何不同。
『教师引导学生讨论、归纳、结合模拟动画得出结论』
[投影]化学能转化为电能
一、原电池
1、概念:将化学能转化成电能的装置称为原电池
2、电极名称及电极反应:负极(锌片):Zn-2e-=Zn2+ 正极(铜片):2H++2e-=H2↑
原电池总反应: Zn + 2H+ = Zn2+ + H2↑
3、电子方向: 由负极经导线到正极 电流方向:正极到负极
4、实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移到氧化剂。
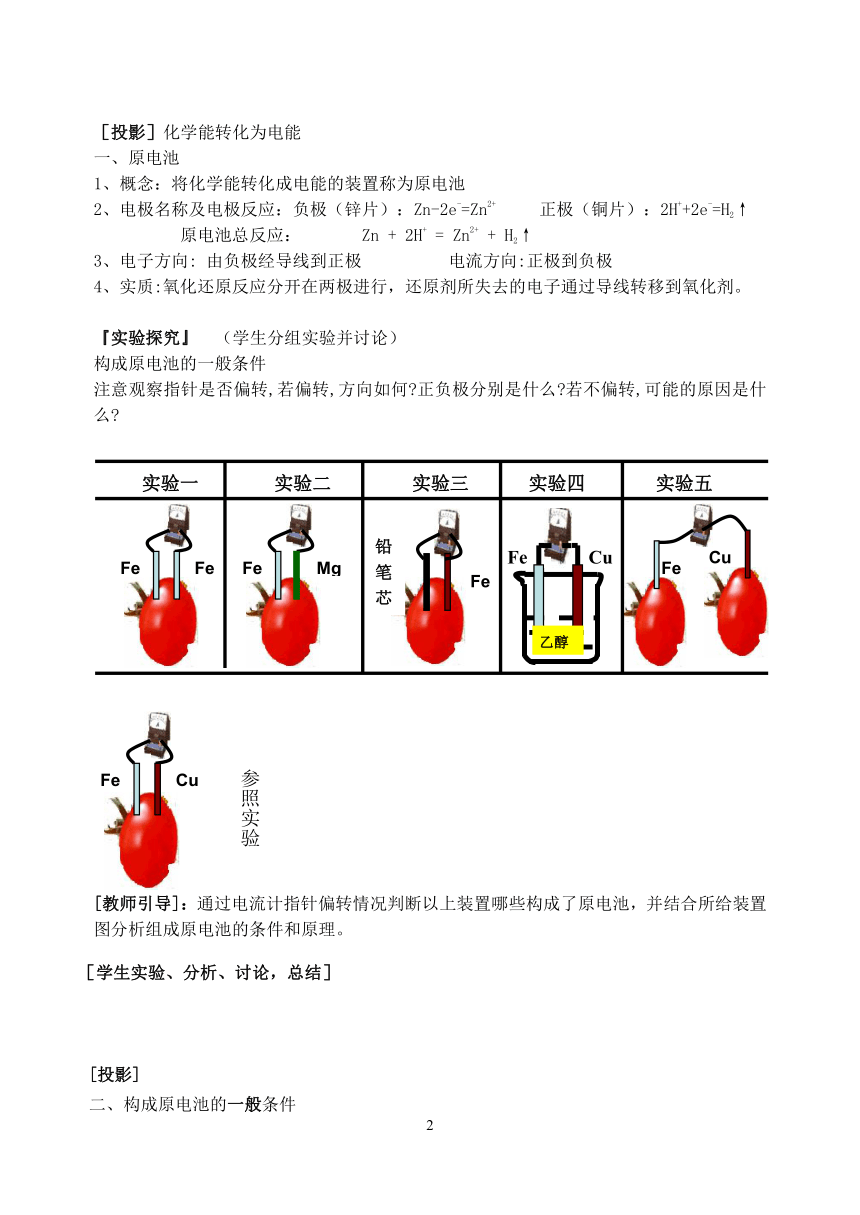
『实验探究』 (学生分组实验并讨论)
构成原电池的一般条件
注意观察指针是否偏转,若偏转,方向如何 正负极分别是什么 若不偏转,可能的原因是什么
[教师引导]:通过电流计指针偏转情况判断以上装置哪些构成了原电池,并结合所给装置图分析组成原电池的条件和原理。
[学生实验、分析、讨论,总结]
[投影]
二、构成原电池的一般条件
①有氧化还原反应
②两个活泼性不同的电极
负极:较活泼的电极 (氧化反应, 电子流出)
正极:较不活泼的金属、石墨等 (还原反应, 电子流入)
③同时与电解质溶液接触
④形成闭合回路
[练习] 投影练习,学生练习
[问题解决] (配以音乐卡)
1、青蛙抽搐实验的解释
2、巴格达电池
3、泰坦尼克号面临的二次毁灭 (电化学腐蚀)
[投影]
三、原电池原理的应用
1、设计各种实用电池,使其具有节约能源、方便、环保等优点以满足人类需要及可持续发展的要求
2、金属的腐蚀及防护
[研究性学习]
1、利用日常用品设计原电池,并检测电流的产生。(启发可利用音乐卡)
2、“解剖”一节废弃的一号干电池,了解其构造及组成,调查日常所用电池的种类及用途 。
3、调查废电池对环境产生的污染及产生的原因,我们应如何应对
[课后巩固]
1、某原电池的总反应的离子方程式是: Zn+Cu2+=Zn2++Cu
依据此反应设计的原电池的正确组合是 ( )
正极 负极 电极同时浸入
(A) Cu Zn 稀盐酸
(B) Zn Zn 硫酸铜溶液
(C) Cu Zn 氯化铜溶液
(D) Cu Zn 四氯化碳
2、把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,d极上产生大量气泡;a、c相连时,电流由c经导线流向a;b、d相连电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为 ( )
(A) a>b>c>d (B) a>c>d>b
(C) c>a>b>d (D) b>d>c>a
[板书设计]
化学能转化为电能
一、原电池
1、概念:将化学能转化成电能的装置称为原电池
2、电极名称及电极反应:负极(锌片):Zn-2e-=Zn2+ (氧化反应)
正极(铜片):2H++2e-=H2↑ (还原反应)
原电池总反应:Zn + 2H+ = Zn2+ + H2↑ (氧化还原反应)
3、电子方向: 由负极经导线到正极 电流方向:正极到负极
4、实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移到氧化剂。
二、构成原电池的一般条件
①有氧化还原反应
②两个活泼性不同的电极
负极:较活泼的电极 (氧化反应, 电子流出)
正极:较不活泼的金属、石墨等 (还原反应, 电子流入)
③同时与电解质溶液接触
④形成闭合回路
以上几个条件需同时满足。
三、原电池原理的应用
1、设计各种实用电池,使其具有节约能源、方便、环保等优点以满足人类需要及可持续发展的要求
2、金属的腐蚀及防护
实验四
Fe
铅笔芯
参照实验
Cu
Fe
实验五
实验三
Cu
Fe
Mg
Fe
实验二
Fe
Fe
实验一
乙醇
Cu
Fe
PAGE
3
江苏省扬州中学高一化学备课组
教学目标:
知识目标:通过实验探究, 使学生认识化学能可以转化为电能,初步认识原电池的结构和工作原理。学会判断原电池的正、负极,初步认识电极反应式及原电池反应方程式的书写。
情感目标:培养学生的探究精神和依据实验事实得出结论的科学态度,训练科学的学习方法,渗透环境保护意识
能力目标:培养学生探究式的思维能力、自学能力和动手能力及发现问题、分析问题和解决问题的能力。
教学重点、难点:原电池原理,构成原电池的一般条件。
教学方法:1、实验探究法——通过实验、分析、讨论、总结应用等过程,引导学生观察、思考、推理、探究。
2、利用多媒体将微观、抽象的理论转为具体、直观的形象。
学习方法:实验——观察——思考——讨论——结论——应用。
教学用品:铁丝、铜丝、锌片、铜片、镁条、铅笔芯、火柴梗、西红柿、稀硫酸、无水乙醇、导线、烧杯、电流计、实物展台、投影仪。
教学过程:
『导入』1、火电厂的基本原理
2、伽伐尼的青蛙抽搐实验及伏打电堆
『实验探究』
实物投影实验:
实 验 步 骤 现 象 或 结 论
1.锌片插入稀硫酸(投影实验)
2.铜片插入稀硫酸(投影实验)
3.锌片和铜片上端连接在一起插入稀硫酸(投影实验)
4.锌片和铜片之间连电流表一起插入稀硫酸
5.用电流计判断电极名称
6.能量转化
『学生讨论』
1、铜与稀硫酸不反应,但与锌片相连后,铜片上有气泡产生,是如何生成的
2、电流计指针偏转方向如何 和干电池对比确定电极名称。
3、试从能量角度分析此装置和锌单独与稀硫酸的反应有何不同。
『教师引导学生讨论、归纳、结合模拟动画得出结论』
[投影]化学能转化为电能
一、原电池
1、概念:将化学能转化成电能的装置称为原电池
2、电极名称及电极反应:负极(锌片):Zn-2e-=Zn2+ 正极(铜片):2H++2e-=H2↑
原电池总反应: Zn + 2H+ = Zn2+ + H2↑
3、电子方向: 由负极经导线到正极 电流方向:正极到负极
4、实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移到氧化剂。
『实验探究』 (学生分组实验并讨论)
构成原电池的一般条件
注意观察指针是否偏转,若偏转,方向如何 正负极分别是什么 若不偏转,可能的原因是什么
[教师引导]:通过电流计指针偏转情况判断以上装置哪些构成了原电池,并结合所给装置图分析组成原电池的条件和原理。
[学生实验、分析、讨论,总结]
[投影]
二、构成原电池的一般条件
①有氧化还原反应
②两个活泼性不同的电极
负极:较活泼的电极 (氧化反应, 电子流出)
正极:较不活泼的金属、石墨等 (还原反应, 电子流入)
③同时与电解质溶液接触
④形成闭合回路
[练习] 投影练习,学生练习
[问题解决] (配以音乐卡)
1、青蛙抽搐实验的解释
2、巴格达电池
3、泰坦尼克号面临的二次毁灭 (电化学腐蚀)
[投影]
三、原电池原理的应用
1、设计各种实用电池,使其具有节约能源、方便、环保等优点以满足人类需要及可持续发展的要求
2、金属的腐蚀及防护
[研究性学习]
1、利用日常用品设计原电池,并检测电流的产生。(启发可利用音乐卡)
2、“解剖”一节废弃的一号干电池,了解其构造及组成,调查日常所用电池的种类及用途 。
3、调查废电池对环境产生的污染及产生的原因,我们应如何应对
[课后巩固]
1、某原电池的总反应的离子方程式是: Zn+Cu2+=Zn2++Cu
依据此反应设计的原电池的正确组合是 ( )
正极 负极 电极同时浸入
(A) Cu Zn 稀盐酸
(B) Zn Zn 硫酸铜溶液
(C) Cu Zn 氯化铜溶液
(D) Cu Zn 四氯化碳
2、把a、b、c、d 4块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,d极上产生大量气泡;a、c相连时,电流由c经导线流向a;b、d相连电子由d经导线流向b,则此4种金属的活动性由强到弱的顺序为 ( )
(A) a>b>c>d (B) a>c>d>b
(C) c>a>b>d (D) b>d>c>a
[板书设计]
化学能转化为电能
一、原电池
1、概念:将化学能转化成电能的装置称为原电池
2、电极名称及电极反应:负极(锌片):Zn-2e-=Zn2+ (氧化反应)
正极(铜片):2H++2e-=H2↑ (还原反应)
原电池总反应:Zn + 2H+ = Zn2+ + H2↑ (氧化还原反应)
3、电子方向: 由负极经导线到正极 电流方向:正极到负极
4、实质:氧化还原反应分开在两极进行,还原剂所失去的电子通过导线转移到氧化剂。
二、构成原电池的一般条件
①有氧化还原反应
②两个活泼性不同的电极
负极:较活泼的电极 (氧化反应, 电子流出)
正极:较不活泼的金属、石墨等 (还原反应, 电子流入)
③同时与电解质溶液接触
④形成闭合回路
以上几个条件需同时满足。
三、原电池原理的应用
1、设计各种实用电池,使其具有节约能源、方便、环保等优点以满足人类需要及可持续发展的要求
2、金属的腐蚀及防护
实验四
Fe
铅笔芯
参照实验
Cu
Fe
实验五
实验三
Cu
Fe
Mg
Fe
实验二
Fe
Fe
实验一
乙醇
Cu
Fe
PAGE
3
