人教版-初三化学中考复习之化学方程式[下学期]
文档属性
| 名称 | 人教版-初三化学中考复习之化学方程式[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 114.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-17 20:26:00 | ||
图片预览







文档简介
课件21张PPT。中考复习课化学方程式执教者: 丰唐初中 张海波学习目标:正确理解质量守恒定律,知道”质量守恒”的内在原因并会运用质量守恒定律知识解题掌握化学方程式的书写与计算学以致用,能运用本节知识解决实际问题,培养良好的科学精神和人文精神将12g镁分别在一定的氧气中燃烧,有如下实验数据:案例导入:遭遇问题,准备应对吧!请思考: 1、这三次试验哪一次符合质量守恒定律?
2、第一次为什么会生成10克氧化镁而不是16克氧化镁?哪一种物质有剩余?
3、第三次为什么会生成20克氧化镁而不是28克氧化镁?哪一种物质有剩余?1、提出假设 物质发生化学反应后,其质量总和_________
2、实验验证及结论
3、实验分析 用原子的观点对结论的解释是________________
不变对质量守恒定律的探究:一、质量守恒定律
1、质量守恒定律:
参加反应的各物质__________ 等于反应后生成的各物质的___________。
2、化学反应“质量守恒”的原因:
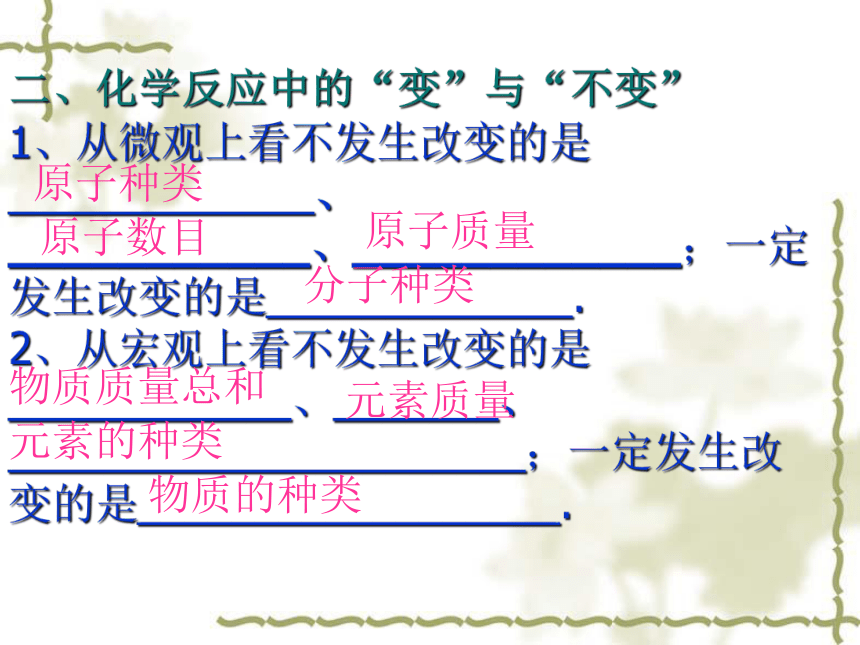
在化学反应前后___________没有改变、_______没有增减,___________没有改变。考点归纳:质量总和质量总和原子种类数目原子质量二、化学反应中的“变”与“不变”
1、从微观上看不发生改变的是_____________、
___________、____________;一定发生改变的是_____________.
2、从宏观上看不发生改变的是____________、_______、
______________________;一定发生改变的是__________________.原子种类原子数目原子质量分子种类物质质量总和元素的种类物质的种类元素质量三、质量守恒定律的应用简单计算例1、在化学反应A +B = C 中,10克A物质恰好与8克B物质完全反应,则生成C物质的质量为 ( )
A、 8克B、18克C、10克
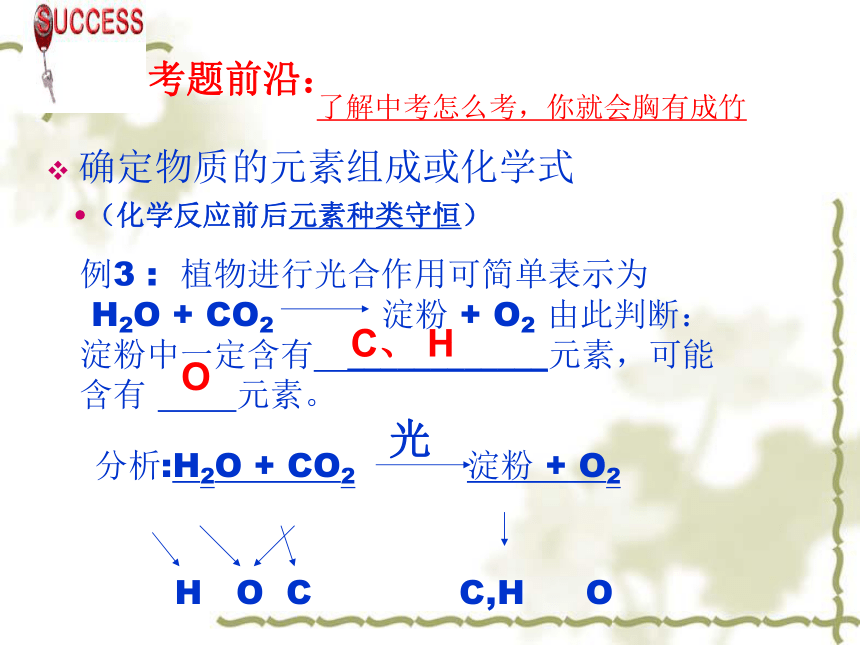
D、无法确定B(化学反应前后物质的总质量守 恒)考题前沿:了解中考怎么考,你就会胸有成竹确定物质的元素组成或化学式(化学反应前后元素种类守恒)C、 HO2005年中考题:食物中的糖类给人体提供热量,某糖X在人体内发生的反应是:
X+6O2=6CO2+6H2O,则X的化学式为:___________;判断的依据是_______________。C6H12O6质量守恒定律案例导入:你准备好了吗?下图是某种胃药的部分标识,小强的爸爸按标识要求服用两天胃药,理论上可以反应掉多少毫克盐酸?XX牌胃药
成分:每片含
AL(OH)3
260mg
服用方法:
每日3次
每次2片知识梳理:回忆一下,看你掌握了多少?1、化学方程式的定义_________
2、化学方程式的书写原则:
____________,_____________
3、化学方程式的涵义_________
4、化学方程式的书写步骤
____,______,_______,_______考题前沿:1、书写化学方程式
食品包装袋中的干燥剂(CaO)的防潮作用______________________________
汽车尾气中含有CO和NO等有害气体,其净化过程如下:
在催化剂的条件下CO将NO还原为
N2————————————————
再通入足量的氧气使剩余的CO完全氧化________________________2、关于化学方程式的计算化学方程式计算的依据:各个反应物和生成物的质量比。质量比的表示1、实际质量比2、相对分子质量×化学计量数化学方程式计算的主要类型:1、简单计算:3、综合计算:1、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?2、由锌和碳酸钠组成的混合物中,加入足量的稀硫酸,完全反应后,将生成的4.6克气体,全部通入足量的石灰水中,生成10克沉淀,求混合物中锌的质量分数。应用学以致用,学会创新化学方程式:2H2+O2===2H2O给我们提供了哪些重要信息?点燃拓展探究:氢氧化铜分解能得到两种产物,其中一种为固体,为了确定这种固体的成分,进行了如下的探究活动:Cu(OH)2假设:生成的产物可能是Cu2O,也可能是————————
资料:氧化亚铜是红色固体
实验:将新制的氢氧化铜粉末放入试管加热,蓝色逐渐变成黑色
推测结论:该黑色粉末是氧化铜,依据是————————
验证结论:设计一个简单的实验,证明这种推断是正确的。谢谢再见
2、第一次为什么会生成10克氧化镁而不是16克氧化镁?哪一种物质有剩余?
3、第三次为什么会生成20克氧化镁而不是28克氧化镁?哪一种物质有剩余?1、提出假设 物质发生化学反应后,其质量总和_________
2、实验验证及结论
3、实验分析 用原子的观点对结论的解释是________________
不变对质量守恒定律的探究:一、质量守恒定律
1、质量守恒定律:
参加反应的各物质__________ 等于反应后生成的各物质的___________。
2、化学反应“质量守恒”的原因:
在化学反应前后___________没有改变、_______没有增减,___________没有改变。考点归纳:质量总和质量总和原子种类数目原子质量二、化学反应中的“变”与“不变”
1、从微观上看不发生改变的是_____________、
___________、____________;一定发生改变的是_____________.
2、从宏观上看不发生改变的是____________、_______、
______________________;一定发生改变的是__________________.原子种类原子数目原子质量分子种类物质质量总和元素的种类物质的种类元素质量三、质量守恒定律的应用简单计算例1、在化学反应A +B = C 中,10克A物质恰好与8克B物质完全反应,则生成C物质的质量为 ( )
A、 8克B、18克C、10克
D、无法确定B(化学反应前后物质的总质量守 恒)考题前沿:了解中考怎么考,你就会胸有成竹确定物质的元素组成或化学式(化学反应前后元素种类守恒)C、 HO2005年中考题:食物中的糖类给人体提供热量,某糖X在人体内发生的反应是:
X+6O2=6CO2+6H2O,则X的化学式为:___________;判断的依据是_______________。C6H12O6质量守恒定律案例导入:你准备好了吗?下图是某种胃药的部分标识,小强的爸爸按标识要求服用两天胃药,理论上可以反应掉多少毫克盐酸?XX牌胃药
成分:每片含
AL(OH)3
260mg
服用方法:
每日3次
每次2片知识梳理:回忆一下,看你掌握了多少?1、化学方程式的定义_________
2、化学方程式的书写原则:
____________,_____________
3、化学方程式的涵义_________
4、化学方程式的书写步骤
____,______,_______,_______考题前沿:1、书写化学方程式
食品包装袋中的干燥剂(CaO)的防潮作用______________________________
汽车尾气中含有CO和NO等有害气体,其净化过程如下:
在催化剂的条件下CO将NO还原为
N2————————————————
再通入足量的氧气使剩余的CO完全氧化________________________2、关于化学方程式的计算化学方程式计算的依据:各个反应物和生成物的质量比。质量比的表示1、实际质量比2、相对分子质量×化学计量数化学方程式计算的主要类型:1、简单计算:3、综合计算:1、将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
(1)生成氧气的质量是多少克?
(2)原混合物中氯酸钾和二氧化锰分别为多少克?2、由锌和碳酸钠组成的混合物中,加入足量的稀硫酸,完全反应后,将生成的4.6克气体,全部通入足量的石灰水中,生成10克沉淀,求混合物中锌的质量分数。应用学以致用,学会创新化学方程式:2H2+O2===2H2O给我们提供了哪些重要信息?点燃拓展探究:氢氧化铜分解能得到两种产物,其中一种为固体,为了确定这种固体的成分,进行了如下的探究活动:Cu(OH)2假设:生成的产物可能是Cu2O,也可能是————————
资料:氧化亚铜是红色固体
实验:将新制的氢氧化铜粉末放入试管加热,蓝色逐渐变成黑色
推测结论:该黑色粉末是氧化铜,依据是————————
验证结论:设计一个简单的实验,证明这种推断是正确的。谢谢再见
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
