2.1 金属材料(课件 37张ppt)
图片预览







文档简介
这些建筑物所用的各种物品都是由什么材料制成的?你知道它是由哪些元素组成的吗?
金属材料(合金)
无机非金属材料(水泥.玻璃.陶瓷)
有机合成材料 (合成纤维.塑料.橡胶)
常见
材料
几十万种材料;由100多种元素不同的排列组合而形成的。
它们主要由什么材料制成的?
建筑
桥梁
器械
交通
生活
其它
金属材料
纯金属
合 金
合金是混合物:如黄铜.铝合金.钢铁
最常见的金属材料就是铁及其合金
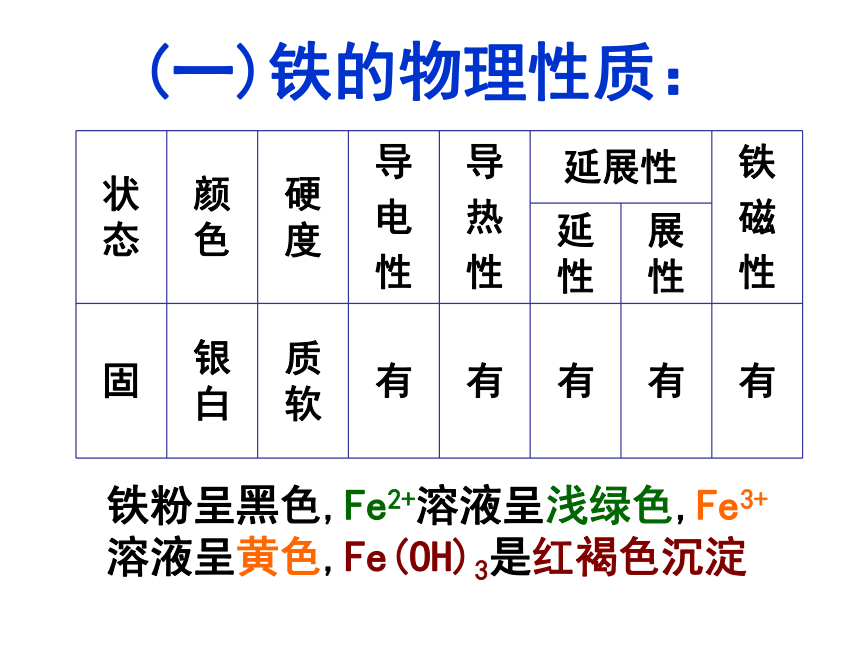
(一)铁的物理性质:
铁粉呈黑色,Fe2+溶液呈浅绿色,Fe3+溶液呈黄色,Fe(OH)3是红褐色沉淀
状态 颜色 硬度 导
电
性 导
热
性 延展性 铁
磁
性
延性 展性
固 银白 质软 有 有 有 有 有
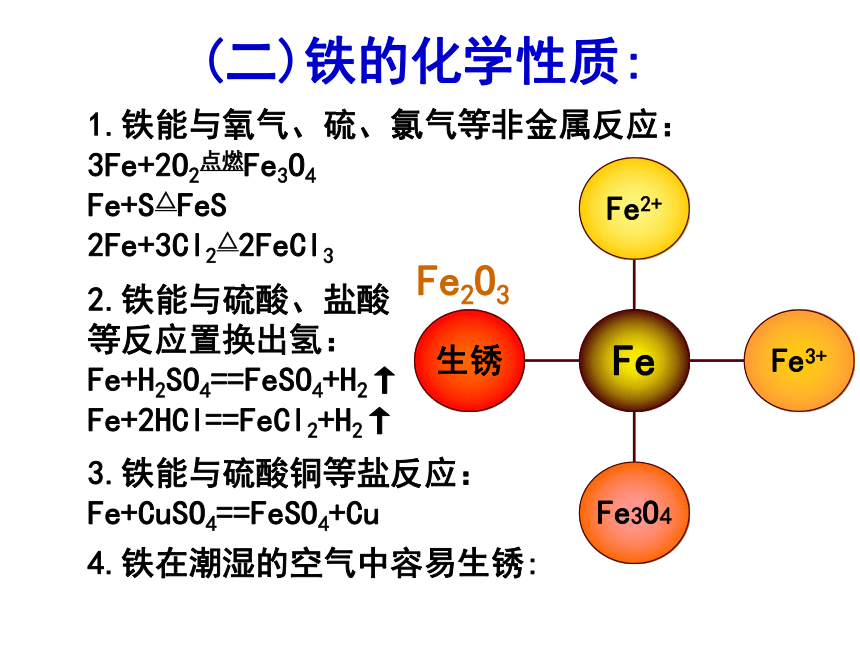
(二)铁的化学性质:
1.铁能与氧气、硫、氯气等非金属反应:
3Fe+2O2点燃Fe3O4
Fe+S△FeS
2Fe+3Cl2△2FeCl3
2.铁能与硫酸、盐酸
等反应置换出氢:
Fe+H2SO4==FeSO4+H2↑
Fe+2HCl==FeCl2+H2↑
3.铁能与硫酸铜等盐反应:
Fe+CuSO4==FeSO4+Cu
4.铁在潮湿的空气中容易生锈:
Fe2O3
铝镁合金主要特点:用其压铸的零部件轻薄,具有表面光亮,质量轻,强度重量比高,尺寸稳定性,吸震性好,散热快,抗静电等特点。主要用途:广泛应用于高档家用电器,如壁挂式电视机外壳.笔记本电脑外壳.通讯电子产品.汽车零.部件的制造。用此材料加工制造的产品可100%的回收再利用,符合环保概念。 ??镁合金主要用途:用于航空.航天.国防,汽车工业及制作各种镁合金型材.
铅.锡.铅锡合金性质比较
1.观察它们的外观:
都具有银白色金属光泽的固体.
2.导电性实验:
最 大
两者之间
最 小
3.压力实验:
用相同大小的力,用一枚铁钉在每块金属表面往下压10秒钟左右,用放大镜观察凹陷面的深浅。
铅锡合金最浅,锡块最深。
4.熔化试验:
各剪下一小块铅.锡和铅锡合金,放入坩锅内加热,观察熔化的先后情况。
铅锡合金最先熔化
铅锡合金的性质与纯铅.锡金属相比,你觉得有哪些改变?
金属 铅 锡 铅锡合金
电流表读数
合金与纯金属相比,性能上发生了改变,说明物质组成改变会使其性能改变.
合金与组成它们纯金属性质之比较
根据以上实验及通过下表可知合金与组成它们纯金属的性质有何异同?你可得出怎样的结论?
结论:
合金往往比金属具有更好的性能.
1.合金的熔点比它的各成分金属的熔点都低.
2.合金的导电性能比它的各成分金属的导电性能都弱(电阻率大).
3.合金的强度或硬度大部分比纯金属强.
性质比较 黄铜 铜 焊锡 锡
颜色与 光泽 黄色有光泽 紫红色有光泽 银白色有光泽 银白色 有光泽
硬度 比铜大 坚韧 坚硬 质软
熔点 比铜低 较高 比锡低 较高
在通常所用的金属材料中,很多都是由合金制成的.那么什么是合金呢?
1.合金:由2种或2种以上的金属熔合在一起形成的具有金属特性混合物(也可以是金属与非金属结合)
注意:1.合金一定有金属特征
2.合金不是单质,也化合物,
是一种特殊的混合物
3.合金=金属+金属(或非金属)
4.合金中至少含一种金属.
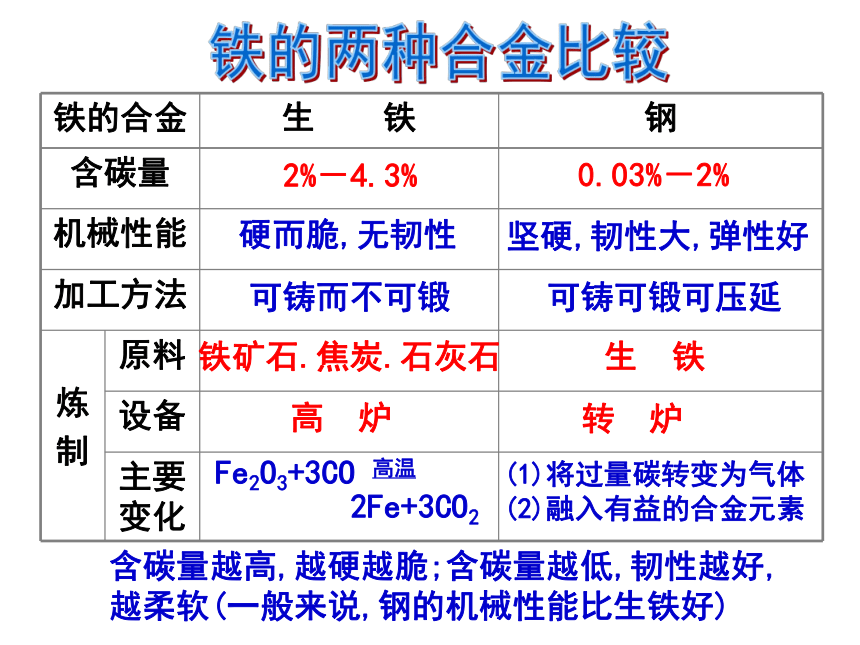
2.铁的合金——钢和生铁。
根本区别在于含碳量不同
铁碳合金(钢):是最常见.应用最广的一种合金材料
2%-4.3%
0.03%-2%
铁矿石.焦炭.石灰石
生 铁
高 炉
Fe2O3+3CO 高温
2Fe+3CO2
(1)将过量碳转变为气体
(2)融入有益的合金元素
硬而脆,无韧性
坚硬,韧性大,弹性好
可铸而不可锻
可铸可锻可压延
含碳量越高,越硬越脆;含碳量越低,韧性越好,越柔软(一般来说,钢的机械性能比生铁好)
转 炉
铁的合金 生 铁 钢
含碳量
机械性能
加工方法
炼
制 原料
设备
主要变化
易锈蚀是许多金属共同弊端
随着科学技术的不断进步,人类对于钢铁的需求量也在不断的增大,我国是钢铁生产大国,钢铁工人不断的制造出一些性能优良的钢材;但是,根据一些数据统计,每年由于锈蚀而浪费掉的钢铁材料仍占每年钢铁产量的1/4,因此给国家带来了较为严重的经济损失。
你知道钢铁产生锈蚀的原因是什么吗?
金属产生锈蚀的条件有哪些?
1、提出问题:
可能与金属的内部结构有关……
可能与是否与氧气接触有关
可能与空气的湿度有关
3、设计实验:
(以铁的锈蚀为例)
实验装置图:
( )
干燥剂
一段 时间后
通过B.C的比较可知铁的锈蚀与 有关,通过 的比较可知铁的锈蚀与水有关;本实验中 为对照组。
空气
A.C
C
4、结论:
金属的锈蚀与水.空气等物质有关
若想验证金属的锈蚀可能与金属的内部结构有关,该如何设计实验呢?
5、利用纯铁(D)按上述方案进行实验,纯铁生锈了吗,为什么?
6、比较(D与A):铁锈蚀的内部条件是:______________________。
与内部结构有关
探究影响铁生锈速率的因素
酸性污染物的存在 (酸雨)
加快生锈速度
电解质溶液 (如.氯化钠浓度)
高溫 (加快化学反应速度)
……
经刮擦或凹凸扭曲表面(增加接触面)
根据铁生锈的条件,如何采取防锈措施?
铁锈蚀的原因:
1.周围环境介质(如:H2O.O2.CO2)
2.金属内部结构(如:纯铁不易生锈)
防锈 方法
保护膜法
改变内部结构法(加Cr.Ni制不锈钢)
非金属覆盖层(如搪瓷等)
金属镀层(如镀锌等)
自身氧化膜保护层(Fe3O4)
最常用
最理想
问1.铁内融入Cr.Ni与表面镀上Cr.Ni制成的都是铁合金吗?防锈原理一样吗?
问2.被水淋湿的自行车能用带油抹布擦吗?
问3.铁生锈有其利用价值吗?
①医疗上的“理疗特效热”——如:热敷袋
②食品包装中用作双吸剂
红褐色或棕黄色的铁锈(主要成分是氧化铁Fe2O3)
很疏松,易吸水,因此,铁制品表面的锈如不及时除
去,会加快铁制品的生锈速度。
铁
更不易
金属的锈蚀还与金属内部的结构有关.
问4.不锈钢和生铁的主要成分是 ,不锈钢比生铁 生锈,为什么?
小林同学发现铜制眼镜框表面出现了绿色物
质,通过化学学习知道该物质为铜锈,俗称铜
绿,主要成分是Cu2(OH)2CO3。
[提出问题] 铜是在什么条件下锈蚀的?小林对此进行
了探究。
[猜想] 根据铜锈的化学式,猜想铜生锈可能是铜与水 . , 共同作用的结果。
O2
CO2
[设计与实验] 借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”实验如右图所示:
(1)实验较长时间后,发现 试管中的光亮铜片最先生锈(填字母编号)。
(2)从优化实验的角度考虑,A实验是多余的,他只考虑了水这个单一条件。C试管中除光亮铜片、蒸馏水外,还有的另外一种物质为 。
(3)D试管除光亮铜片外,还有的另外两种物质为 ;从D试管的实验中,获得的结论是 。
B
O2或CO2
CO2和O2
水是生成铜锈的必要条件
[评价与改进] 我认为小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确结论,还要补充的一个实验是(可图示) 。
[反思与小结] 通过铜片锈蚀条件的探究实验,我获得的启示是:
铜生锈比铁困难;要控制好变量;应设置对比实验……
CO2或O2
1.生铁和稀盐酸溶液充分反应后,总
会有残渣产生,残渣的成分是( )
A.铁? B.氯化铁 C.氯化亚铁 D.碳和一些杂质
2.下列物质中属于合金的是( )
A.三氧化二铁???????B.高炉炼出的生铁??? C.不锈钢
D.铁矿石 E.铁粉和铜粉混合 F.白铁
4.下列各项比较中,正确的是( )
A.含碳量:生铁>钢 B.含铁量:Fe2O3 > FeO
C.地壳中元素含量:Al > Fe D.韧性:生铁>钢
A.C
D
B.C
5.某课外活动小组去一家废旧金属回收公司辨别废生铁和废钢,他们运用所学的生铁和钢的性能.用途等有关知识进行辨别,收获很大。试问:该课外活动小组可能是用哪些方法辨别废生铁和废钢的?
(1)看部件的用途; (2)敲击听声音
(3)可用铁锤敲击看其韧性、脆性等
6.现有一种铁合金样品8.7克,与足量的稀硫酸反应,产生了0.3克氢气,根据上述实验数据和获取的资料,通过计算推断,这种碳素钢是生铁还是钢?
7.有铁样品10克,在氧气中充分燃烧后生成二氧化碳通入足量的澄清石灰水中,生成沉淀0.5克,通过计算确定该样品是生铁还是钢?
8.在氧气的制取和性质的实验中,某同学取一段纱窗上的细铁丝,在自己收集的氧气中做铁丝在氧气中燃烧的实验,结果没有观察到火星四射的现象,造成实验失败的原因不可能的是( )
A.收集的氧气太少或纯度不够 B.铁丝已生锈
C.集气瓶底部没有放少量的细砂 D.铁丝温度没有达到着火点
C
9.下列关于铁的性质的说法正确的是( )
A.铁在温暖干燥的环境中易生锈B.铁能置换出硫酸中的氢气
C.铁能与氯气反应生成氯化铁 D.铁能置换出硫酸镁中的镁
C
10.关于铁的下列说法正确的是( )
A.铁能和高温水蒸气.硝酸锌溶液.盐酸发生置换反应
B.在铁制品表面涂油漆或电镀上一层其他金属,这两种防锈措施的原理是相同的
C.炼铁的过程是铁矿石(主要成分是Fe3O4/Fe2O3)被氧化过程 D.铁是地壳中含量最多的金属
B
11.下列关于物质组成的说法中正确的是( )
A.钢含碳的质量分数大于生铁含碳的质量分数
B.二氧化碳是由碳和氧气组成的混合物
C.酒精只含C、H两种元素
D.煤是由多种有机物和一些无机物组成的混合物
12.铁是人类生活、生产实际中应用很广的一种金属材料。有关铁的叙述正确的是( )
A.使用铁锅比使用铝锅更有利于人的健康
B.铁是一种晶体,熔化时温度逐渐升高
C.铁能置换出酸中的氢气
D.铁是电的良导体,因为铁是由铁原子直接构成的
D
A
13.某学生做了如下实验:将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球悬浮于液面;将几枚小铁钉投入烧杯中,到不再 有气泡逸出(溶液的体积变化忽略不计),和开始相比,小球的位 置将( )
A.上浮 B.不变 C.下沉 D.沉至杯底
A
14.铜币在历史上曾经是一种广泛流通的货币,已知铜的熔点是1083.4℃,铁的熔点是15348℃。
(1)请从物理性质角度说明为什么用铜而不用铁来铸造货币。
铜的熔点比铁的熔点低,便于铸造。
(2)请用典型的例子说明铁金属活动性比铜强,并指出所依据的化学反应属于哪种基本反应类型。
铁可以从可溶性的铜盐中置换出铜来;铁可以与盐酸发生置换反应,而铜却不能与盐酸发生置换反应.
15.氯化铁是一种良好的净水剂,化学上可以用多种方法来制取,请写出四种用铁及铁的化合物通过一步化学反应制取氯化铁的四个化学方程式: (注:碳酸铁不要作反应物)
2Fe+3Cl2△2FeCl3
Fe2O3+6HCl=2FeCl3+3H2O
Fe(OH)3+3HCl=FeCl3+3H2O
Fe2(SO4)3+BaCl2=BaSO4↓ +2FeCl3
混合物
4Al+3O2==2Al2O3
2Al+3H2SO4===Al2(SO4)3+3H2
16.广东佛山是有色金属之乡,其中铝合金材料的产量约占全国的一半;铝合金材料属于_______(选填“纯净物”“混合物”或“单质”),铝是活泼金属,生活中的铝锅却有较强的抗腐蚀性,原因是__________________(用化学方程式表示)如果将铝片投入到稀硫酸中,片刻之后才有气泡产生,请用化学方程式表示这一过程:
Al2O3+3H2SO4===Al2(SO4)3+3H2O
17.巳知+3价铁盐跟铁粉在溶液中能发生化合反应,生成亚铁盐,现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉剩余,最终得到一种浅绿色的溶液;写出整个实验过程中所发生的化学方程式。
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
2FeCl3+Fe=3FeCl2
金属污染的来源:
1.日常生活废弃的金属垃圾;
2.大量工业废弃的金属垃圾;
3.工厂排出含重金属的污水.
金属污染危害
1.浪费大量资源
2.铝等金属在自然界不会自行分解,积累在土壤中,破坏土壤结构.
3.含铅.镉等有毒金属被腐蚀后,导致土壤和地下水源重金属污染及危害生态环境.
4.大量使用含铅汽油和废弃的电池都可引起土壤重金属污染.
目前我国的垃圾处理方法主要以填埋为主
水俣病和汞污染
整整五十年前即1950年,在日本西部九州岛的东俣小镇,发生了一系列使人们莫明其妙而又十分震惊的事情:海面有死鱼漂浮,空中有鸟儿毙命,海里有贝类腐烂、海藻枯死,陆地上有猫儿发疯,跳海自杀,更可怕的是发现有人莫明其妙的突然口齿不清、呆痴流涎、耳聋失明、精神失常,最后痛苦的死去,这就是当时震惊日本朝野的水俣病。 经过近10年的研究,到1959年,人们才弄明白这是甲基汞中毒,是由于人们和猫食用了含甲基汞的鱼和贝类引起的。可是甲基汞是哪里来的?为什么鱼和贝类中含有甲基汞呢?经过大量研究,最后才弄明白是由于附近一家氮肥厂,用含汞的化合物作为催化剂,而将含有汞的废水排入大海,从而在鱼和贝类中富集,这种生物富集是逐渐浓缩的过程,最后甲基汞含量可以达到百万分之五--百万分之二十,而安全的最高含量不过为百万分之零点五。水俣病病因的查明,使人们进一步揭示了有毒物质在生态系统循环的规律。
密度在5以上的金属统称为重金属,如金.银.铜.铅.锌.镍.钴.镉.铬和汞等45种。从环境污染方面所说的重金属,实际上主要是指汞.镉.铅.铬以及类金属砷等生物毒性显著的重金属,也指具有一定毒性的一般重金属如锌.铜.钴.镍.锡等。目前最引起人们注意的是汞.镉.铬.铅等。重金属随废水排出时,即使浓度很小,也可能造成危害。由重金属造成的环境污染称为重金属污染。重金属污染的特点表现在以下几方面: (1)水体中的某些重金属可在微生物作用下转化为毒性更强的金属化合物,如汞的甲基化作用就是其中典型例子;
(2)生物从环境中摄取重金属可以经过食物链的生物富集作用,在较高级生物体内成千万倍地富集起来,然后通过食物进入人体,在人体的某些器官中积蓄起来造成慢性中毒,危害人体健康;
(3)在天然水体中只要有微量重金属即可产生毒性效应,一般重金属产生毒性的范围大约在1—10mg/L之间,毒性较强的金属如汞.镉等产生毒性的质量浓度范围在0.0l—0.001mg/L之间。
重金属污染
防治金属污染方法
1.垃圾进行分类回收
2.分类回收各种废弃金属材料循环再利用
3.使用无铅汽油。
4.废旧电池不能任意丢弃。
5.工业废水和废渣不能任意排放和堆放。
废干电池的处理
方案例举:1.对锌的回收:
剥下干电池外面的锌皮,并用小刀或纱纸去掉表面的杂质,洗净干燥。(可用作实验室制氢气的原料)
2.对汞的回收:(Hg2+) 向初步处理后的废液中,加入铜屑、铁屑或锌粒,置换出汞。
3.对镉.镍的回收:(Cd2+、Ni2+)
提示:Cd(OH)2Ni(OH)2难溶于水。向含Cd2+的废液中,加入可溶性碱,生成沉淀,过滤,洗涤,干燥。
金属材料(合金)
无机非金属材料(水泥.玻璃.陶瓷)
有机合成材料 (合成纤维.塑料.橡胶)
常见
材料
几十万种材料;由100多种元素不同的排列组合而形成的。
它们主要由什么材料制成的?
建筑
桥梁
器械
交通
生活
其它
金属材料
纯金属
合 金
合金是混合物:如黄铜.铝合金.钢铁
最常见的金属材料就是铁及其合金
(一)铁的物理性质:
铁粉呈黑色,Fe2+溶液呈浅绿色,Fe3+溶液呈黄色,Fe(OH)3是红褐色沉淀
状态 颜色 硬度 导
电
性 导
热
性 延展性 铁
磁
性
延性 展性
固 银白 质软 有 有 有 有 有
(二)铁的化学性质:
1.铁能与氧气、硫、氯气等非金属反应:
3Fe+2O2点燃Fe3O4
Fe+S△FeS
2Fe+3Cl2△2FeCl3
2.铁能与硫酸、盐酸
等反应置换出氢:
Fe+H2SO4==FeSO4+H2↑
Fe+2HCl==FeCl2+H2↑
3.铁能与硫酸铜等盐反应:
Fe+CuSO4==FeSO4+Cu
4.铁在潮湿的空气中容易生锈:
Fe2O3
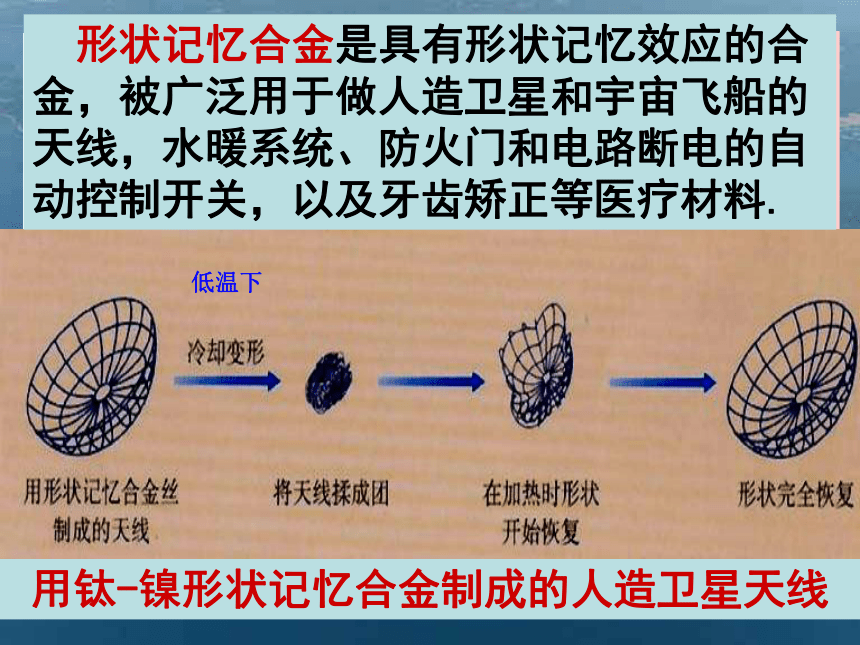
铝镁合金主要特点:用其压铸的零部件轻薄,具有表面光亮,质量轻,强度重量比高,尺寸稳定性,吸震性好,散热快,抗静电等特点。主要用途:广泛应用于高档家用电器,如壁挂式电视机外壳.笔记本电脑外壳.通讯电子产品.汽车零.部件的制造。用此材料加工制造的产品可100%的回收再利用,符合环保概念。 ??镁合金主要用途:用于航空.航天.国防,汽车工业及制作各种镁合金型材.
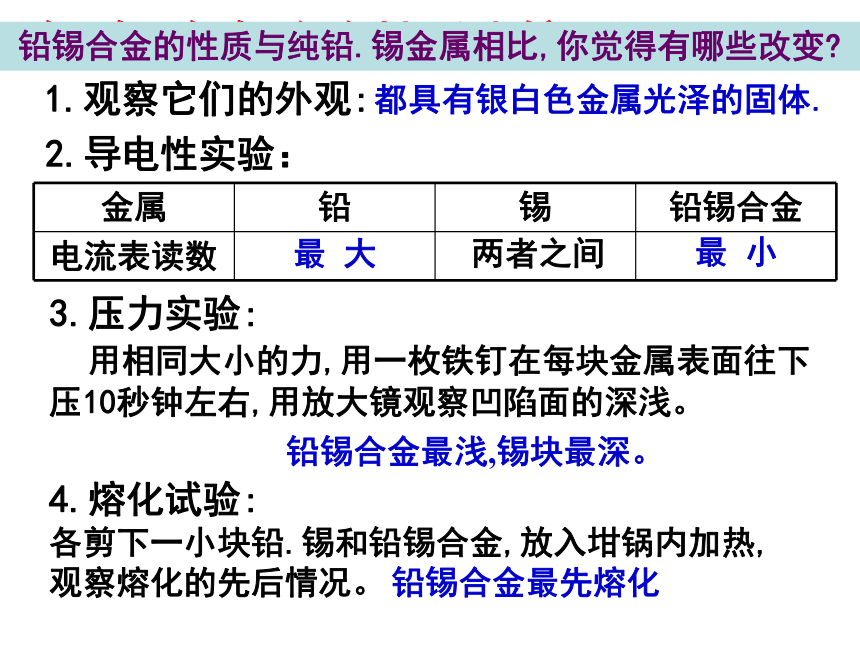
铅.锡.铅锡合金性质比较
1.观察它们的外观:
都具有银白色金属光泽的固体.
2.导电性实验:
最 大
两者之间
最 小
3.压力实验:
用相同大小的力,用一枚铁钉在每块金属表面往下压10秒钟左右,用放大镜观察凹陷面的深浅。
铅锡合金最浅,锡块最深。
4.熔化试验:
各剪下一小块铅.锡和铅锡合金,放入坩锅内加热,观察熔化的先后情况。
铅锡合金最先熔化
铅锡合金的性质与纯铅.锡金属相比,你觉得有哪些改变?
金属 铅 锡 铅锡合金
电流表读数
合金与纯金属相比,性能上发生了改变,说明物质组成改变会使其性能改变.
合金与组成它们纯金属性质之比较
根据以上实验及通过下表可知合金与组成它们纯金属的性质有何异同?你可得出怎样的结论?
结论:
合金往往比金属具有更好的性能.
1.合金的熔点比它的各成分金属的熔点都低.
2.合金的导电性能比它的各成分金属的导电性能都弱(电阻率大).
3.合金的强度或硬度大部分比纯金属强.
性质比较 黄铜 铜 焊锡 锡
颜色与 光泽 黄色有光泽 紫红色有光泽 银白色有光泽 银白色 有光泽
硬度 比铜大 坚韧 坚硬 质软
熔点 比铜低 较高 比锡低 较高
在通常所用的金属材料中,很多都是由合金制成的.那么什么是合金呢?
1.合金:由2种或2种以上的金属熔合在一起形成的具有金属特性混合物(也可以是金属与非金属结合)
注意:1.合金一定有金属特征
2.合金不是单质,也化合物,
是一种特殊的混合物
3.合金=金属+金属(或非金属)
4.合金中至少含一种金属.
2.铁的合金——钢和生铁。
根本区别在于含碳量不同
铁碳合金(钢):是最常见.应用最广的一种合金材料
2%-4.3%
0.03%-2%
铁矿石.焦炭.石灰石
生 铁
高 炉
Fe2O3+3CO 高温
2Fe+3CO2
(1)将过量碳转变为气体
(2)融入有益的合金元素
硬而脆,无韧性
坚硬,韧性大,弹性好
可铸而不可锻
可铸可锻可压延
含碳量越高,越硬越脆;含碳量越低,韧性越好,越柔软(一般来说,钢的机械性能比生铁好)
转 炉
铁的合金 生 铁 钢
含碳量
机械性能
加工方法
炼
制 原料
设备
主要变化
易锈蚀是许多金属共同弊端
随着科学技术的不断进步,人类对于钢铁的需求量也在不断的增大,我国是钢铁生产大国,钢铁工人不断的制造出一些性能优良的钢材;但是,根据一些数据统计,每年由于锈蚀而浪费掉的钢铁材料仍占每年钢铁产量的1/4,因此给国家带来了较为严重的经济损失。
你知道钢铁产生锈蚀的原因是什么吗?
金属产生锈蚀的条件有哪些?
1、提出问题:
可能与金属的内部结构有关……
可能与是否与氧气接触有关
可能与空气的湿度有关
3、设计实验:
(以铁的锈蚀为例)
实验装置图:
( )
干燥剂
一段 时间后
通过B.C的比较可知铁的锈蚀与 有关,通过 的比较可知铁的锈蚀与水有关;本实验中 为对照组。
空气
A.C
C
4、结论:
金属的锈蚀与水.空气等物质有关
若想验证金属的锈蚀可能与金属的内部结构有关,该如何设计实验呢?
5、利用纯铁(D)按上述方案进行实验,纯铁生锈了吗,为什么?
6、比较(D与A):铁锈蚀的内部条件是:______________________。
与内部结构有关
探究影响铁生锈速率的因素
酸性污染物的存在 (酸雨)
加快生锈速度
电解质溶液 (如.氯化钠浓度)
高溫 (加快化学反应速度)
……
经刮擦或凹凸扭曲表面(增加接触面)
根据铁生锈的条件,如何采取防锈措施?
铁锈蚀的原因:
1.周围环境介质(如:H2O.O2.CO2)
2.金属内部结构(如:纯铁不易生锈)
防锈 方法
保护膜法
改变内部结构法(加Cr.Ni制不锈钢)
非金属覆盖层(如搪瓷等)
金属镀层(如镀锌等)
自身氧化膜保护层(Fe3O4)
最常用
最理想
问1.铁内融入Cr.Ni与表面镀上Cr.Ni制成的都是铁合金吗?防锈原理一样吗?
问2.被水淋湿的自行车能用带油抹布擦吗?
问3.铁生锈有其利用价值吗?
①医疗上的“理疗特效热”——如:热敷袋
②食品包装中用作双吸剂
红褐色或棕黄色的铁锈(主要成分是氧化铁Fe2O3)
很疏松,易吸水,因此,铁制品表面的锈如不及时除
去,会加快铁制品的生锈速度。
铁
更不易
金属的锈蚀还与金属内部的结构有关.
问4.不锈钢和生铁的主要成分是 ,不锈钢比生铁 生锈,为什么?
小林同学发现铜制眼镜框表面出现了绿色物
质,通过化学学习知道该物质为铜锈,俗称铜
绿,主要成分是Cu2(OH)2CO3。
[提出问题] 铜是在什么条件下锈蚀的?小林对此进行
了探究。
[猜想] 根据铜锈的化学式,猜想铜生锈可能是铜与水 . , 共同作用的结果。
O2
CO2
[设计与实验] 借鉴“铁钉锈蚀条件的探究”实验,小林设计了“铜片锈蚀条件的探究”实验如右图所示:
(1)实验较长时间后,发现 试管中的光亮铜片最先生锈(填字母编号)。
(2)从优化实验的角度考虑,A实验是多余的,他只考虑了水这个单一条件。C试管中除光亮铜片、蒸馏水外,还有的另外一种物质为 。
(3)D试管除光亮铜片外,还有的另外两种物质为 ;从D试管的实验中,获得的结论是 。
B
O2或CO2
CO2和O2
水是生成铜锈的必要条件
[评价与改进] 我认为小林设计的“铜片锈蚀条件的探究”实验不够完善,要得出正确结论,还要补充的一个实验是(可图示) 。
[反思与小结] 通过铜片锈蚀条件的探究实验,我获得的启示是:
铜生锈比铁困难;要控制好变量;应设置对比实验……
CO2或O2
1.生铁和稀盐酸溶液充分反应后,总
会有残渣产生,残渣的成分是( )
A.铁? B.氯化铁 C.氯化亚铁 D.碳和一些杂质
2.下列物质中属于合金的是( )
A.三氧化二铁???????B.高炉炼出的生铁??? C.不锈钢
D.铁矿石 E.铁粉和铜粉混合 F.白铁
4.下列各项比较中,正确的是( )
A.含碳量:生铁>钢 B.含铁量:Fe2O3 > FeO
C.地壳中元素含量:Al > Fe D.韧性:生铁>钢
A.C
D
B.C
5.某课外活动小组去一家废旧金属回收公司辨别废生铁和废钢,他们运用所学的生铁和钢的性能.用途等有关知识进行辨别,收获很大。试问:该课外活动小组可能是用哪些方法辨别废生铁和废钢的?
(1)看部件的用途; (2)敲击听声音
(3)可用铁锤敲击看其韧性、脆性等
6.现有一种铁合金样品8.7克,与足量的稀硫酸反应,产生了0.3克氢气,根据上述实验数据和获取的资料,通过计算推断,这种碳素钢是生铁还是钢?
7.有铁样品10克,在氧气中充分燃烧后生成二氧化碳通入足量的澄清石灰水中,生成沉淀0.5克,通过计算确定该样品是生铁还是钢?
8.在氧气的制取和性质的实验中,某同学取一段纱窗上的细铁丝,在自己收集的氧气中做铁丝在氧气中燃烧的实验,结果没有观察到火星四射的现象,造成实验失败的原因不可能的是( )
A.收集的氧气太少或纯度不够 B.铁丝已生锈
C.集气瓶底部没有放少量的细砂 D.铁丝温度没有达到着火点
C
9.下列关于铁的性质的说法正确的是( )
A.铁在温暖干燥的环境中易生锈B.铁能置换出硫酸中的氢气
C.铁能与氯气反应生成氯化铁 D.铁能置换出硫酸镁中的镁
C
10.关于铁的下列说法正确的是( )
A.铁能和高温水蒸气.硝酸锌溶液.盐酸发生置换反应
B.在铁制品表面涂油漆或电镀上一层其他金属,这两种防锈措施的原理是相同的
C.炼铁的过程是铁矿石(主要成分是Fe3O4/Fe2O3)被氧化过程 D.铁是地壳中含量最多的金属
B
11.下列关于物质组成的说法中正确的是( )
A.钢含碳的质量分数大于生铁含碳的质量分数
B.二氧化碳是由碳和氧气组成的混合物
C.酒精只含C、H两种元素
D.煤是由多种有机物和一些无机物组成的混合物
12.铁是人类生活、生产实际中应用很广的一种金属材料。有关铁的叙述正确的是( )
A.使用铁锅比使用铝锅更有利于人的健康
B.铁是一种晶体,熔化时温度逐渐升高
C.铁能置换出酸中的氢气
D.铁是电的良导体,因为铁是由铁原子直接构成的
D
A
13.某学生做了如下实验:将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球悬浮于液面;将几枚小铁钉投入烧杯中,到不再 有气泡逸出(溶液的体积变化忽略不计),和开始相比,小球的位 置将( )
A.上浮 B.不变 C.下沉 D.沉至杯底
A
14.铜币在历史上曾经是一种广泛流通的货币,已知铜的熔点是1083.4℃,铁的熔点是15348℃。
(1)请从物理性质角度说明为什么用铜而不用铁来铸造货币。
铜的熔点比铁的熔点低,便于铸造。
(2)请用典型的例子说明铁金属活动性比铜强,并指出所依据的化学反应属于哪种基本反应类型。
铁可以从可溶性的铜盐中置换出铜来;铁可以与盐酸发生置换反应,而铜却不能与盐酸发生置换反应.
15.氯化铁是一种良好的净水剂,化学上可以用多种方法来制取,请写出四种用铁及铁的化合物通过一步化学反应制取氯化铁的四个化学方程式: (注:碳酸铁不要作反应物)
2Fe+3Cl2△2FeCl3
Fe2O3+6HCl=2FeCl3+3H2O
Fe(OH)3+3HCl=FeCl3+3H2O
Fe2(SO4)3+BaCl2=BaSO4↓ +2FeCl3
混合物
4Al+3O2==2Al2O3
2Al+3H2SO4===Al2(SO4)3+3H2
16.广东佛山是有色金属之乡,其中铝合金材料的产量约占全国的一半;铝合金材料属于_______(选填“纯净物”“混合物”或“单质”),铝是活泼金属,生活中的铝锅却有较强的抗腐蚀性,原因是__________________(用化学方程式表示)如果将铝片投入到稀硫酸中,片刻之后才有气泡产生,请用化学方程式表示这一过程:
Al2O3+3H2SO4===Al2(SO4)3+3H2O
17.巳知+3价铁盐跟铁粉在溶液中能发生化合反应,生成亚铁盐,现往生锈的铁粉中加入稀盐酸,过一会儿有气泡产生,反应后铁粉剩余,最终得到一种浅绿色的溶液;写出整个实验过程中所发生的化学方程式。
Fe2O3+6HCl=2FeCl3+3H2O
Fe+2HCl=FeCl2+H2↑
2FeCl3+Fe=3FeCl2
金属污染的来源:
1.日常生活废弃的金属垃圾;
2.大量工业废弃的金属垃圾;
3.工厂排出含重金属的污水.
金属污染危害
1.浪费大量资源
2.铝等金属在自然界不会自行分解,积累在土壤中,破坏土壤结构.
3.含铅.镉等有毒金属被腐蚀后,导致土壤和地下水源重金属污染及危害生态环境.
4.大量使用含铅汽油和废弃的电池都可引起土壤重金属污染.
目前我国的垃圾处理方法主要以填埋为主
水俣病和汞污染
整整五十年前即1950年,在日本西部九州岛的东俣小镇,发生了一系列使人们莫明其妙而又十分震惊的事情:海面有死鱼漂浮,空中有鸟儿毙命,海里有贝类腐烂、海藻枯死,陆地上有猫儿发疯,跳海自杀,更可怕的是发现有人莫明其妙的突然口齿不清、呆痴流涎、耳聋失明、精神失常,最后痛苦的死去,这就是当时震惊日本朝野的水俣病。 经过近10年的研究,到1959年,人们才弄明白这是甲基汞中毒,是由于人们和猫食用了含甲基汞的鱼和贝类引起的。可是甲基汞是哪里来的?为什么鱼和贝类中含有甲基汞呢?经过大量研究,最后才弄明白是由于附近一家氮肥厂,用含汞的化合物作为催化剂,而将含有汞的废水排入大海,从而在鱼和贝类中富集,这种生物富集是逐渐浓缩的过程,最后甲基汞含量可以达到百万分之五--百万分之二十,而安全的最高含量不过为百万分之零点五。水俣病病因的查明,使人们进一步揭示了有毒物质在生态系统循环的规律。
密度在5以上的金属统称为重金属,如金.银.铜.铅.锌.镍.钴.镉.铬和汞等45种。从环境污染方面所说的重金属,实际上主要是指汞.镉.铅.铬以及类金属砷等生物毒性显著的重金属,也指具有一定毒性的一般重金属如锌.铜.钴.镍.锡等。目前最引起人们注意的是汞.镉.铬.铅等。重金属随废水排出时,即使浓度很小,也可能造成危害。由重金属造成的环境污染称为重金属污染。重金属污染的特点表现在以下几方面: (1)水体中的某些重金属可在微生物作用下转化为毒性更强的金属化合物,如汞的甲基化作用就是其中典型例子;
(2)生物从环境中摄取重金属可以经过食物链的生物富集作用,在较高级生物体内成千万倍地富集起来,然后通过食物进入人体,在人体的某些器官中积蓄起来造成慢性中毒,危害人体健康;
(3)在天然水体中只要有微量重金属即可产生毒性效应,一般重金属产生毒性的范围大约在1—10mg/L之间,毒性较强的金属如汞.镉等产生毒性的质量浓度范围在0.0l—0.001mg/L之间。
重金属污染
防治金属污染方法
1.垃圾进行分类回收
2.分类回收各种废弃金属材料循环再利用
3.使用无铅汽油。
4.废旧电池不能任意丢弃。
5.工业废水和废渣不能任意排放和堆放。
废干电池的处理
方案例举:1.对锌的回收:
剥下干电池外面的锌皮,并用小刀或纱纸去掉表面的杂质,洗净干燥。(可用作实验室制氢气的原料)
2.对汞的回收:(Hg2+) 向初步处理后的废液中,加入铜屑、铁屑或锌粒,置换出汞。
3.对镉.镍的回收:(Cd2+、Ni2+)
提示:Cd(OH)2Ni(OH)2难溶于水。向含Cd2+的废液中,加入可溶性碱,生成沉淀,过滤,洗涤,干燥。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
