中考专题复习 金属的化学性质[下学期]
文档属性
| 名称 | 中考专题复习 金属的化学性质[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 308.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-22 12:37:00 | ||
图片预览










文档简介
课件35张PPT。金属的化学性质中考导航1、 知道常见的金属与氧气的反应。
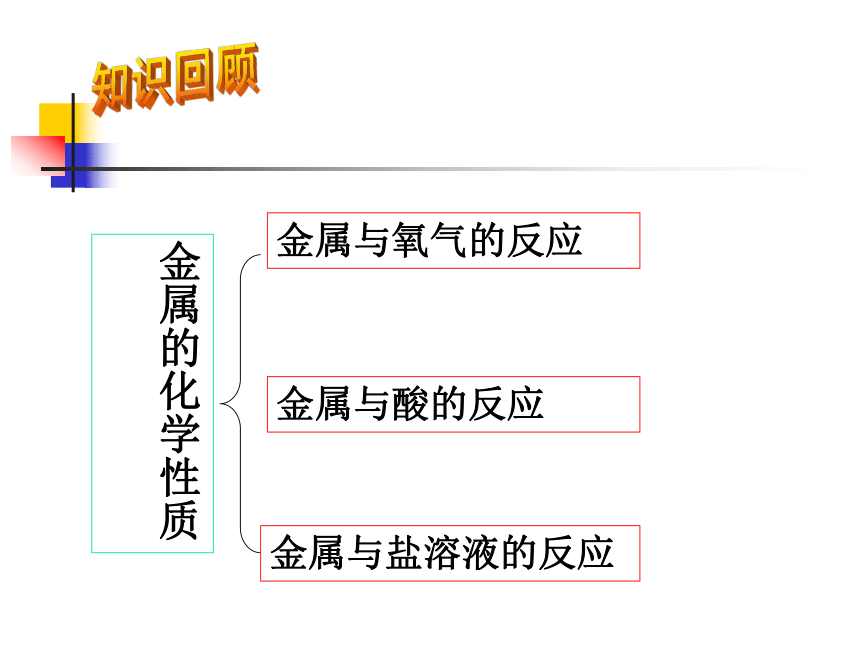
2、 能用金属活动性顺序对有关的置换反应进行简单的判断,并能解释日常生活中的一些现象。知识回顾金属与氧气的反应金属的化学性质金属与酸的反应金属与盐溶液的反应典型例题:1、写出下列金属与氧气反应的化学方程式
(1)铁在氧气中燃烧
(2)镁在空气中燃烧
(3)铜在空气只加热
(4)铝在空气中形成致密的氧化膜相信你能发现:
大多数金属都能与氧气发生化合反应,但反应的难易程度和剧烈程度 。比较活泼次之最不活泼不相同金属活动性由强逐渐减弱相信你能归纳:1、在金属活动性顺序里,金属的位置与它的活动性关系?
2、在金属活动性顺序里,哪些金属能置换出盐酸、稀硫酸中的氢?
3、在金属活动性顺序里,金属排在什么位置才能把金属从它们化合物的溶液里置换出来?
常见金属在溶液中的活动性顺序:相信你能归纳:
常见金属在溶液中的活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。金属活动性由强逐渐减弱学以致用判断金属和酸能否反应判断金属和盐能否反应判断金属和混合盐溶液反应的顺序一 判断金属跟酸能否发生置换反应及其反应的快慢。1 反应条件:(1) 排在氢前面的金属才能置换酸
中的氢(2) 酸指盐酸和稀硫酸,不能用浓硫酸,硝酸。Fe和稀H2SO4练习1:
下列金属跟酸能反应而放出氢气的是ABCDAg和稀HClZn和稀HNO3Al和浓H2SO4( )AFeSO4练习2:
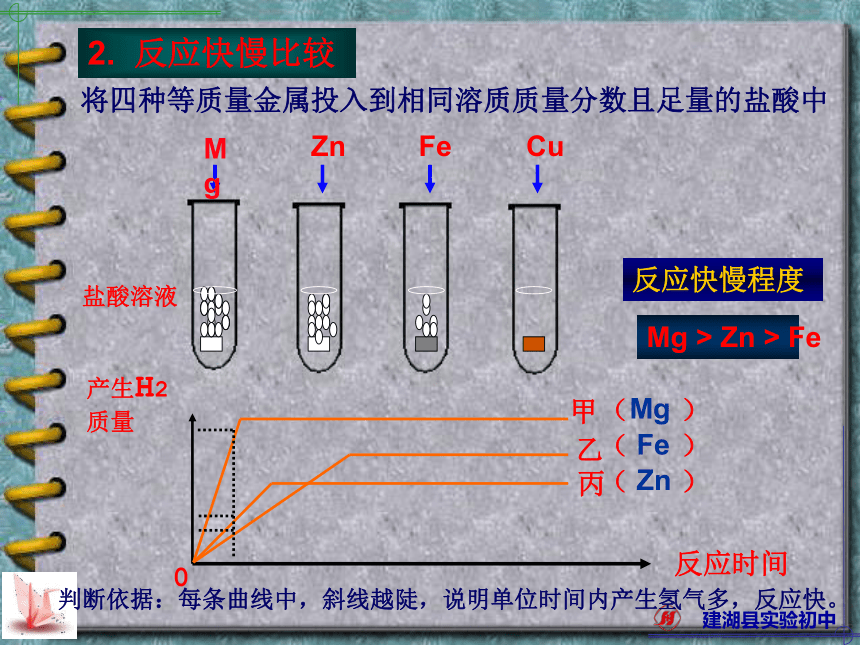
不能由金属跟稀硫酸直接反应制得的物质是ABCD( )CMgSO4CuSO4Al2(SO4)3反应快慢程度Mg > Zn > Fe判断依据:每条曲线中,斜线越陡,说明单位时间内产生氢气多,反应快。MgZnFe2. 反应快慢比较练习3:等质量的A,B,C三种金属分别与质量相同,
质量分数也相同的稀硫酸充分反应放出氢气的情况
如下图所示:AC)反应时间1 活动性最强的金属是2 活动性最弱的金属是3 反应结束时,一定没有剩余的物质是((())硫酸1.A2.B3.C4.硫酸产生H2
质量判断动脑筋想一想完成下面的化学反应二 判断金属跟盐溶液能否发生置换反应。 1.单质金属要排在盐中金属元素前面2.反应物之一盐必须是可溶性,即是
溶液。3.K Ca Na除外。CB相关中考试题有 X、Y、Z三种金属,将X和Y浸入稀硫酸中,Y溶解,X不溶解;将X浸入Z的硝酸盐溶液中,在X表面有Z析出,则X、Y、Z的金属活动性由强到弱的顺序是 ( )A.Z、Y、X B.Z、X、YC.Y、Z、XD.Y、X、ZD 请你设计一个实验方案,以验证锌、铁、铜三种金属的活动性顺序,并写出实验报告。
想一想做一做思路一:利用金属和酸的反应思路二:利用金属和盐的反应实验报告实验目的:_______________________________________
实验用品:_______________________________________三 判断金属跟混合盐溶液反应的次序。反应的先后次序是:在金属活动性顺序表里,排在越后面的金属,越易从它们的盐溶液里被置换出来。
或者说:金属活动性相差越大,置换反应越易发生。练习6:将一定质量的铁粉放入足量相同质量分数的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是A. FeB. CuC. AgCD. 无法确定D 向氧化铜和铁粉的混合物中,加入一定量的稀硫酸,反应停止后,过滤,除去不溶物。向滤液中加一铁片,未看到铁片有任何变化。下列分析正确的是( )
A. 滤出的不溶物中一定含有Cu和FeB. 滤出的不溶物中一定含有CuC. 滤液中一定不含有CuSO4D. 滤液中一定不含有FeSO4和H2SO4金属活动性顺序表反应条件反应次序1、5角硬币的外观呈金黄色,它是铜和锌的合金,市面上有人用它制成假金元宝行骗,小明同学用一种试剂揭穿了他。小明一定不会用的试剂是
A.硫酸铜溶液 B.硝酸银溶液
C.盐酸 D.硝酸钠溶液效果检测2、据古籍记载江西上饶有一苦泉(苦泉水呈蓝色)铁锅使用苦泉水会变成铜锅,试分析蕴含化学原理。3、工人师傅在钢板上划线,钢板上会出现一条红色的线。使用的是下列哪种物质溶液? ( ) A.ZnSO4 B.AgNO3 C.FeSO4 D.CuSO4Fe+CuSO4=FeSO4+CuD4、某锌样品6.5g与足量稀硫酸完全反应后产生氢气0.195g。则其所含杂质可能是( )
A、Fe B、Mg C、Al D、Cu5、判断下列各组物质能否发生置换反应,如果能反应的写出其反应方程式;不能的说明理由.
(1)铜和稀硫酸
(2)铁和稀盐酸
(3)铜和硝酸汞溶液
(4)铁和硫酸锌溶液
(5)铝和氯化银6、在AgNO3和Cu(NO3)2的混合液中,加入一定量的铁粉,充分反应后发现有少量金属析出,过滤后向滤液中滴加少量盐酸有白色沉淀产生,则( )
A.金属是Ag,滤液中只有Cu 2+ 、Fe2+
B.金属是Ag和Fe,滤液中只有Ag +、 Cu 2+
C.金属是Ag,滤液中只有Ag +、 Cu 2+ 、 Fe2+
D.金属是Cu和Ag,滤液中只有Ag +、 Fe2+ 用于判断置换反应后金属的组成和溶液中溶质的存在 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列有关说法中,正确的是( )
A.滤出的固体中一定含有银和铜,一定不含铁
B.滤出的固体中一定含有银,可能含有铜和铁
C.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜
D.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜7、从含有大量硫酸亚铁、少量硫酸铜以及不
溶性杂质的工业废水中回收金属铜并获得硫酸
亚铁晶体,操作步骤和目的如下表,请填出表
中未完成部分。 将质量相等的A、B两种金属,同时分别放入两份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,写出能从中得出的正确结论.(已知:A、B在生成物中均为+2价) 锌粉、铝粉、铁粉、镁粉的混合物3.8g与一定质量溶质质量分数为25%的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体(不含结晶水)11g,则反应中生成氢气的质量为( )
A.0.15g B.0.20g
C.0.30g D.0.45g利用元素质量守恒巧算金属与酸反应生成氢气的质量 运用金属活动性顺序和质量守恒解答比较复杂的综合型计算题 某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:根据该同学的实验,试回答以下问题:
(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是_____g。(2)该铜铁合金中铁的质量分数是多少?
(3)第三次实验所得溶液溶质质量分数为____________(结果保留至0.1%)。 用于判断置换反应后盐溶液的质量变化 把铁片分别放入下列物质的溶液中,过一段时间取出,溶液质量增加的是( )
A、Al2(SO4) B、CuSO4
C、H2SO4 D、AgNO3
2、 能用金属活动性顺序对有关的置换反应进行简单的判断,并能解释日常生活中的一些现象。知识回顾金属与氧气的反应金属的化学性质金属与酸的反应金属与盐溶液的反应典型例题:1、写出下列金属与氧气反应的化学方程式
(1)铁在氧气中燃烧
(2)镁在空气中燃烧
(3)铜在空气只加热
(4)铝在空气中形成致密的氧化膜相信你能发现:
大多数金属都能与氧气发生化合反应,但反应的难易程度和剧烈程度 。比较活泼次之最不活泼不相同金属活动性由强逐渐减弱相信你能归纳:1、在金属活动性顺序里,金属的位置与它的活动性关系?
2、在金属活动性顺序里,哪些金属能置换出盐酸、稀硫酸中的氢?
3、在金属活动性顺序里,金属排在什么位置才能把金属从它们化合物的溶液里置换出来?
常见金属在溶液中的活动性顺序:相信你能归纳:
常见金属在溶液中的活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 3、在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。金属活动性由强逐渐减弱学以致用判断金属和酸能否反应判断金属和盐能否反应判断金属和混合盐溶液反应的顺序一 判断金属跟酸能否发生置换反应及其反应的快慢。1 反应条件:(1) 排在氢前面的金属才能置换酸
中的氢(2) 酸指盐酸和稀硫酸,不能用浓硫酸,硝酸。Fe和稀H2SO4练习1:
下列金属跟酸能反应而放出氢气的是ABCDAg和稀HClZn和稀HNO3Al和浓H2SO4( )AFeSO4练习2:
不能由金属跟稀硫酸直接反应制得的物质是ABCD( )CMgSO4CuSO4Al2(SO4)3反应快慢程度Mg > Zn > Fe判断依据:每条曲线中,斜线越陡,说明单位时间内产生氢气多,反应快。MgZnFe2. 反应快慢比较练习3:等质量的A,B,C三种金属分别与质量相同,
质量分数也相同的稀硫酸充分反应放出氢气的情况
如下图所示:AC)反应时间1 活动性最强的金属是2 活动性最弱的金属是3 反应结束时,一定没有剩余的物质是((())硫酸1.A2.B3.C4.硫酸产生H2
质量判断动脑筋想一想完成下面的化学反应二 判断金属跟盐溶液能否发生置换反应。 1.单质金属要排在盐中金属元素前面2.反应物之一盐必须是可溶性,即是
溶液。3.K Ca Na除外。CB相关中考试题有 X、Y、Z三种金属,将X和Y浸入稀硫酸中,Y溶解,X不溶解;将X浸入Z的硝酸盐溶液中,在X表面有Z析出,则X、Y、Z的金属活动性由强到弱的顺序是 ( )A.Z、Y、X B.Z、X、YC.Y、Z、XD.Y、X、ZD 请你设计一个实验方案,以验证锌、铁、铜三种金属的活动性顺序,并写出实验报告。
想一想做一做思路一:利用金属和酸的反应思路二:利用金属和盐的反应实验报告实验目的:_______________________________________
实验用品:_______________________________________三 判断金属跟混合盐溶液反应的次序。反应的先后次序是:在金属活动性顺序表里,排在越后面的金属,越易从它们的盐溶液里被置换出来。
或者说:金属活动性相差越大,置换反应越易发生。练习6:将一定质量的铁粉放入足量相同质量分数的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是A. FeB. CuC. AgCD. 无法确定D 向氧化铜和铁粉的混合物中,加入一定量的稀硫酸,反应停止后,过滤,除去不溶物。向滤液中加一铁片,未看到铁片有任何变化。下列分析正确的是( )
A. 滤出的不溶物中一定含有Cu和FeB. 滤出的不溶物中一定含有CuC. 滤液中一定不含有CuSO4D. 滤液中一定不含有FeSO4和H2SO4金属活动性顺序表反应条件反应次序1、5角硬币的外观呈金黄色,它是铜和锌的合金,市面上有人用它制成假金元宝行骗,小明同学用一种试剂揭穿了他。小明一定不会用的试剂是
A.硫酸铜溶液 B.硝酸银溶液
C.盐酸 D.硝酸钠溶液效果检测2、据古籍记载江西上饶有一苦泉(苦泉水呈蓝色)铁锅使用苦泉水会变成铜锅,试分析蕴含化学原理。3、工人师傅在钢板上划线,钢板上会出现一条红色的线。使用的是下列哪种物质溶液? ( ) A.ZnSO4 B.AgNO3 C.FeSO4 D.CuSO4Fe+CuSO4=FeSO4+CuD4、某锌样品6.5g与足量稀硫酸完全反应后产生氢气0.195g。则其所含杂质可能是( )
A、Fe B、Mg C、Al D、Cu5、判断下列各组物质能否发生置换反应,如果能反应的写出其反应方程式;不能的说明理由.
(1)铜和稀硫酸
(2)铁和稀盐酸
(3)铜和硝酸汞溶液
(4)铁和硫酸锌溶液
(5)铝和氯化银6、在AgNO3和Cu(NO3)2的混合液中,加入一定量的铁粉,充分反应后发现有少量金属析出,过滤后向滤液中滴加少量盐酸有白色沉淀产生,则( )
A.金属是Ag,滤液中只有Cu 2+ 、Fe2+
B.金属是Ag和Fe,滤液中只有Ag +、 Cu 2+
C.金属是Ag,滤液中只有Ag +、 Cu 2+ 、 Fe2+
D.金属是Cu和Ag,滤液中只有Ag +、 Fe2+ 用于判断置换反应后金属的组成和溶液中溶质的存在 某金属加工厂生产过程中的废液含有少量硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列有关说法中,正确的是( )
A.滤出的固体中一定含有银和铜,一定不含铁
B.滤出的固体中一定含有银,可能含有铜和铁
C.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜
D.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜7、从含有大量硫酸亚铁、少量硫酸铜以及不
溶性杂质的工业废水中回收金属铜并获得硫酸
亚铁晶体,操作步骤和目的如下表,请填出表
中未完成部分。 将质量相等的A、B两种金属,同时分别放入两份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,写出能从中得出的正确结论.(已知:A、B在生成物中均为+2价) 锌粉、铝粉、铁粉、镁粉的混合物3.8g与一定质量溶质质量分数为25%的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体(不含结晶水)11g,则反应中生成氢气的质量为( )
A.0.15g B.0.20g
C.0.30g D.0.45g利用元素质量守恒巧算金属与酸反应生成氢气的质量 运用金属活动性顺序和质量守恒解答比较复杂的综合型计算题 某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下表:根据该同学的实验,试回答以下问题:
(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是_____g。(2)该铜铁合金中铁的质量分数是多少?
(3)第三次实验所得溶液溶质质量分数为____________(结果保留至0.1%)。 用于判断置换反应后盐溶液的质量变化 把铁片分别放入下列物质的溶液中,过一段时间取出,溶液质量增加的是( )
A、Al2(SO4) B、CuSO4
C、H2SO4 D、AgNO3
同课章节目录
