2.3 化学变化中的质量守恒(50张PPT)
文档属性
| 名称 | 2.3 化学变化中的质量守恒(50张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 747.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2018-12-06 00:00:00 | ||
图片预览











文档简介
课件50张PPT。化合物化学式的书写CaCl2NaCl氯化钙氯化钠2个氯原子1个氯原子Why?化合价世界上的物质很多,组成也很复杂,科学家研究了物质组成元素原子数量之间的关系,总结出化合价以帮助我们书写化学式。化合价标法:写在元素符号的正上方如:MgO H2O CO2 Al2O3 +2 +1 +4 +3化合价法则:化合物中正负化合价代数和为零
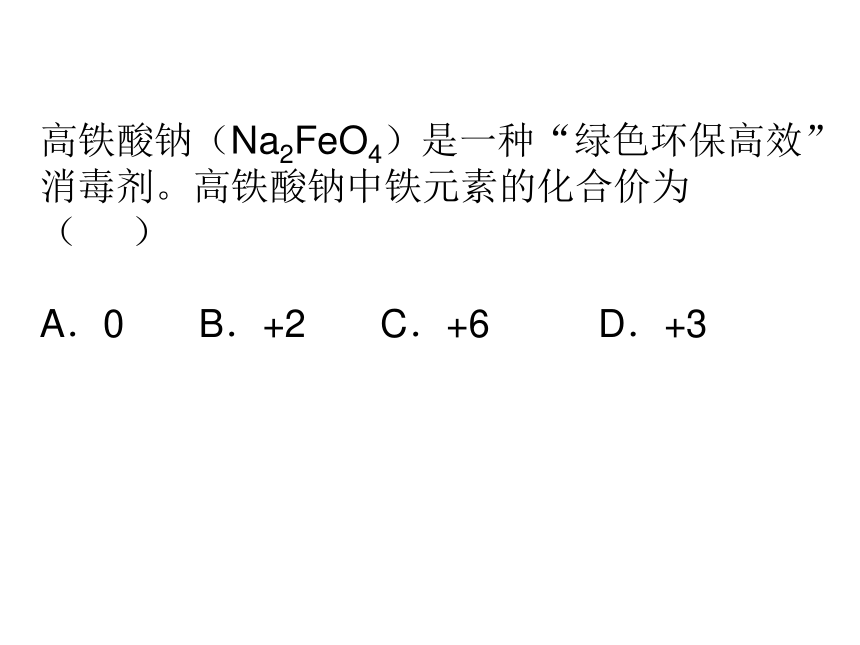
单质中元素的化合价为零如:O2 Fe CO 0 0 +2 -2 常见元素的化合价:(口诀)O S -2价 Cl -1价K Na Ag H +1价Ca Mg Cu Ba Zn +2价Al +3价 亚铁+2、铁+3 3.金属没有负价1.化合物中,氧一般都是-2价,氢一般都是+1价2.与金属元素形成的氯化物中,氯是-1价标出下列化合物中各元素(除氧外)的化合价 N2O5 Fe2O3 CO2+5+3+4高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂。高铁酸钠中铁元素的化合价为 ( )
A.0 B.+2 C.+6 D.+3常见五种原子团及其化合价CO3 SO4 NO3 OH NH4-2-2-1-1+1碳酸根 硫酸根 硝酸根 氢氧根 铵根某些元素的原子集合在一起作为一个整体参加化学反应,它所起的作用和一个原子一样,这样的原子集团称为原子团。原子团根据元素的化合价书写化合物的化学式写化学式的步骤(以水为例):1.写出组成水的元素 H O(正价元素写左边,负价元素写右边)2.标出各元素的化合价 H O(化合价写在元素符号的正上方)3.标出各元素的个数 H2O(化合物中正价总数和负价总数的代数和等于零,原子个数用阿拉伯数字写在元素符号的右下角)+1-2写出氯化铜的化学式已知氯化铜中Cu的化合价为+2 ,Cl的化合价为-1Cu Cl+2-12试写出下列物质的化学式氯化钙氧化镁氢氧化钠氢氧化钙碳酸钙硝酸银国际单位制中7个基本物理量:长度 单位: m
质量 单位:kg
时间 单位: s
电流 单位: A
热力学温度 单位: K
发光强度 单位:cd
物质的量 单位:mol物质的量:专用名词,是一个 整体,不能简化或添加。物质的量——表示微粒集合体的物理量。符号:n 单位:摩尔(mol)1双1打1mol个数212约6.02X1023国际上是如何规定NA的?12克C-12(相对原子质量12)所含碳原子数目即为NA(1mol)1mol物质的微粒个数为NA,并把它称为“阿佛加德罗常数”,近似6.02×1023 ① NA个微观粒子所形成的微粒集体的质量在几克 到
几百克之间,质量大小适宜,可以称量,便于换算。
② 有利于借助相对原子质量,确定不同种类粒子集体
的质量。 这样规定有什么好处? 6.02×1023个面值为人民币1元的硬币,如果全世界的人来数,每人每秒数一枚,那么要数约 。
320万年摩尔适用于微观粒子,
不能用于宏观物体。1)1mol 氧2)1mol 氧气指明微粒的名称或化学式3)0.1mol 水4)1mol 大米下列描述是否正确(√)(√)(×)(×)物质的量与物质所含微粒数的关系物质的量=
(mol) 3.01×1024个硫酸分子的物质的量为 mol;5在0.5molO2中含有的O2的分子数目N = n × NA = 0.5 mol × 6.02 ×1023 mol -1 = 3.01 × 1023例题1摩尔质量1mol物质(即单位物质的量的物质)
的质量叫做摩尔质量,符号:M , 单位:克/摩,符号 g/mol12克C-12(相对原子质量12)所含碳原子数目即为1molC-12(相对原子质量12)的摩尔质量为12g/mol式量与摩尔质量 的相互联系和区别 ① 摩尔质量在数值上 = 物质的式量
② 摩尔质量单位:g/mol ;式量没有单位练习:
1、O2的式量=_______,摩尔质量
=________。
2、N2的式量=__________,摩尔质量
= 。
3232g/mol2828g/molO-16 N-14摩尔质量、质量、物质的量三者关系式如何表示呢?n =物质的质量(g)摩尔质量(g/mol) 物质的量(mol)=关系式:Mm24.5gH2SO4 物质的量是多少?n( H2SO4 )==0.25mol例题1已知:H2SO4的相对分子质量为98例题1.5molH2SO4 的质量是多少?m(H2SO4)=n(H2SO4)×M(H2SO4)答:1.5molH2SO4 的质量是157.0g。=1.5mol ×98g/mol=157.0g已知:H2SO4的相对分子质量为98质量 物质的量 微粒数÷M×M×NA÷NA物质的量是联系肉眼看不见的微粒和宏观可称量的物质的桥梁。(N)(n)(m)1、3.5molNaOH的质量是多少?试一试2、求19.6g硫酸H2SO4的物质的量?140 g0.2 molNa-23 O-16 H-1 S-32化学变化前后元素种类有变化吗?化学变化前后原子的个数有变化吗?你觉得化学变化前后物质的质量会发生变化吗?没有变化没有变化硫酸铜溶液与氢氧化钠溶液反应反应前后质量没有发生改变 质量守恒定律参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。 质量守恒的本质化学反应前后,原子的种类不变,原子的数目不变,原子的质量不变(微观解释)。因此,化学反应前后的质量也不会改变(表现在宏观方面)。一定改变:分子的种类
一定不变:
(微观)原子种类、原子个数、原子的质量
(宏观)总质量、元素种类分子的数目改变吗?S+O2 SO2点燃H2+Cl2 2HCl点燃分子数目可能改变,可能不变注意1.质量守恒定律只适用于化学变化,不能用于物理变化2.化学反应前后所有参加反应的反应物的总质量等于所有生成物的总质量,包括固体、液体、气体3.所有化学反应都符合质量守恒定律A镁带燃烧前后的质量变化固体质量增加了Why?碳酸钙粉末与盐酸反应反应后质量减少了,为什么呢?答:CO2是气体飞走了下列变化中,属于化学变化,并且能用质量守恒定律解释的是( )
A.5g水受热变成5g水蒸气
B.5g食盐溶解在95g水中,成为 100g食盐溶液
C.100mL水加入100mL酒精,成为体积小于200mL的溶液
D.木炭燃烧后质量减少Da g镁在氧气中完全燃烧后,得到 b g白色固体,此时参加反应的氧气为( )
A.(a+b)g B.(a-b)g C.(b-a)g D.无法判断C化学方程式用化学式表示化学反应的式子书写化学方程式的注意点遵循客观事实,正确书写化学式和反应条件(点燃、通电、高温等,加热用“ ”表示)
配平反应前后各元素的原子个数
当生成气体时,用“ ”表示,当生成沉淀时,用“ ”表示
KClO3 KCl+ O2MnO2223配平化学变化过程中,必然遵循质量守恒定律,即反应前后元素种类与原子个数相等。 常见的配平方法:最小公倍数法、奇偶法、观察法等最小公倍数法Al+ O2 Al2O3432N2+ H2 NH332奇偶法H2O2 H2O+ O2↑22物质的量之比等于系数(化学计量数)之比 2 1 2每2mol一氧化碳气体跟1mol氧气在点燃的条件下发生反应,生成2mol二氧化碳气体2mol2mol1mol例题:( )工业上可用电解水得到氧气 。 试问,1mol水能得到多少mol氧气?
解:设1mol水能得到xmol氧气2 11mol x mol21=1xx =0.5答:1mol水能得到0.5mol氧气。例题:实验室常用氯酸钾制氧气,24.5克KClO3在MnO2的催化条件下完全分解,求产生氧气的物质的量为多少mol?解:设产生氧气的物质的量为x mol2 30.2mol xmol答:产生氧气的物质的量为0.3 mol。
单质中元素的化合价为零如:O2 Fe CO 0 0 +2 -2 常见元素的化合价:(口诀)O S -2价 Cl -1价K Na Ag H +1价Ca Mg Cu Ba Zn +2价Al +3价 亚铁+2、铁+3 3.金属没有负价1.化合物中,氧一般都是-2价,氢一般都是+1价2.与金属元素形成的氯化物中,氯是-1价标出下列化合物中各元素(除氧外)的化合价 N2O5 Fe2O3 CO2+5+3+4高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂。高铁酸钠中铁元素的化合价为 ( )
A.0 B.+2 C.+6 D.+3常见五种原子团及其化合价CO3 SO4 NO3 OH NH4-2-2-1-1+1碳酸根 硫酸根 硝酸根 氢氧根 铵根某些元素的原子集合在一起作为一个整体参加化学反应,它所起的作用和一个原子一样,这样的原子集团称为原子团。原子团根据元素的化合价书写化合物的化学式写化学式的步骤(以水为例):1.写出组成水的元素 H O(正价元素写左边,负价元素写右边)2.标出各元素的化合价 H O(化合价写在元素符号的正上方)3.标出各元素的个数 H2O(化合物中正价总数和负价总数的代数和等于零,原子个数用阿拉伯数字写在元素符号的右下角)+1-2写出氯化铜的化学式已知氯化铜中Cu的化合价为+2 ,Cl的化合价为-1Cu Cl+2-12试写出下列物质的化学式氯化钙氧化镁氢氧化钠氢氧化钙碳酸钙硝酸银国际单位制中7个基本物理量:长度 单位: m
质量 单位:kg
时间 单位: s
电流 单位: A
热力学温度 单位: K
发光强度 单位:cd
物质的量 单位:mol物质的量:专用名词,是一个 整体,不能简化或添加。物质的量——表示微粒集合体的物理量。符号:n 单位:摩尔(mol)1双1打1mol个数212约6.02X1023国际上是如何规定NA的?12克C-12(相对原子质量12)所含碳原子数目即为NA(1mol)1mol物质的微粒个数为NA,并把它称为“阿佛加德罗常数”,近似6.02×1023 ① NA个微观粒子所形成的微粒集体的质量在几克 到
几百克之间,质量大小适宜,可以称量,便于换算。
② 有利于借助相对原子质量,确定不同种类粒子集体
的质量。 这样规定有什么好处? 6.02×1023个面值为人民币1元的硬币,如果全世界的人来数,每人每秒数一枚,那么要数约 。
320万年摩尔适用于微观粒子,
不能用于宏观物体。1)1mol 氧2)1mol 氧气指明微粒的名称或化学式3)0.1mol 水4)1mol 大米下列描述是否正确(√)(√)(×)(×)物质的量与物质所含微粒数的关系物质的量=
(mol) 3.01×1024个硫酸分子的物质的量为 mol;5在0.5molO2中含有的O2的分子数目N = n × NA = 0.5 mol × 6.02 ×1023 mol -1 = 3.01 × 1023例题1摩尔质量1mol物质(即单位物质的量的物质)
的质量叫做摩尔质量,符号:M , 单位:克/摩,符号 g/mol12克C-12(相对原子质量12)所含碳原子数目即为1molC-12(相对原子质量12)的摩尔质量为12g/mol式量与摩尔质量 的相互联系和区别 ① 摩尔质量在数值上 = 物质的式量
② 摩尔质量单位:g/mol ;式量没有单位练习:
1、O2的式量=_______,摩尔质量
=________。
2、N2的式量=__________,摩尔质量
= 。
3232g/mol2828g/molO-16 N-14摩尔质量、质量、物质的量三者关系式如何表示呢?n =物质的质量(g)摩尔质量(g/mol) 物质的量(mol)=关系式:Mm24.5gH2SO4 物质的量是多少?n( H2SO4 )==0.25mol例题1已知:H2SO4的相对分子质量为98例题1.5molH2SO4 的质量是多少?m(H2SO4)=n(H2SO4)×M(H2SO4)答:1.5molH2SO4 的质量是157.0g。=1.5mol ×98g/mol=157.0g已知:H2SO4的相对分子质量为98质量 物质的量 微粒数÷M×M×NA÷NA物质的量是联系肉眼看不见的微粒和宏观可称量的物质的桥梁。(N)(n)(m)1、3.5molNaOH的质量是多少?试一试2、求19.6g硫酸H2SO4的物质的量?140 g0.2 molNa-23 O-16 H-1 S-32化学变化前后元素种类有变化吗?化学变化前后原子的个数有变化吗?你觉得化学变化前后物质的质量会发生变化吗?没有变化没有变化硫酸铜溶液与氢氧化钠溶液反应反应前后质量没有发生改变 质量守恒定律参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。 质量守恒的本质化学反应前后,原子的种类不变,原子的数目不变,原子的质量不变(微观解释)。因此,化学反应前后的质量也不会改变(表现在宏观方面)。一定改变:分子的种类
一定不变:
(微观)原子种类、原子个数、原子的质量
(宏观)总质量、元素种类分子的数目改变吗?S+O2 SO2点燃H2+Cl2 2HCl点燃分子数目可能改变,可能不变注意1.质量守恒定律只适用于化学变化,不能用于物理变化2.化学反应前后所有参加反应的反应物的总质量等于所有生成物的总质量,包括固体、液体、气体3.所有化学反应都符合质量守恒定律A镁带燃烧前后的质量变化固体质量增加了Why?碳酸钙粉末与盐酸反应反应后质量减少了,为什么呢?答:CO2是气体飞走了下列变化中,属于化学变化,并且能用质量守恒定律解释的是( )
A.5g水受热变成5g水蒸气
B.5g食盐溶解在95g水中,成为 100g食盐溶液
C.100mL水加入100mL酒精,成为体积小于200mL的溶液
D.木炭燃烧后质量减少Da g镁在氧气中完全燃烧后,得到 b g白色固体,此时参加反应的氧气为( )
A.(a+b)g B.(a-b)g C.(b-a)g D.无法判断C化学方程式用化学式表示化学反应的式子书写化学方程式的注意点遵循客观事实,正确书写化学式和反应条件(点燃、通电、高温等,加热用“ ”表示)
配平反应前后各元素的原子个数
当生成气体时,用“ ”表示,当生成沉淀时,用“ ”表示
KClO3 KCl+ O2MnO2223配平化学变化过程中,必然遵循质量守恒定律,即反应前后元素种类与原子个数相等。 常见的配平方法:最小公倍数法、奇偶法、观察法等最小公倍数法Al+ O2 Al2O3432N2+ H2 NH332奇偶法H2O2 H2O+ O2↑22物质的量之比等于系数(化学计量数)之比 2 1 2每2mol一氧化碳气体跟1mol氧气在点燃的条件下发生反应,生成2mol二氧化碳气体2mol2mol1mol例题:( )工业上可用电解水得到氧气 。 试问,1mol水能得到多少mol氧气?
解:设1mol水能得到xmol氧气2 11mol x mol21=1xx =0.5答:1mol水能得到0.5mol氧气。例题:实验室常用氯酸钾制氧气,24.5克KClO3在MnO2的催化条件下完全分解,求产生氧气的物质的量为多少mol?解:设产生氧气的物质的量为x mol2 30.2mol xmol答:产生氧气的物质的量为0.3 mol。
