气体摩尔体积第一课时1[下学期]
文档属性
| 名称 | 气体摩尔体积第一课时1[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 29.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-05-19 15:32:00 | ||
图片预览




文档简介
课件11张PPT。第二节 气体摩尔体积
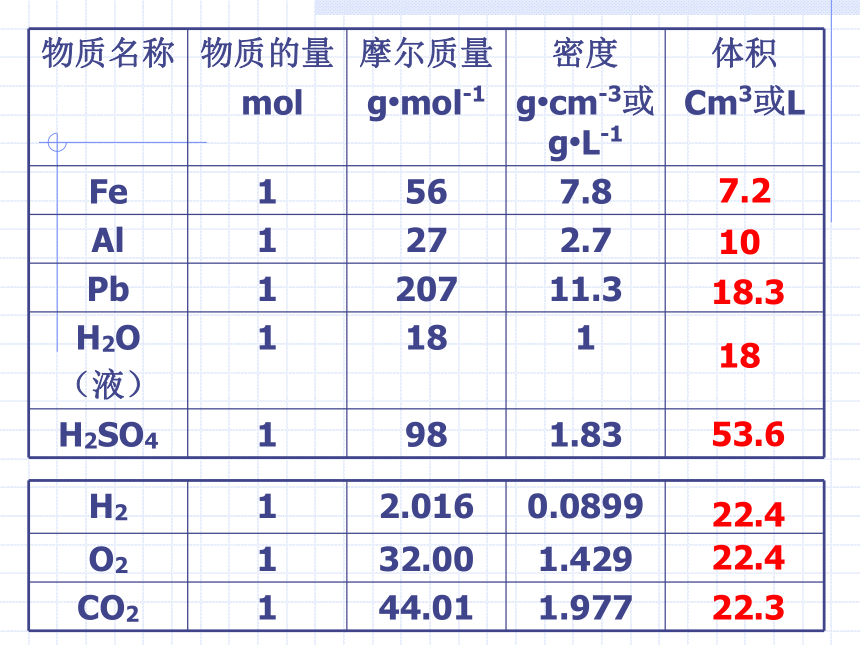
(第一课时)复习:2、1mol任何物质的质量,我们可以通过摩尔质量出,若要通过质量求体积 还要知道什么? 密度,V=m/ρ3、下面就请同学们计算填表:(气体是指相同状况下)7.21018.31853.622.422.422.3分析上述两表,得出什么结论?1、1mol不同的固态或液态物质,体积不同。
2、在相同状态下,1mol气体的体积基本相同。那么不同状态的物质,体积大小跟哪些因素有关呢?
举一个例子:同学们在做操的时候,一个班在操场上所占的面积和哪些因素有关:人数、距离、胖瘦粒子数目粒子大小粒子间距现在我们讨论1mol物质的体积,也就是粒子数是6.02?1023。固、液体 气体6.02?1023 6.02?1023??对于固、液体,粒子间距很小,粒子的大小是决定物质体积大小的主要因素。在固态和液态中粒子本身的大小不同,决定了其体积不同。所以,1mol固体、液体的体积主要决定于原子、分子、离子的大小。对于气体,粒子间距较大,决定物质体积大小的主要因素是粒子间的距离。而不同的气体在一定温度和压强下,分子间的距离可以看作是相等的,所以1mol任何气体的体积基本相同结论:相同条件下,1mol气体的体积主要决定与分子间的距离。一.气体摩尔体积
定义:单位物质的量的气体所占的体积。
符号:Vm
单位:L/mol或m3/mol等
公式:
Vm= ——
对象:任何气体(纯净或混合气体)
标准状况:Vm约22.4L/mol
标准状况: 温度:0oC、压强1.01×105PaVn思考:1mol气体在任何状况下所占的体积是不是相等?是不是都约为22 .4L?几点注意:1、状态:气体
2、状况:一定温度和压强下,一般指标准状况
3、定量:1mol
4、数值:22 .4L
5、通常状况:200C、1atm
6、气体体积与微粒数目有关,与种类无关。
7、结论:在标准状况下,1mol任何气体所占的体积都约为22 .4L。
8、有关计算:(标准状况下)
V=n×22.4L/mol(n---气体的物质的量)1、下列说法是否正确?
(1)、1摩尔氢气的体积约为22.4L
(2)、标准状况下,1摩尔水的体积约22.4升。
(3)、20oC时, 1摩尔氧气的体积约22.4升。
(4)、2×105Pa时,1摩尔氮气的体积小于22.4升。 2、标准状况下:
(1)44.8升氢气的物质的量是多少?
(2)0.5摩尔氧气的体积是多少?
(3)14克CO的体积是多少?
(4)33.6升氮气中含多少个氮分子?练习:物质
质量物质
的量微粒
数÷M×M×NA÷NA×22.4L/mol÷22.4L/mol[小结](标准
状况)气体体积3、下列说法中,正确的是( )
A、1mol某气体的体积是22.4L,该气体所处的状况不一定是标准状况.
B、非标准状况下,1molO2的体积必定不是22.4L
C、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D、标准状况下,1molH2和O2的混合气体的体积不一定为22.4LC练习:作业:
1、阅读课本有关内容
2、课课练P61—62
(第一课时)复习:2、1mol任何物质的质量,我们可以通过摩尔质量出,若要通过质量求体积 还要知道什么? 密度,V=m/ρ3、下面就请同学们计算填表:(气体是指相同状况下)7.21018.31853.622.422.422.3分析上述两表,得出什么结论?1、1mol不同的固态或液态物质,体积不同。
2、在相同状态下,1mol气体的体积基本相同。那么不同状态的物质,体积大小跟哪些因素有关呢?
举一个例子:同学们在做操的时候,一个班在操场上所占的面积和哪些因素有关:人数、距离、胖瘦粒子数目粒子大小粒子间距现在我们讨论1mol物质的体积,也就是粒子数是6.02?1023。固、液体 气体6.02?1023 6.02?1023??对于固、液体,粒子间距很小,粒子的大小是决定物质体积大小的主要因素。在固态和液态中粒子本身的大小不同,决定了其体积不同。所以,1mol固体、液体的体积主要决定于原子、分子、离子的大小。对于气体,粒子间距较大,决定物质体积大小的主要因素是粒子间的距离。而不同的气体在一定温度和压强下,分子间的距离可以看作是相等的,所以1mol任何气体的体积基本相同结论:相同条件下,1mol气体的体积主要决定与分子间的距离。一.气体摩尔体积
定义:单位物质的量的气体所占的体积。
符号:Vm
单位:L/mol或m3/mol等
公式:
Vm= ——
对象:任何气体(纯净或混合气体)
标准状况:Vm约22.4L/mol
标准状况: 温度:0oC、压强1.01×105PaVn思考:1mol气体在任何状况下所占的体积是不是相等?是不是都约为22 .4L?几点注意:1、状态:气体
2、状况:一定温度和压强下,一般指标准状况
3、定量:1mol
4、数值:22 .4L
5、通常状况:200C、1atm
6、气体体积与微粒数目有关,与种类无关。
7、结论:在标准状况下,1mol任何气体所占的体积都约为22 .4L。
8、有关计算:(标准状况下)
V=n×22.4L/mol(n---气体的物质的量)1、下列说法是否正确?
(1)、1摩尔氢气的体积约为22.4L
(2)、标准状况下,1摩尔水的体积约22.4升。
(3)、20oC时, 1摩尔氧气的体积约22.4升。
(4)、2×105Pa时,1摩尔氮气的体积小于22.4升。 2、标准状况下:
(1)44.8升氢气的物质的量是多少?
(2)0.5摩尔氧气的体积是多少?
(3)14克CO的体积是多少?
(4)33.6升氮气中含多少个氮分子?练习:物质
质量物质
的量微粒
数÷M×M×NA÷NA×22.4L/mol÷22.4L/mol[小结](标准
状况)气体体积3、下列说法中,正确的是( )
A、1mol某气体的体积是22.4L,该气体所处的状况不一定是标准状况.
B、非标准状况下,1molO2的体积必定不是22.4L
C、某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4L
D、标准状况下,1molH2和O2的混合气体的体积不一定为22.4LC练习:作业:
1、阅读课本有关内容
2、课课练P61—62
