选修3 原子结构(3)-新课标[下学期]
文档属性
| 名称 | 选修3 原子结构(3)-新课标[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 546.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-04-02 20:20:00 | ||
图片预览





文档简介
课件14张PPT。广东肇庆中学 曾凯芳原子结构电子云与原子轨道宏观、微观运动的不同宏观物体的运动特征:可以准确地测出它们在某一时刻所处的位置及运行的速度;
可以描画它们的运动轨迹。微观物体的运动特征:核外电子质量小,运动空间小,运动速率大。
无确定的轨道,无法描述其运动轨迹。
无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会的多少。核外电子运动的特征核外电子运动状态的描述电子云:描述核外电子运动特征的图象。
电子云中的小黑点:
并不是表示原子核外的一个电子,而是表示电子在此空间出现的机率。
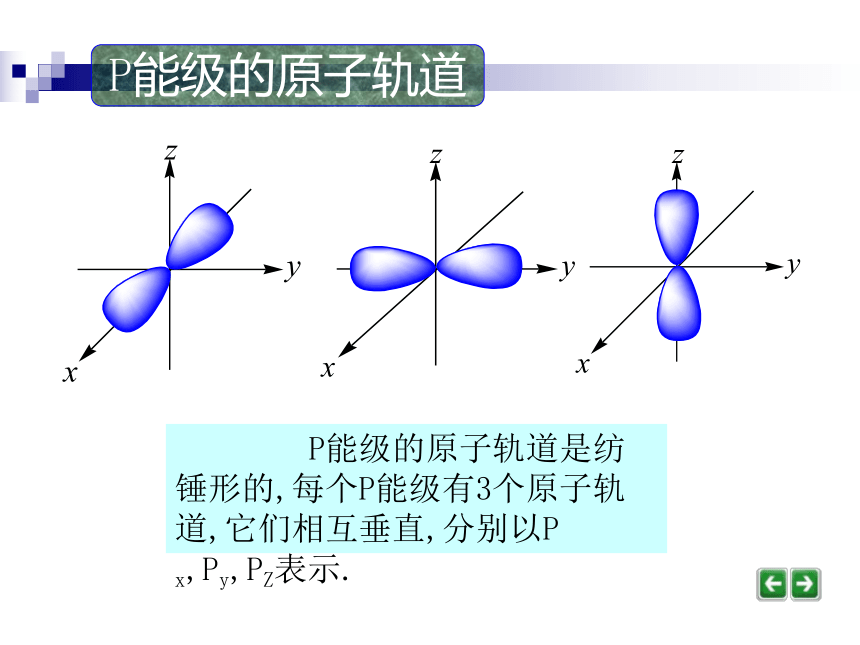
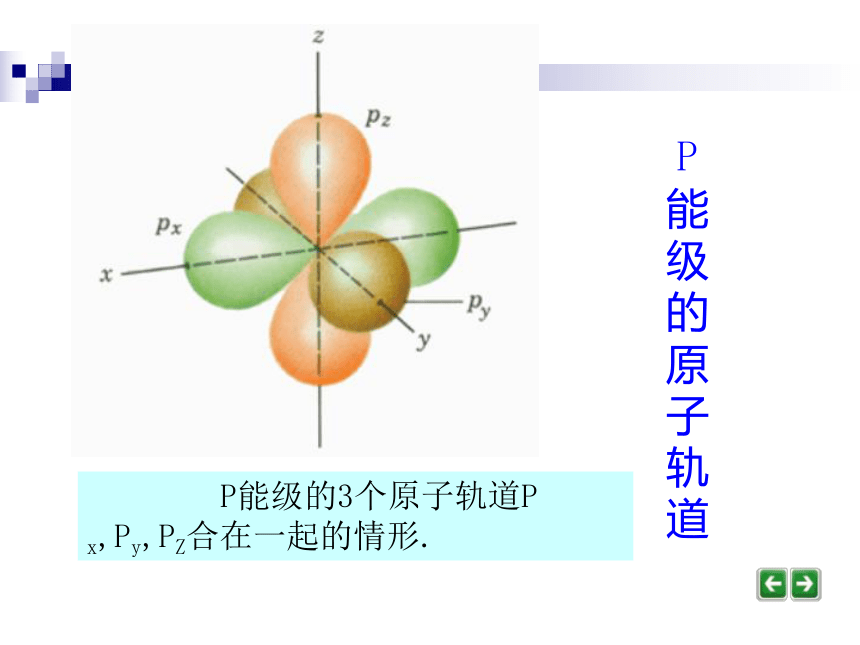
电子云密度大的地方说明电子出现的机会多,而电子云密度小的地方说明电子出现的机会少。电子云(演示)S能级的原子轨道电子云轮廓图----原子轨道S能级的原子轨道是球形对称的. P能级的原子轨道是纺锤形的,每个P能级有3个原子轨道,它们相互垂直,分别以P x,Py,PZ表示. P能级的原子轨道P能级的原子轨道 P能级的3个原子轨道P x,Py,PZ合在一起的情形. d能级的原子轨道有5个.d能级的原子轨道原子轨道与火车运行的轨道有何不同? 原子轨道是指一定能级上的电子,在核外空间运动的一个空间区域.火车的轨道则是火车运行的一个固定路线.问题讨论1、S、P、d能级分别有多少个轨道,每个轨道上最多能容纳几个电子?其自旋方向怎样?
2、举例说明洪特规则:科学研究阅读课文P12,讨论下列问题 S p d f能级分别有2、3、5、7个轨道,每个轨道最多能容纳的电子数为2个,且自旋方向相反。这就是泡利原理
当电子排布在同一能级的不同轨道时,总是首先单独占一个轨道(即分占不同的轨道),而且自旋方向相同。课堂练习 用轨道表示式表示出铁原子的核外电子排布↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利原理能量最低原理1、从元素周期表中查出铜的外围电子排布,它是否符合构造原理。
当一个能级上的电子填充达到全充满,半充满或全空时是一种稳定状态,使得体系的能量较低。这就是洪特规则的第二条。
2、钠的电子排布式可写成[Ne]3S1,试问:上式方括号中的符号是什么意思?思考与交流 通读本节《原子结构》课文,归纳本节知识内容,并自出自解一道题。
(以上两项均写在作业本上)作 业
老曾学做课件之
肇中版
2005-30
再 见
可以描画它们的运动轨迹。微观物体的运动特征:核外电子质量小,运动空间小,运动速率大。
无确定的轨道,无法描述其运动轨迹。
无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会的多少。核外电子运动的特征核外电子运动状态的描述电子云:描述核外电子运动特征的图象。
电子云中的小黑点:
并不是表示原子核外的一个电子,而是表示电子在此空间出现的机率。
电子云密度大的地方说明电子出现的机会多,而电子云密度小的地方说明电子出现的机会少。电子云(演示)S能级的原子轨道电子云轮廓图----原子轨道S能级的原子轨道是球形对称的. P能级的原子轨道是纺锤形的,每个P能级有3个原子轨道,它们相互垂直,分别以P x,Py,PZ表示. P能级的原子轨道P能级的原子轨道 P能级的3个原子轨道P x,Py,PZ合在一起的情形. d能级的原子轨道有5个.d能级的原子轨道原子轨道与火车运行的轨道有何不同? 原子轨道是指一定能级上的电子,在核外空间运动的一个空间区域.火车的轨道则是火车运行的一个固定路线.问题讨论1、S、P、d能级分别有多少个轨道,每个轨道上最多能容纳几个电子?其自旋方向怎样?
2、举例说明洪特规则:科学研究阅读课文P12,讨论下列问题 S p d f能级分别有2、3、5、7个轨道,每个轨道最多能容纳的电子数为2个,且自旋方向相反。这就是泡利原理
当电子排布在同一能级的不同轨道时,总是首先单独占一个轨道(即分占不同的轨道),而且自旋方向相同。课堂练习 用轨道表示式表示出铁原子的核外电子排布↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利原理能量最低原理1、从元素周期表中查出铜的外围电子排布,它是否符合构造原理。
当一个能级上的电子填充达到全充满,半充满或全空时是一种稳定状态,使得体系的能量较低。这就是洪特规则的第二条。
2、钠的电子排布式可写成[Ne]3S1,试问:上式方括号中的符号是什么意思?思考与交流 通读本节《原子结构》课文,归纳本节知识内容,并自出自解一道题。
(以上两项均写在作业本上)作 业
老曾学做课件之
肇中版
2005-30
再 见
