硫酸课件第一课时[下学期]
文档属性
| 名称 | 硫酸课件第一课时[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 25.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-05-22 11:31:00 | ||
图片预览







文档简介
课件20张PPT。第三节 硫酸
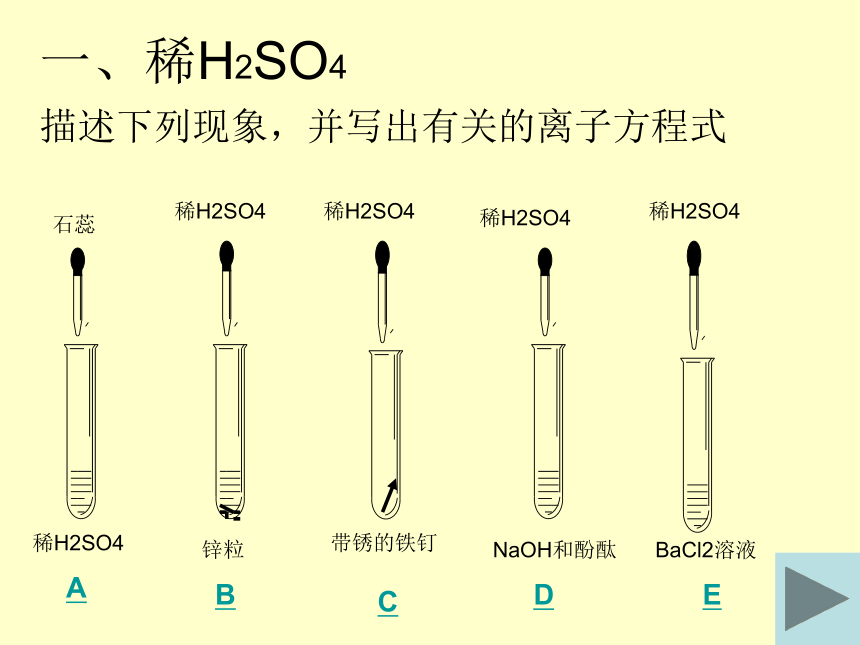
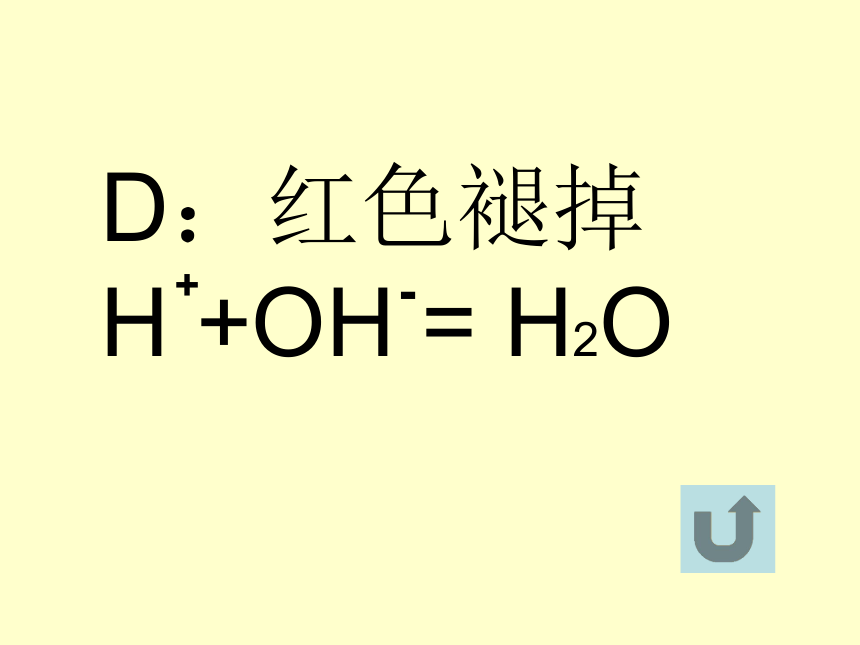
(第一课时)一、稀H2SO4描述下列现象,并写出有关的离子方程式A:变为红色E:白色沉淀 Ba +SO4 = BaSO42+2-D:红色褪掉 H + OH = H2O+ -C:变的光亮 Fe2O3+6H =2Fe +3H2O+3+B:产生气泡 Zn+2H = H2 +Zn+2+A:变为红色变化实质H2SO4在溶液中全部电离
H2SO4=2H + SO4
上述变化是由H 和SO4 所引起的+2-2-+二、浓硫酸的性质(一)、物理性质1、纯硫酸(或浓硫酸)无色油状液体2、沸点高-----难挥发性(98.3%、 338℃)3、极易溶于H2O-----任意比溶于水,同时放出大量的热。4、密度大,98%(1.84)
思考题:
1、根据上述物性你能想到哪些实验问题?涉及到有关什么物性?
2、根据上述物理性质如何区别两瓶失去标签的浓HCl和浓H2SO4?
(1)、稀释注意点是-----密度大,极易溶于水,放出大量热。
(2)、用浓硫酸来制取挥发性的酸(HCl)-----难挥发
(二)、特性1、吸水性2、脱水性:实验用途:干燥剂(NH3、H2S、HBr、HI等除外)指浓硫酸将某些有机物中氢、氧元素按原子个数比2:1脱去的性质。
思考:
脱水性与吸水性有什么区别?吸水指对方物质含“游离水” (一般为物理变化)脱水指对方物质无水,是将所含H、O元素按原子个数2:1形式脱掉为化学变化。3、强氧化性(1)、与金属的反应实验说明:(2)应注明“浓”和“加热”(3)气体产物不是H2,而是SO2。(4)浓H2SO4表现“两性”(1)实验改进——Cu与浓硫酸反应返回小结:特例:图片常温下,Fe、Al被浓H2SO4氧化为一层致密的氧化膜,而阻止内部金属继续氧化————“钝化”(2)、与非金属的反应(3)、与还原性化合物的反应实验探究——蔗糖的“发糕”实验取少量蔗糖于烧杯中,滴加几滴水搅拌均匀后,再注入适量浓硫酸迅速搅拌。
请推测实验现象,并说明依据。表现了浓硫酸的三大特性问题探究——浓H2SO4与稀H2SO4为什么性质不同?练习下列各表现硫酸了的什么性质?
1、敞口放置浓硫酸,质量增加_____
2、把CuSO4·5H2O晶体放入浓硫酸中时,变成白色_____
3、锌粒放入稀硫酸中时,有气体放出______
4、把木屑放入浓硫酸中时,变黑____
5、用浓硫酸制取HCl_____吸水性吸水性酸性脱水性难挥发性
(第一课时)一、稀H2SO4描述下列现象,并写出有关的离子方程式A:变为红色E:白色沉淀 Ba +SO4 = BaSO42+2-D:红色褪掉 H + OH = H2O+ -C:变的光亮 Fe2O3+6H =2Fe +3H2O+3+B:产生气泡 Zn+2H = H2 +Zn+2+A:变为红色变化实质H2SO4在溶液中全部电离
H2SO4=2H + SO4
上述变化是由H 和SO4 所引起的+2-2-+二、浓硫酸的性质(一)、物理性质1、纯硫酸(或浓硫酸)无色油状液体2、沸点高-----难挥发性(98.3%、 338℃)3、极易溶于H2O-----任意比溶于水,同时放出大量的热。4、密度大,98%(1.84)
思考题:
1、根据上述物性你能想到哪些实验问题?涉及到有关什么物性?
2、根据上述物理性质如何区别两瓶失去标签的浓HCl和浓H2SO4?
(1)、稀释注意点是-----密度大,极易溶于水,放出大量热。
(2)、用浓硫酸来制取挥发性的酸(HCl)-----难挥发
(二)、特性1、吸水性2、脱水性:实验用途:干燥剂(NH3、H2S、HBr、HI等除外)指浓硫酸将某些有机物中氢、氧元素按原子个数比2:1脱去的性质。
思考:
脱水性与吸水性有什么区别?吸水指对方物质含“游离水” (一般为物理变化)脱水指对方物质无水,是将所含H、O元素按原子个数2:1形式脱掉为化学变化。3、强氧化性(1)、与金属的反应实验说明:(2)应注明“浓”和“加热”(3)气体产物不是H2,而是SO2。(4)浓H2SO4表现“两性”(1)实验改进——Cu与浓硫酸反应返回小结:特例:图片常温下,Fe、Al被浓H2SO4氧化为一层致密的氧化膜,而阻止内部金属继续氧化————“钝化”(2)、与非金属的反应(3)、与还原性化合物的反应实验探究——蔗糖的“发糕”实验取少量蔗糖于烧杯中,滴加几滴水搅拌均匀后,再注入适量浓硫酸迅速搅拌。
请推测实验现象,并说明依据。表现了浓硫酸的三大特性问题探究——浓H2SO4与稀H2SO4为什么性质不同?练习下列各表现硫酸了的什么性质?
1、敞口放置浓硫酸,质量增加_____
2、把CuSO4·5H2O晶体放入浓硫酸中时,变成白色_____
3、锌粒放入稀硫酸中时,有气体放出______
4、把木屑放入浓硫酸中时,变黑____
5、用浓硫酸制取HCl_____吸水性吸水性酸性脱水性难挥发性
