铵盐[下学期]
图片预览





文档简介
课件17张PPT。第二节 氨 铵盐
第二课时二、铵盐
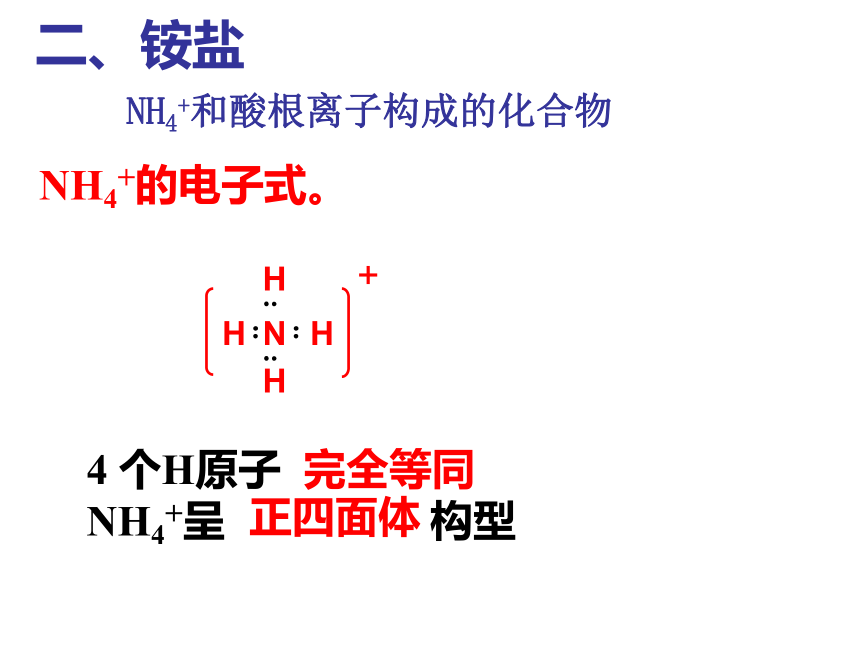
NH4+和酸根离子构成的化合物4 个H原子
NH4+呈 构型NH4+的电子式。完全等同正四面体1、铵盐的物理性质:2、铵盐的化学性质:都能溶于水的白色晶体。一般生成氨和相应的酸。*问题3:为什么铵肥施用时要埋在土下并
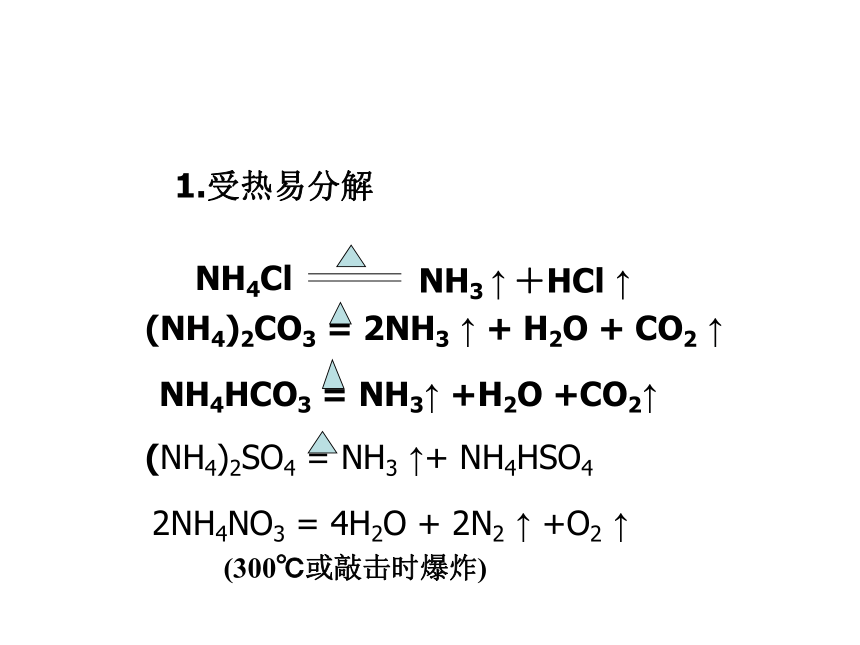
及时灌水?*问题1:氯化铵受热时的现象是升华吗?(1)易分解: NH4Cl==HCl+NH3
NH3+HCl==NH4Cl*问题2:下面两个反应是可逆反应吗?△1.受热易分解NH3 ↑ +HCl ↑NH4ClNH4HCO3 = NH3↑ +H2O +CO2↑(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑2NH4NO3 = 4H2O + 2N2 ↑ +O2 ↑(NH4)2SO4 = NH3 ↑+ NH4HSO4(300℃或敲击时爆炸)*注意1:铵盐与碱固体间反应时不能写离子方程式。【实验】与碱反应铵盐跟碱共热都能反应放出氨气。(NH4)2SO4+2NaOH == 2NH3↑+Na2SO4+2H2O
NH4Cl+NaOH== NH3↑+ NaCl+H2O△△若在溶液中进行,可用离子方程式表示如下:
NH4+ +OH- == NH3↑ + H2O
或 NH4+ +OH- == NH3. H2O
上述两个离子方程式的区别是什么?*注意2:铵盐与碱溶液间反应时浓溶液或加热产生氨气,稀溶液不加热生成NH3 ? H2O。△3、NH4+的检验:1、取少量样品与碱混合于试管中共热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则证明样品中含有NH4+;
2、用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+。讨论后回答:操作(试剂)、现象、结论。4.NH3的实验室制法:(1)药品:(2)原理:(3)装置:固+固,加热型(4)收集:(5)验满:①湿润的红色石蕊试纸变蓝
(唯一的一种碱性气体);
②蘸有浓HCl的玻璃棒接近
试管口产生白烟。2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑向下排空气法氯化铵晶体、消石灰固体?棉花的作用: ?干燥氨气的常用试剂:?实验室中其余的制氨气的方法:①CaO、碱石灰等碱性干燥剂②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)通过浸湿稀硫酸起到环保作用。①加热浓氨水法(装置与实验室制氯气的发生装置相同)②浓氨水加碱石灰法(碱石灰吸水、溶解时放热)4、铵盐的用途①大量的铵盐用于生产氮肥
③氯化铵常用作印染和制干电池的原料, 也可以做焊药,用于金属的焊接,以除去金属表面的氧化物薄膜。②硝酸铵用于制炸药1、铵盐的通性是
A、加热时一定有氨生成 B、与碱共热时都产生氨
C、都是晶体,都溶于水 D、能与酸反应??2、检验铵盐的方法是将待测物取出少许放入试管中,然后
A、加热,用润湿红色石蕊试纸在管口试之
B、加水溶解,用红色石蕊试纸试其溶液
C、加强碱溶液,加热,滴入酚酞试剂
D、加苛性钠溶液加热,用润湿红色石蕊试纸在管口试之
?3.能用NH4++OH-=NH3↑+H2O表示的化学反应为 (均为溶液中反应)
(A) 、NH4HCO3+NaOH (B)、NH4Br+NaOH
(C) 、(NH4)2SO4+Ba(OH)2 (D)、NH4HSO4+KOH?4.下列混合物可用加热方法分离
(A)碘和氯化铵 (B)硝酸钾和纯碱
(C)硫酸钾和碳酸钾 (D)氯化铵和氯化钡?5.只用一种试剂,就可区别NH4Cl (NH4)2SO4 KCl Na2SO4 AlCl3 五种无色溶液,这种试剂是
(A)NaOH溶液 (B)AgNO3溶液
(C)BaCl2溶液 (D)Ba(OH)2溶液?1.四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是( )。 C2.白色固体A的水溶液能使蓝色石蕊试纸变红。把A装入试管中充分加热,A全部消失,同时产生白烟和紫色蒸汽。将加热生成的烟气通过浓热的NaOH溶液,紫色消失,但有无色气体。将这无色气体通过硫酸溶液,无色气体明显减少,再将剩余的无色气体在空气中点燃,产物生成水。由此上事实推知:
A的化学式应该是______________;
A受热变化的化学方程式是_________。
NH4I2 NH4I=2NH3↑+I2↑+H2↑3.用一种白色固体A和一种黄色固体B做如下实验:①A与等物质的量的一元强酸和一元强碱都能完全作用,依次生成有毒气体C和极易溶于水的气体D。②B在空气中燃烧生成气体E。E与C反应又生成B。③将D通入滴有石蕊的水中,溶液呈蓝色,再通入E,过量时溶液由蓝变红。④将E与空气混合通入装有催化剂的灼热的玻璃管,气体出口处有白雾生成。则(填化学式)
A是_________,B是________,
C是________,D是_______,
E是________。NH4HS,SH2SNH3SO24.从某物质A的水溶液出发有下面所示的一系列变化:(1)写出A~F物质的化学式。
(2)写出E→F的化学方程式:____________。
(3)鉴别物质F中阴离子的方法是_______。(1)写出A~F物质的化学式。
(2)写出E→F的化学方程式:____________。
(3)鉴别物质F中阴离子的方法是_______。
答案:
(1)A是(NH4)2SO3,B是(NH4)2SO4,C是SO2,D是NH3,E是K2SO3,F是K2SO4。
(2)K2SO3+Br2+H2O=K2SO4+2HBr。
(3)F中的阴离子是硫酸根离子,可以先加盐酸、再加BaCl2溶液来鉴别。课堂小结:
1.什么叫铵盐?
2.铵盐在水中的溶解度是怎样 的?
3.铵盐的主要化学性质是
⑴受热分解:
⑵与碱反应:
4.氨气的实验室制法
5.铵盐的用途:
第二课时二、铵盐
NH4+和酸根离子构成的化合物4 个H原子
NH4+呈 构型NH4+的电子式。完全等同正四面体1、铵盐的物理性质:2、铵盐的化学性质:都能溶于水的白色晶体。一般生成氨和相应的酸。*问题3:为什么铵肥施用时要埋在土下并
及时灌水?*问题1:氯化铵受热时的现象是升华吗?(1)易分解: NH4Cl==HCl+NH3
NH3+HCl==NH4Cl*问题2:下面两个反应是可逆反应吗?△1.受热易分解NH3 ↑ +HCl ↑NH4ClNH4HCO3 = NH3↑ +H2O +CO2↑(NH4)2CO3 = 2NH3 ↑ + H2O + CO2 ↑2NH4NO3 = 4H2O + 2N2 ↑ +O2 ↑(NH4)2SO4 = NH3 ↑+ NH4HSO4(300℃或敲击时爆炸)*注意1:铵盐与碱固体间反应时不能写离子方程式。【实验】与碱反应铵盐跟碱共热都能反应放出氨气。(NH4)2SO4+2NaOH == 2NH3↑+Na2SO4+2H2O
NH4Cl+NaOH== NH3↑+ NaCl+H2O△△若在溶液中进行,可用离子方程式表示如下:
NH4+ +OH- == NH3↑ + H2O
或 NH4+ +OH- == NH3. H2O
上述两个离子方程式的区别是什么?*注意2:铵盐与碱溶液间反应时浓溶液或加热产生氨气,稀溶液不加热生成NH3 ? H2O。△3、NH4+的检验:1、取少量样品与碱混合于试管中共热,用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则证明样品中含有NH4+;
2、用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+。讨论后回答:操作(试剂)、现象、结论。4.NH3的实验室制法:(1)药品:(2)原理:(3)装置:固+固,加热型(4)收集:(5)验满:①湿润的红色石蕊试纸变蓝
(唯一的一种碱性气体);
②蘸有浓HCl的玻璃棒接近
试管口产生白烟。2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑向下排空气法氯化铵晶体、消石灰固体?棉花的作用: ?干燥氨气的常用试剂:?实验室中其余的制氨气的方法:①CaO、碱石灰等碱性干燥剂②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)通过浸湿稀硫酸起到环保作用。①加热浓氨水法(装置与实验室制氯气的发生装置相同)②浓氨水加碱石灰法(碱石灰吸水、溶解时放热)4、铵盐的用途①大量的铵盐用于生产氮肥
③氯化铵常用作印染和制干电池的原料, 也可以做焊药,用于金属的焊接,以除去金属表面的氧化物薄膜。②硝酸铵用于制炸药1、铵盐的通性是
A、加热时一定有氨生成 B、与碱共热时都产生氨
C、都是晶体,都溶于水 D、能与酸反应??2、检验铵盐的方法是将待测物取出少许放入试管中,然后
A、加热,用润湿红色石蕊试纸在管口试之
B、加水溶解,用红色石蕊试纸试其溶液
C、加强碱溶液,加热,滴入酚酞试剂
D、加苛性钠溶液加热,用润湿红色石蕊试纸在管口试之
?3.能用NH4++OH-=NH3↑+H2O表示的化学反应为 (均为溶液中反应)
(A) 、NH4HCO3+NaOH (B)、NH4Br+NaOH
(C) 、(NH4)2SO4+Ba(OH)2 (D)、NH4HSO4+KOH?4.下列混合物可用加热方法分离
(A)碘和氯化铵 (B)硝酸钾和纯碱
(C)硫酸钾和碳酸钾 (D)氯化铵和氯化钡?5.只用一种试剂,就可区别NH4Cl (NH4)2SO4 KCl Na2SO4 AlCl3 五种无色溶液,这种试剂是
(A)NaOH溶液 (B)AgNO3溶液
(C)BaCl2溶液 (D)Ba(OH)2溶液?1.四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满Cl2的试管是( )。 C2.白色固体A的水溶液能使蓝色石蕊试纸变红。把A装入试管中充分加热,A全部消失,同时产生白烟和紫色蒸汽。将加热生成的烟气通过浓热的NaOH溶液,紫色消失,但有无色气体。将这无色气体通过硫酸溶液,无色气体明显减少,再将剩余的无色气体在空气中点燃,产物生成水。由此上事实推知:
A的化学式应该是______________;
A受热变化的化学方程式是_________。
NH4I2 NH4I=2NH3↑+I2↑+H2↑3.用一种白色固体A和一种黄色固体B做如下实验:①A与等物质的量的一元强酸和一元强碱都能完全作用,依次生成有毒气体C和极易溶于水的气体D。②B在空气中燃烧生成气体E。E与C反应又生成B。③将D通入滴有石蕊的水中,溶液呈蓝色,再通入E,过量时溶液由蓝变红。④将E与空气混合通入装有催化剂的灼热的玻璃管,气体出口处有白雾生成。则(填化学式)
A是_________,B是________,
C是________,D是_______,
E是________。NH4HS,SH2SNH3SO24.从某物质A的水溶液出发有下面所示的一系列变化:(1)写出A~F物质的化学式。
(2)写出E→F的化学方程式:____________。
(3)鉴别物质F中阴离子的方法是_______。(1)写出A~F物质的化学式。
(2)写出E→F的化学方程式:____________。
(3)鉴别物质F中阴离子的方法是_______。
答案:
(1)A是(NH4)2SO3,B是(NH4)2SO4,C是SO2,D是NH3,E是K2SO3,F是K2SO4。
(2)K2SO3+Br2+H2O=K2SO4+2HBr。
(3)F中的阴离子是硫酸根离子,可以先加盐酸、再加BaCl2溶液来鉴别。课堂小结:
1.什么叫铵盐?
2.铵盐在水中的溶解度是怎样 的?
3.铵盐的主要化学性质是
⑴受热分解:
⑵与碱反应:
4.氨气的实验室制法
5.铵盐的用途:
