物质结构(二)0_167668[上学期]
文档属性
| 名称 | 物质结构(二)0_167668[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 126.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-07-10 09:22:00 | ||
图片预览





文档简介
课件17张PPT。专题复习二物质结构(二)知识点:
1. 化学键类型的判断
2. 电子式的书写例1: 下列物质中,不存在化学键的是( )
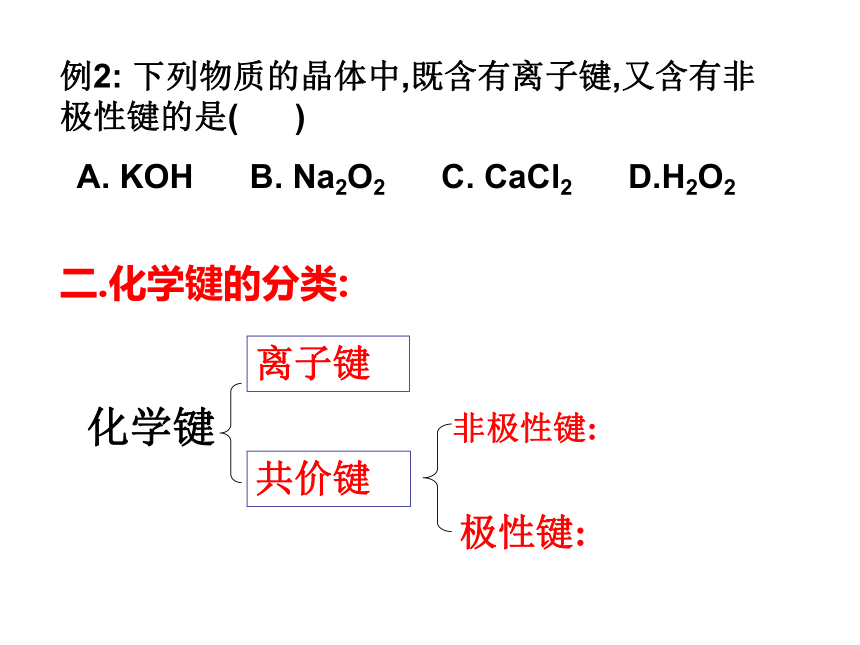
A. 氢气 B. 氦气 C. 氯化钠 D. 氯化氢一、化学键 在原子结合成分子时,相邻的原子之间强烈的相互作用,叫做化学键。2)化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。说明1)化学键存在于分子内原子(或离子)间, 不存在于分子之间;例2: 下列物质的晶体中,既含有离子键,又含有非极性键的是( )
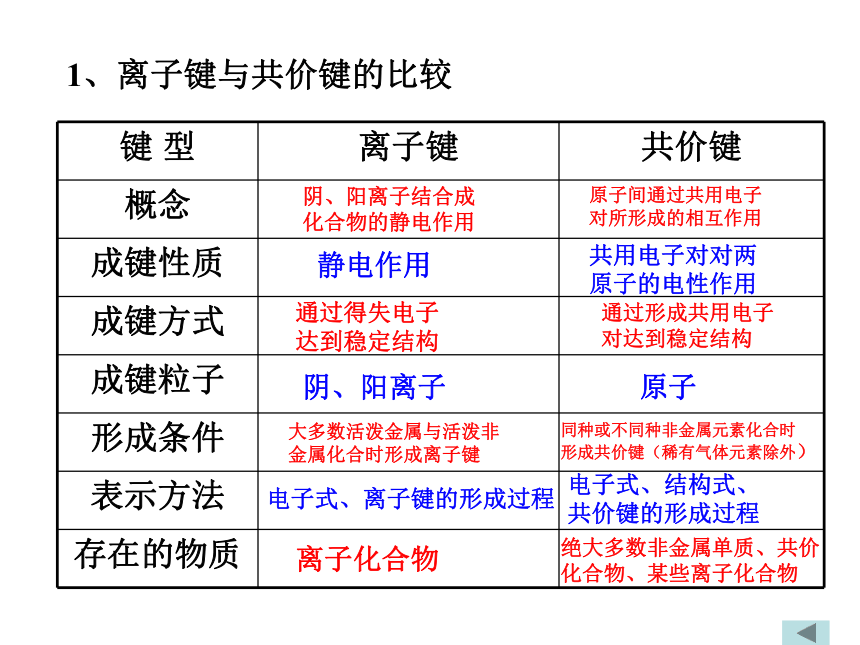
A. KOH B. Na2O2 C. CaCl2 D.H2O2二.化学键的分类:1、离子键与共价键的比较 阴、阳离子结合成
化合物的静电作用原子间通过共用电子
对所形成的相互作用静电作用共用电子对对两
原子的电性作用通过得失电子
达到稳定结构通过形成共用电子
对达到稳定结构阴、阳离子原子大多数活泼金属与活泼非
金属化合时形成离子键同种或不同种非金属元素化合时
形成共价键(稀有气体元素除外)电子式、离子键的形成过程电子式、结构式、
共价键的形成过程离子化合物绝大多数非金属单质、共价
化合物、某些离子化合物思考:
如何区别极性键与非极性键,请举例说明.1、离子化合物中可能含有共价键。正确。如离子化合物Na2O2、NaOH中含有共价键。2、共价化合物中可能含有离子键。不正确2、概念辨析3、两个非金属原子间不可能形成离子键。正确4、非金属原子间不可能形成离子键。不正确。如NH4Cl5、非极性键只存在于双原子单质分子里。不正确。如Na2O2中含有非极性键。1. 下列说法中正确的是 ( )
A. 全部由非金属元素组成的化合物一定是共价化合物
B. 非极性键只存在于非金属单质中
C. 气态单质分子中一定有共价键
D. 共价化合物中不可能含有离子键2. 下列物质在发生变化时,需克服化学键的是 ( )
A.干冰升华 B. NaCl晶体熔化
C. 电解水 D. 液溴挥发 常见题型:3. 下列分子结构中,每个原子的最外层电子都能满足8电子稳定结构的是( )
A.PCl3 B. HClO C. CO2 D. SO2规律: 每种元素的化合价绝对值与其最外层电子数之和均等于8的分子.三. 电子式书写:1.离子化合物与共价化合物的书写区别2.分清要写物质的电子式或写物质的形成过程知识点:知识讲解:4. 原子团的电子式: 同阴离子处理,
如:1. 原子的电子式: 直接以最外层电子数表示,
如:2. 金属阳离子的电子式: 直接以离子符号表示,
如:3. 阴离子的电子式:最外层达到稳定结构,用中括号,并注明电荷,
如:5. 物质的电子式的书写:
首先要区别是离子化合物或是共价化合物1)离子化合物:
如:2)共价化合物:
如:1、写出下列微粒的电子式:
N2、 CaCl2、 H2O2 、O22- 、CO22、用电子式表示下列物质的形成过程:
H2S、NaH练习:1. W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且最外层只有1个电子。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
⑴写出元素名称:W________,X________,
(2)Z元素的原子结构示意图为___________,其在周期表中的位置是____________。
(3)W2Z是由________________(填极性键或非极性键)组成的分子,用电子式表示其形成过程:_________________________________。
(4)由Y和W元素组成的物质的电子式__________,形成的化学键属于_________氢氧第三周期第VIA族极性键离子键常见题型:2. X、Y、Z、W 4种元素都位于短周期, 且原子序数X(2) [ZH4]+的电子式_____________,
(3)写出X2W和X2W2的电子式:______, ______,
(4)X、Y、Z、W组成的盐, 其原子数比为5:1:1:3, 其化学式是__________.3.A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,回答: ①写出下列元素的符号:B????? 、D??????? 、E????????? 。 ②用电子式写出A、F形成化合物的电子式??????????? 。 ③A、C两种元素最高价氧化物的水化物反应的离子方程式????????????????????。 ④D的固态氧化物自然界广泛存在的物质,也是工业上应用常见的原料,试写出它的用途两例: _________________.
1. 化学键类型的判断
2. 电子式的书写例1: 下列物质中,不存在化学键的是( )
A. 氢气 B. 氦气 C. 氯化钠 D. 氯化氢一、化学键 在原子结合成分子时,相邻的原子之间强烈的相互作用,叫做化学键。2)化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。说明1)化学键存在于分子内原子(或离子)间, 不存在于分子之间;例2: 下列物质的晶体中,既含有离子键,又含有非极性键的是( )
A. KOH B. Na2O2 C. CaCl2 D.H2O2二.化学键的分类:1、离子键与共价键的比较 阴、阳离子结合成
化合物的静电作用原子间通过共用电子
对所形成的相互作用静电作用共用电子对对两
原子的电性作用通过得失电子
达到稳定结构通过形成共用电子
对达到稳定结构阴、阳离子原子大多数活泼金属与活泼非
金属化合时形成离子键同种或不同种非金属元素化合时
形成共价键(稀有气体元素除外)电子式、离子键的形成过程电子式、结构式、
共价键的形成过程离子化合物绝大多数非金属单质、共价
化合物、某些离子化合物思考:
如何区别极性键与非极性键,请举例说明.1、离子化合物中可能含有共价键。正确。如离子化合物Na2O2、NaOH中含有共价键。2、共价化合物中可能含有离子键。不正确2、概念辨析3、两个非金属原子间不可能形成离子键。正确4、非金属原子间不可能形成离子键。不正确。如NH4Cl5、非极性键只存在于双原子单质分子里。不正确。如Na2O2中含有非极性键。1. 下列说法中正确的是 ( )
A. 全部由非金属元素组成的化合物一定是共价化合物
B. 非极性键只存在于非金属单质中
C. 气态单质分子中一定有共价键
D. 共价化合物中不可能含有离子键2. 下列物质在发生变化时,需克服化学键的是 ( )
A.干冰升华 B. NaCl晶体熔化
C. 电解水 D. 液溴挥发 常见题型:3. 下列分子结构中,每个原子的最外层电子都能满足8电子稳定结构的是( )
A.PCl3 B. HClO C. CO2 D. SO2规律: 每种元素的化合价绝对值与其最外层电子数之和均等于8的分子.三. 电子式书写:1.离子化合物与共价化合物的书写区别2.分清要写物质的电子式或写物质的形成过程知识点:知识讲解:4. 原子团的电子式: 同阴离子处理,
如:1. 原子的电子式: 直接以最外层电子数表示,
如:2. 金属阳离子的电子式: 直接以离子符号表示,
如:3. 阴离子的电子式:最外层达到稳定结构,用中括号,并注明电荷,
如:5. 物质的电子式的书写:
首先要区别是离子化合物或是共价化合物1)离子化合物:
如:2)共价化合物:
如:1、写出下列微粒的电子式:
N2、 CaCl2、 H2O2 、O22- 、CO22、用电子式表示下列物质的形成过程:
H2S、NaH练习:1. W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素且最外层只有1个电子。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
⑴写出元素名称:W________,X________,
(2)Z元素的原子结构示意图为___________,其在周期表中的位置是____________。
(3)W2Z是由________________(填极性键或非极性键)组成的分子,用电子式表示其形成过程:_________________________________。
(4)由Y和W元素组成的物质的电子式__________,形成的化学键属于_________氢氧第三周期第VIA族极性键离子键常见题型:2. X、Y、Z、W 4种元素都位于短周期, 且原子序数X
(3)写出X2W和X2W2的电子式:______, ______,
(4)X、Y、Z、W组成的盐, 其原子数比为5:1:1:3, 其化学式是__________.3.A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,回答: ①写出下列元素的符号:B????? 、D??????? 、E????????? 。 ②用电子式写出A、F形成化合物的电子式??????????? 。 ③A、C两种元素最高价氧化物的水化物反应的离子方程式????????????????????。 ④D的固态氧化物自然界广泛存在的物质,也是工业上应用常见的原料,试写出它的用途两例: _________________.
