物质结构与性质-杂化轨道理论简介ppt-新人[上学期]
文档属性
| 名称 | 物质结构与性质-杂化轨道理论简介ppt-新人[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 174.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-09-05 20:12:00 | ||
图片预览




文档简介
课件22张PPT。杂化轨道理论简介分析思考:
1、写出C原子电子排布的轨道表示式,并由此推测:CH4分子的C原子有没有可能形成四个共价键?怎样才能形成四个共价键?2、如果C原子就以1个2S轨道和3个2P轨道上的单电子,分别与四个H原子的1S轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH4分子的实际情况是否吻合? 如何才能使CH4分子中的C原子与四个H原子形成完全等同的四个共价键呢?原子轨道?
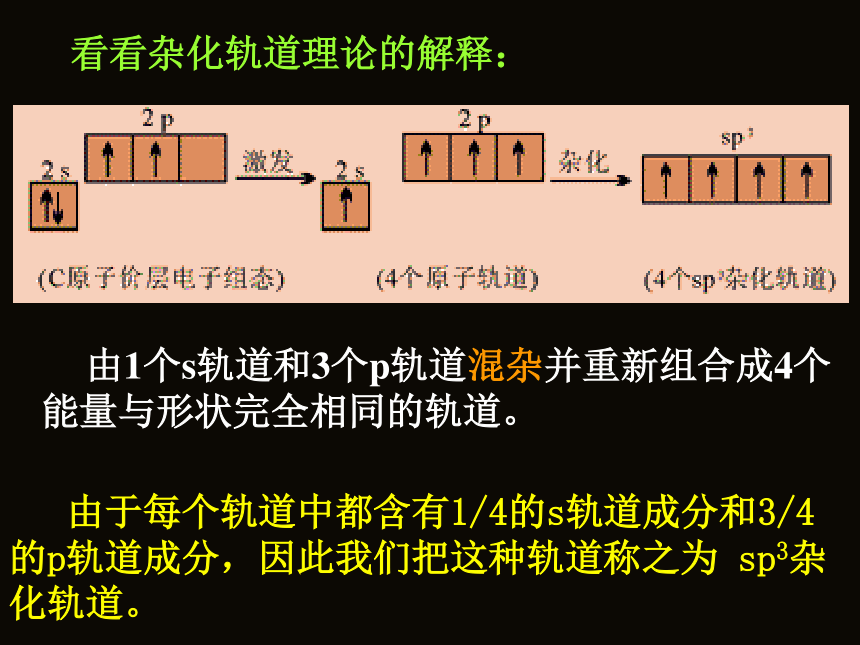
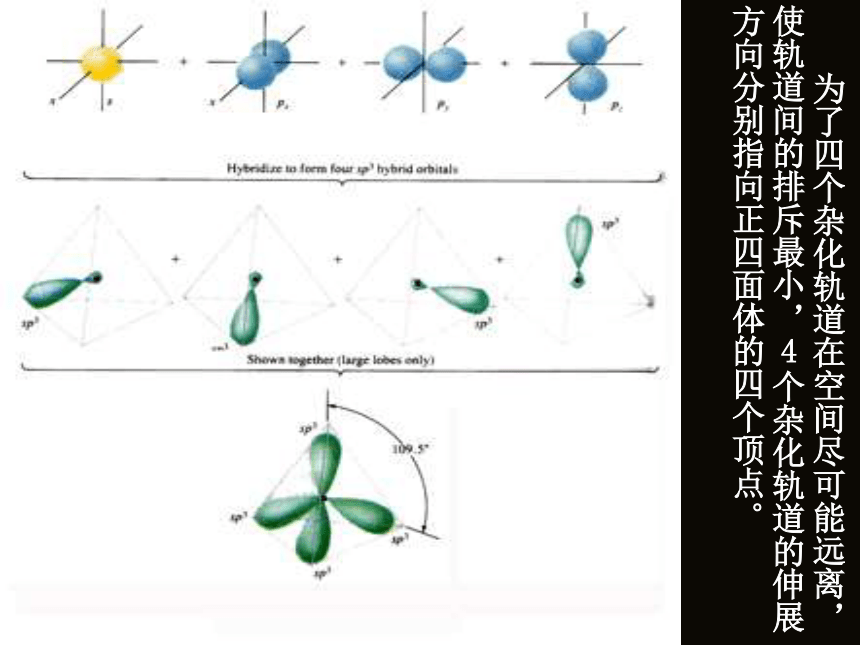
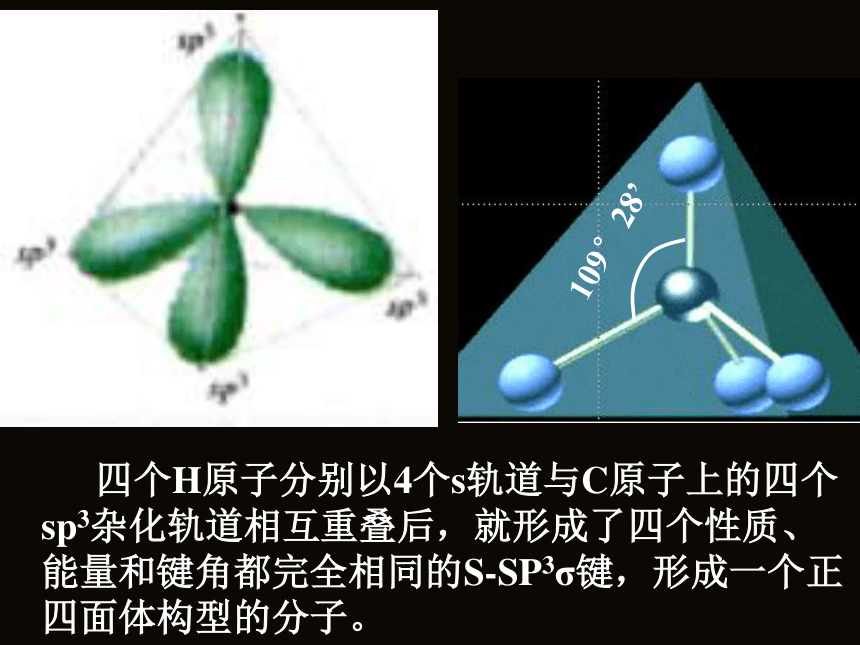
伸展方向? 看看杂化轨道理论的解释: 由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。 由于每个轨道中都含有1/4的s轨道成分和3/4的p轨道成分,因此我们把这种轨道称之为 sp3杂化轨道。141 为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向分别指向正四面体的四个顶点。 四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP3σ键,形成一个正四面体构型的分子。 通过以上的学习,以CH4为例,谈谈你对“杂化”及“杂化轨道”的理解。 C原子为什么要进行“杂化”?
C原子是如何进行“杂化”的?
“杂化轨道”有哪些特点? 通过分析CH2=CH2分子的结构,你认为分子中的C原子是否也需要“杂化”?
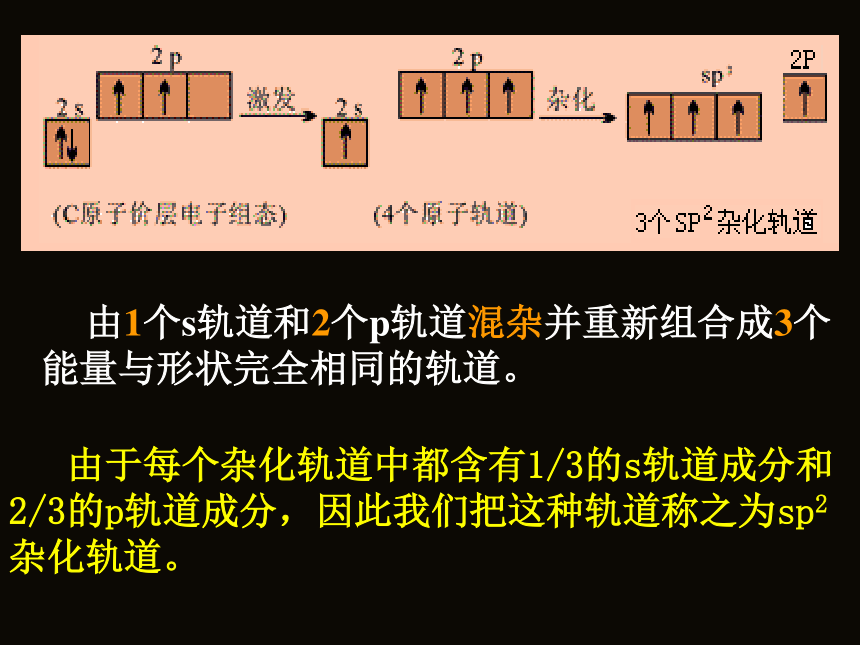
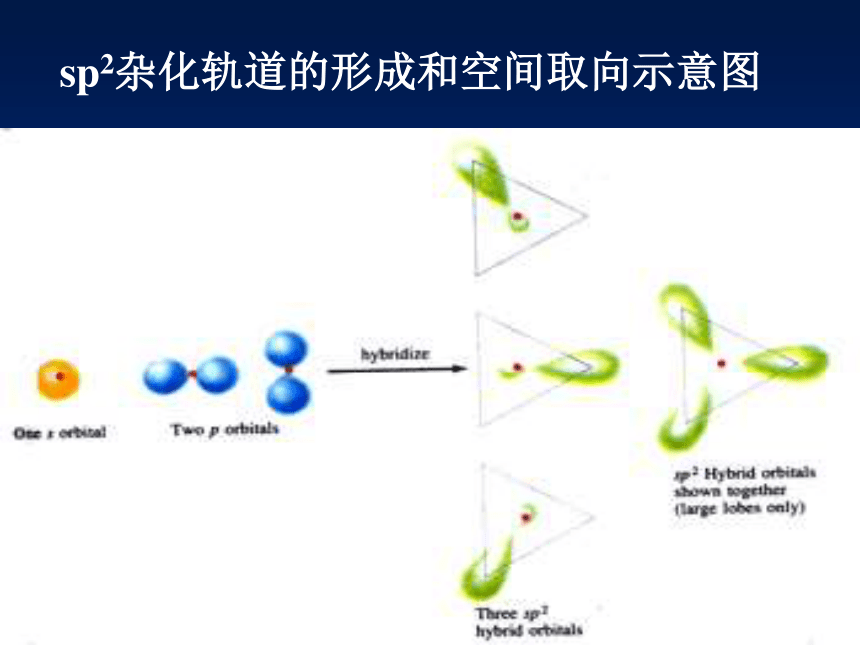
它又应该进行怎样的“杂化”? 由1个s轨道和2个p轨道混杂并重新组合成3个能量与形状完全相同的轨道。 由于每个杂化轨道中都含有1/3的s轨道成分和2/3的p轨道成分,因此我们把这种轨道称之为sp2杂化轨道。sp2杂化轨道的形成和空间取向示意图sp2杂化轨道的形成和特点:
由1个s轨道与2个p轨道组合成3个sp2 杂化轨道的过程称为sp2 杂化。每个sp2 杂化轨道中含有1/3的s轨道成分和2/3的p轨道成分。 为使轨道间的排斥能最小,3个sp2杂化轨道呈正三角形分布,夹角为1200。当3个sp2杂化轨道分别与其他3个相同原子的轨道重叠成键后,就会形成平面三角形构型的分子。 根据以上对SP2杂化过程的分析,自己尝试推测一下乙烯分子中C原子的杂化类型和成键情况,尤其是C=C的形成情况?
现在你能否解释乙烯分子的结构和性质特点了? 由1个s轨道和1个p轨道混杂并重新组合成2个能量与形状完全相同的轨道。 由于每个杂化轨道中都含有1/2的s轨道成分和1/2的p轨道成分,因此我们把这种轨道称之为SP杂化轨道。SP杂化轨道 sp杂化轨道的形成及特点:
由1个s轨道和1个p轨道“混杂”成2个sp杂化轨道的过程称为sp杂化,所形成的轨道称为sp杂化轨道。
为使轨道间的排斥能最小,轨道间的夹角为1800 。当2个sp杂化轨道与其他原子轨道重叠成键后就会形成直线型分子。 sp杂化轨道的形成和空间取向示意图三、杂化轨道理论简介1、杂化轨道
原子中能量相近的几个轨道间通过相互的混杂后,形成相同数量的几个能量与形状都相同的新轨道。2、杂化轨道的类型
(1)SP3杂化轨道
(2)SP2杂化轨道
(3)SP杂化轨道三种SP杂化轨道的比较 实例分析1: ?
试分析BeCl2分子的形成和空间构型。 Be原子的价层电子排布为2s2 。在形成BeCl2 分子的过程中,Be原子的1个2s电子被激发到2p空轨道,价层电子排布变为为2s1 2px1 。这2个含有单电子的2s轨道和2px轨道进行sp杂化,组成夹角为1800 的2个能量相同的sp杂化轨道,其形成过程可表示为:理论分析:Be原子上的两个SP杂化轨道分别与2个Cl原子中含有单电子的3p轨道重叠,形成2个sp-p的σ键,所以BeCl2分子的空间构型为直线。实验测定:BeCl2分子中有2个完全等同的Be-Cl键,键角为1800 ,分子的空间构型为直线。实例分析2:
试说明BF3分子的空间构型。 BF3分子的中心原子是B,其价层电子排布为2s22px1 。在形成BF3分子的过程中,B原子的2s轨道上的1个电子被激发到2p空轨道,价层电子排布为2s12px12py1 ,1个2s轨道和2个2p轨道进行sp2杂化,形成夹角均为1200的3个完全等同的SP2杂化轨道。其形成过程可表示为:理论分析:B原子的三个SP2杂化轨道分别与3个F原子含有单电子的2p轨道重叠,形成3个sp2-p的σ键。故BF3 分子的空间构型是平面三角形。实验测定:BF3分子中有3个完全等同的B-F键,键角为1200 ,分子的空间构型为平面三角形。 实例分析3:
试解释CCl4分子的空间构型。 CCl4分子的中心原子是C,其价层电子组态为2s22px12py1。在形成CCl4分子的过程中,C原子的2s轨道上的1个电子被激发到2p空轨道,价层电子组态为2s12px12py12pz1,1个2s轨道和3个2p轨道进行sp3杂化,形成夹角均为109028′的4个完全等同的sp3杂化轨道。其形成过程可表示为理论分析:C原子的4个sp3杂化轨道分别与4个Cl原子含有单电子的2p轨道重叠,形成4个sp3-p的σ键。故CCl4 分子的空间构型是正四面体.实验测定:CCl4分子中有四个完全等同的C-Cl键,其分子的空间构型为正四面体。 练习:
用杂化轨道理论分析下列物质的杂化类型、成键情况和分子的空间构型。
(1)CH2=CH2 (2)CHΞCH
(3)HCHO (4)HCN杂化轨道所用原子轨道的能量要相近,且杂化轨道只能用于形成σ键或容纳孤对电子,剩余的p轨道还可形成∏键。练习:
1、分析BeF2中的Be和NF3中N的杂化轨道类型及用杂化轨道理论分析它们的立体构型。
2、指出下列分子或离子中的杂化轨道的类型及分子或离子的路易斯结构式
A、CO2中的C_____ ________
B、BF3中的B_____ ________
C、CCl4中的C_____ _______
D、NH3中的N______ ________
1、写出C原子电子排布的轨道表示式,并由此推测:CH4分子的C原子有没有可能形成四个共价键?怎样才能形成四个共价键?2、如果C原子就以1个2S轨道和3个2P轨道上的单电子,分别与四个H原子的1S轨道上的单电子重叠成键,所形成的四个共价键能否完全相同?这与CH4分子的实际情况是否吻合? 如何才能使CH4分子中的C原子与四个H原子形成完全等同的四个共价键呢?原子轨道?
伸展方向? 看看杂化轨道理论的解释: 由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。 由于每个轨道中都含有1/4的s轨道成分和3/4的p轨道成分,因此我们把这种轨道称之为 sp3杂化轨道。141 为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向分别指向正四面体的四个顶点。 四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP3σ键,形成一个正四面体构型的分子。 通过以上的学习,以CH4为例,谈谈你对“杂化”及“杂化轨道”的理解。 C原子为什么要进行“杂化”?
C原子是如何进行“杂化”的?
“杂化轨道”有哪些特点? 通过分析CH2=CH2分子的结构,你认为分子中的C原子是否也需要“杂化”?
它又应该进行怎样的“杂化”? 由1个s轨道和2个p轨道混杂并重新组合成3个能量与形状完全相同的轨道。 由于每个杂化轨道中都含有1/3的s轨道成分和2/3的p轨道成分,因此我们把这种轨道称之为sp2杂化轨道。sp2杂化轨道的形成和空间取向示意图sp2杂化轨道的形成和特点:
由1个s轨道与2个p轨道组合成3个sp2 杂化轨道的过程称为sp2 杂化。每个sp2 杂化轨道中含有1/3的s轨道成分和2/3的p轨道成分。 为使轨道间的排斥能最小,3个sp2杂化轨道呈正三角形分布,夹角为1200。当3个sp2杂化轨道分别与其他3个相同原子的轨道重叠成键后,就会形成平面三角形构型的分子。 根据以上对SP2杂化过程的分析,自己尝试推测一下乙烯分子中C原子的杂化类型和成键情况,尤其是C=C的形成情况?
现在你能否解释乙烯分子的结构和性质特点了? 由1个s轨道和1个p轨道混杂并重新组合成2个能量与形状完全相同的轨道。 由于每个杂化轨道中都含有1/2的s轨道成分和1/2的p轨道成分,因此我们把这种轨道称之为SP杂化轨道。SP杂化轨道 sp杂化轨道的形成及特点:
由1个s轨道和1个p轨道“混杂”成2个sp杂化轨道的过程称为sp杂化,所形成的轨道称为sp杂化轨道。
为使轨道间的排斥能最小,轨道间的夹角为1800 。当2个sp杂化轨道与其他原子轨道重叠成键后就会形成直线型分子。 sp杂化轨道的形成和空间取向示意图三、杂化轨道理论简介1、杂化轨道
原子中能量相近的几个轨道间通过相互的混杂后,形成相同数量的几个能量与形状都相同的新轨道。2、杂化轨道的类型
(1)SP3杂化轨道
(2)SP2杂化轨道
(3)SP杂化轨道三种SP杂化轨道的比较 实例分析1: ?
试分析BeCl2分子的形成和空间构型。 Be原子的价层电子排布为2s2 。在形成BeCl2 分子的过程中,Be原子的1个2s电子被激发到2p空轨道,价层电子排布变为为2s1 2px1 。这2个含有单电子的2s轨道和2px轨道进行sp杂化,组成夹角为1800 的2个能量相同的sp杂化轨道,其形成过程可表示为:理论分析:Be原子上的两个SP杂化轨道分别与2个Cl原子中含有单电子的3p轨道重叠,形成2个sp-p的σ键,所以BeCl2分子的空间构型为直线。实验测定:BeCl2分子中有2个完全等同的Be-Cl键,键角为1800 ,分子的空间构型为直线。实例分析2:
试说明BF3分子的空间构型。 BF3分子的中心原子是B,其价层电子排布为2s22px1 。在形成BF3分子的过程中,B原子的2s轨道上的1个电子被激发到2p空轨道,价层电子排布为2s12px12py1 ,1个2s轨道和2个2p轨道进行sp2杂化,形成夹角均为1200的3个完全等同的SP2杂化轨道。其形成过程可表示为:理论分析:B原子的三个SP2杂化轨道分别与3个F原子含有单电子的2p轨道重叠,形成3个sp2-p的σ键。故BF3 分子的空间构型是平面三角形。实验测定:BF3分子中有3个完全等同的B-F键,键角为1200 ,分子的空间构型为平面三角形。 实例分析3:
试解释CCl4分子的空间构型。 CCl4分子的中心原子是C,其价层电子组态为2s22px12py1。在形成CCl4分子的过程中,C原子的2s轨道上的1个电子被激发到2p空轨道,价层电子组态为2s12px12py12pz1,1个2s轨道和3个2p轨道进行sp3杂化,形成夹角均为109028′的4个完全等同的sp3杂化轨道。其形成过程可表示为理论分析:C原子的4个sp3杂化轨道分别与4个Cl原子含有单电子的2p轨道重叠,形成4个sp3-p的σ键。故CCl4 分子的空间构型是正四面体.实验测定:CCl4分子中有四个完全等同的C-Cl键,其分子的空间构型为正四面体。 练习:
用杂化轨道理论分析下列物质的杂化类型、成键情况和分子的空间构型。
(1)CH2=CH2 (2)CHΞCH
(3)HCHO (4)HCN杂化轨道所用原子轨道的能量要相近,且杂化轨道只能用于形成σ键或容纳孤对电子,剩余的p轨道还可形成∏键。练习:
1、分析BeF2中的Be和NF3中N的杂化轨道类型及用杂化轨道理论分析它们的立体构型。
2、指出下列分子或离子中的杂化轨道的类型及分子或离子的路易斯结构式
A、CO2中的C_____ ________
B、BF3中的B_____ ________
C、CCl4中的C_____ _______
D、NH3中的N______ ________
