化学反应的利用[下学期]
文档属性
| 名称 | 化学反应的利用[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 871.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-04-05 08:07:00 | ||
图片预览










文档简介
课件33张PPT。
第三节化学反应的利用教学目的:
1、了解化学在人类社会发展中的作用;
2、掌握实验室制备氯气的原理和尾气处理
方法;了解制备装置及收集方法;
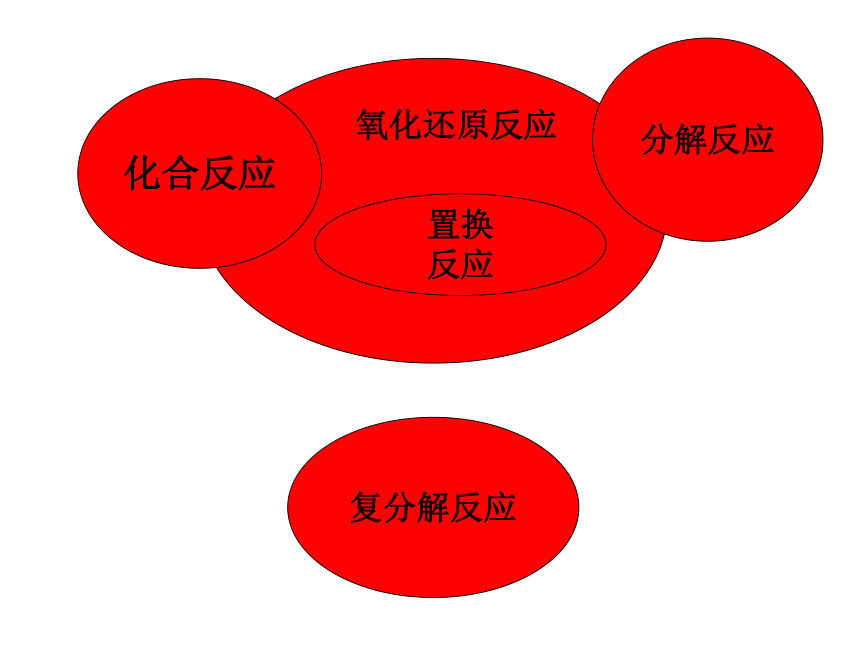
3、培养观察能力、实验能力和分析推理能力化学反应的分类
化合、分解、置换 和复分解
四种基本反应
有些反应为氧化还原反应
吸热和放热反应
有些反应为可逆反应 复习回顾1、化合反应分解反应置换
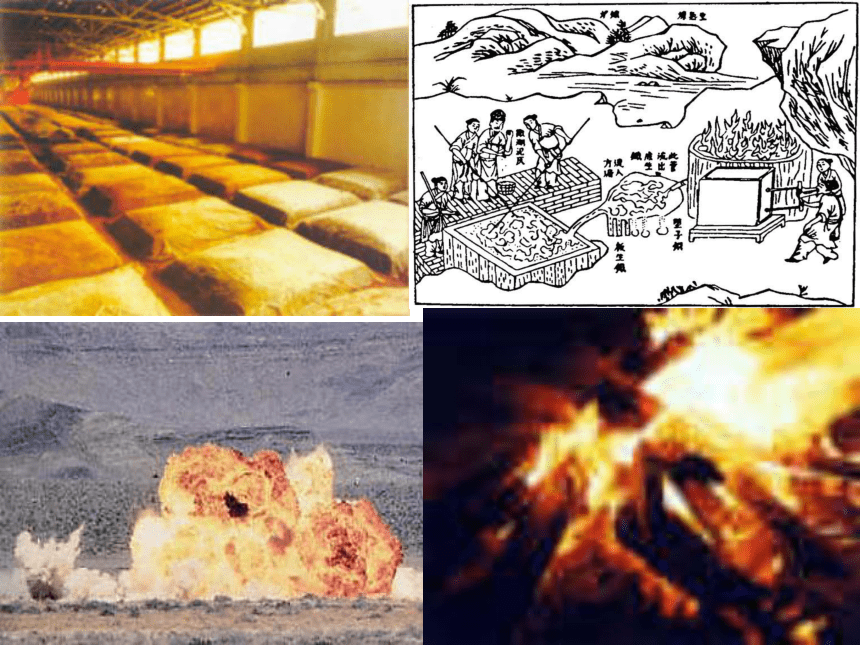
反应复分解反应氧化还原反应化学反应物质变化 提供物质 能量变化提供能量2、 自从有了人类,化学便与人类结下了不解之缘。钻木取火、用火烧烤食物、烧制陶器、冶炼青铜器和铁器等都是化学技术的应用。正是这些应用,极大地促进了当时社会生产力的发展,成为人类进步的标志。 我国古代在实用技术方面的成就主要
有冶金、火药、造纸、陶瓷、酿造等。 秦陶秦陶菜肴药品火柴文具礼花医用氧气液晶产品半导体生物陶瓷 今天,化学作为一门基础学科,在科学技术和社会生活方方面面正起着越来越大的作用。
1965年,我国科学工作者在世界上第一次用化学方法合成了具有生物活性的蛋白质——结晶牛胰素。
1981年,我国科学工作者又在世界上首次用人工方法
合成了一种具有与天然分子相同化学结构和完整生物的核糖核酸。
此外,我国还人工合成了许多结构复杂的天然有机化物,如叶绿素、血红素、维生素B12等。
结晶牛胰岛素化学科学中最具有创造性的工作
就是设计和制备新物质塑料、橡胶、纤维给工农业生产和生活
带来了很大的便利 化学----人类进步的关键化学与人类生活水平的提高和
人类社会的发展密切相关一、利用化学反应制备新物质
一种新物质是怎样利用化学反应制备出来的呢?
Cl2的实验室制取:
设疑复习回顾氯气的性质?请观察氯气,回答氯气有何 物理性质 ? 如何闻气体的气味?1、实验室制取原理
MnO2+4HCl(浓)= MnCl2+Cl2 +2H2O
该反应的离子方程式为:
反应的实质是:MnO2 将 HCl 中-1价的氯
为氯气,
其中浓盐酸表现了 性和 性 2、试剂:浓盐酸和二氧化锰从氧化还原角度分析反应,标出电子的转移情况和数目,
指出氧化剂,还原剂
3 实验装置
a 固体加热制气装置
b 固-液加热制取气体
c 固-液不加热制取气体
(02、NH3)(Cl2)(H2、CO2)实验装置选择的决定因素?
反应物的性质
反应条件右图是制取和收集某气体的实验装置,
可用于( )
A 用氢氧化钠和浓氨水制取氨气
B 用氯酸钾和二氧化锰制取氧气
C 用铜和稀硝酸制取一氧化氮
D 用浓硫酸和浓盐酸反应制取氯化氢D练习4 、实验仪器:按照从下到上,从左到右的顺序
铁架台(带铁圈、铁夹)酒精灯、石棉网、
圆底烧瓶、
双孔、橡皮塞、分液漏斗、导气管、集气瓶、烧杯
分液漏斗作用?
(滴加盐酸控制反应速率)
(1)凡是制气装置都存在气密性检查问题
关键是何时进行气密性检查?
一般应在仪器连接完之后,添加药品之前进行气密性检查。
(2)、 气密性检查的方法虽多种多样,但总的原则是堵死一 头,另一头通过导管插入水中,再微热(用掌心或酒精灯)
较大的玻璃容器的容积,若水中有气泡逸出, 停止加热后导管中有一段水柱上升则表示气密性良好,否则须重新组装与调试。5、气密性检查例、用示意图中的简易装置可以进行
气体的发生和收集。
实验前应如何检查该装置的气密性? 把导管伸入水槽的液面下,手握住试管,过会儿看到导管口有气泡冒出,松开手导管中形成一段水柱,则证明气密性良好6:除杂:先将混合气体通过盛饱和食盐水的
集气瓶(除HCl气体)
再通过浓H2SO4(除去水蒸气)得到纯净干 燥的Cl2
7、收集:
收集方法取决于气体的性质:密度、溶解性
向上排空气法(Cl2的密度比空气大)
排饱和食盐水法(Cl2不溶于饱和食盐水)7、问题
(1)实验过程:按照 连接好仪器
加药品和试剂, 检查装置的气密性
加热制气,净化,拆卸装置 (3)除杂时先通过饱和食盐水,再通过浓硫酸,不能颠倒
(4)Cl2有毒,尾气必须用碱液吸收,(将导管插入盛 NaOH 溶液的底部)(2)缓慢加热(急剧加热 浓HCl大量挥发)(思考:能否用Ca(OH)2 溶液?)防污染安全装置
①灼烧式 原理是有毒可燃性气体被灼烧除去 ②吸收式 原理是有毒气体如Cl2、SO2、H2S等与碱反应被除去 ③收集式 原理是将有害气体收集起来,另作处理。 小结Cl2的工业制法:
通电
2NaCl+2H2O= 2NaOH+H2 + Cl2[思考]Cl2的工业制法和实验室制 法的共同之处 实验室和工厂里利用哪些化学反应制备
下列物质的?请写出化学方程式。1、H2
2、CO2
3、H2SO4(以硫磺为原料)
4、HNO3 (以氨为原料)、NH3
、Cl2作业1、H2:
Zn+H2SO4=ZnSO4+H2
高温
C+H2O(g)=CO +H2
2、 CO2:
CaCO3+2HCl=CaCl2+CO2+H2O
高温
CaCO3=CaO+CO2
3、H2SO4:
点燃
S+O2 = SO2
催化剂
2SO2+O2 = 2SO3
SO3+H2O=H2SO4
4、4NH3+5O2=4NO+6H2O
2 NO+O2=2NO2
3NO2+H2O=2HNO3+NO5 生铁(以赤餮矿为原料)
工业制法:Fe2O3+3CO=2Fe +3CO2
6 氨(NH3)
2NH4Cl+Ca(OH)2=2NH3 +2H2O+CaCl2
第三节化学反应的利用教学目的:
1、了解化学在人类社会发展中的作用;
2、掌握实验室制备氯气的原理和尾气处理
方法;了解制备装置及收集方法;
3、培养观察能力、实验能力和分析推理能力化学反应的分类
化合、分解、置换 和复分解
四种基本反应
有些反应为氧化还原反应
吸热和放热反应
有些反应为可逆反应 复习回顾1、化合反应分解反应置换
反应复分解反应氧化还原反应化学反应物质变化 提供物质 能量变化提供能量2、 自从有了人类,化学便与人类结下了不解之缘。钻木取火、用火烧烤食物、烧制陶器、冶炼青铜器和铁器等都是化学技术的应用。正是这些应用,极大地促进了当时社会生产力的发展,成为人类进步的标志。 我国古代在实用技术方面的成就主要
有冶金、火药、造纸、陶瓷、酿造等。 秦陶秦陶菜肴药品火柴文具礼花医用氧气液晶产品半导体生物陶瓷 今天,化学作为一门基础学科,在科学技术和社会生活方方面面正起着越来越大的作用。
1965年,我国科学工作者在世界上第一次用化学方法合成了具有生物活性的蛋白质——结晶牛胰素。
1981年,我国科学工作者又在世界上首次用人工方法
合成了一种具有与天然分子相同化学结构和完整生物的核糖核酸。
此外,我国还人工合成了许多结构复杂的天然有机化物,如叶绿素、血红素、维生素B12等。
结晶牛胰岛素化学科学中最具有创造性的工作
就是设计和制备新物质塑料、橡胶、纤维给工农业生产和生活
带来了很大的便利 化学----人类进步的关键化学与人类生活水平的提高和
人类社会的发展密切相关一、利用化学反应制备新物质
一种新物质是怎样利用化学反应制备出来的呢?
Cl2的实验室制取:
设疑复习回顾氯气的性质?请观察氯气,回答氯气有何 物理性质 ? 如何闻气体的气味?1、实验室制取原理
MnO2+4HCl(浓)= MnCl2+Cl2 +2H2O
该反应的离子方程式为:
反应的实质是:MnO2 将 HCl 中-1价的氯
为氯气,
其中浓盐酸表现了 性和 性 2、试剂:浓盐酸和二氧化锰从氧化还原角度分析反应,标出电子的转移情况和数目,
指出氧化剂,还原剂
3 实验装置
a 固体加热制气装置
b 固-液加热制取气体
c 固-液不加热制取气体
(02、NH3)(Cl2)(H2、CO2)实验装置选择的决定因素?
反应物的性质
反应条件右图是制取和收集某气体的实验装置,
可用于( )
A 用氢氧化钠和浓氨水制取氨气
B 用氯酸钾和二氧化锰制取氧气
C 用铜和稀硝酸制取一氧化氮
D 用浓硫酸和浓盐酸反应制取氯化氢D练习4 、实验仪器:按照从下到上,从左到右的顺序
铁架台(带铁圈、铁夹)酒精灯、石棉网、
圆底烧瓶、
双孔、橡皮塞、分液漏斗、导气管、集气瓶、烧杯
分液漏斗作用?
(滴加盐酸控制反应速率)
(1)凡是制气装置都存在气密性检查问题
关键是何时进行气密性检查?
一般应在仪器连接完之后,添加药品之前进行气密性检查。
(2)、 气密性检查的方法虽多种多样,但总的原则是堵死一 头,另一头通过导管插入水中,再微热(用掌心或酒精灯)
较大的玻璃容器的容积,若水中有气泡逸出, 停止加热后导管中有一段水柱上升则表示气密性良好,否则须重新组装与调试。5、气密性检查例、用示意图中的简易装置可以进行
气体的发生和收集。
实验前应如何检查该装置的气密性? 把导管伸入水槽的液面下,手握住试管,过会儿看到导管口有气泡冒出,松开手导管中形成一段水柱,则证明气密性良好6:除杂:先将混合气体通过盛饱和食盐水的
集气瓶(除HCl气体)
再通过浓H2SO4(除去水蒸气)得到纯净干 燥的Cl2
7、收集:
收集方法取决于气体的性质:密度、溶解性
向上排空气法(Cl2的密度比空气大)
排饱和食盐水法(Cl2不溶于饱和食盐水)7、问题
(1)实验过程:按照 连接好仪器
加药品和试剂, 检查装置的气密性
加热制气,净化,拆卸装置 (3)除杂时先通过饱和食盐水,再通过浓硫酸,不能颠倒
(4)Cl2有毒,尾气必须用碱液吸收,(将导管插入盛 NaOH 溶液的底部)(2)缓慢加热(急剧加热 浓HCl大量挥发)(思考:能否用Ca(OH)2 溶液?)防污染安全装置
①灼烧式 原理是有毒可燃性气体被灼烧除去 ②吸收式 原理是有毒气体如Cl2、SO2、H2S等与碱反应被除去 ③收集式 原理是将有害气体收集起来,另作处理。 小结Cl2的工业制法:
通电
2NaCl+2H2O= 2NaOH+H2 + Cl2[思考]Cl2的工业制法和实验室制 法的共同之处 实验室和工厂里利用哪些化学反应制备
下列物质的?请写出化学方程式。1、H2
2、CO2
3、H2SO4(以硫磺为原料)
4、HNO3 (以氨为原料)、NH3
、Cl2作业1、H2:
Zn+H2SO4=ZnSO4+H2
高温
C+H2O(g)=CO +H2
2、 CO2:
CaCO3+2HCl=CaCl2+CO2+H2O
高温
CaCO3=CaO+CO2
3、H2SO4:
点燃
S+O2 = SO2
催化剂
2SO2+O2 = 2SO3
SO3+H2O=H2SO4
4、4NH3+5O2=4NO+6H2O
2 NO+O2=2NO2
3NO2+H2O=2HNO3+NO5 生铁(以赤餮矿为原料)
工业制法:Fe2O3+3CO=2Fe +3CO2
6 氨(NH3)
2NH4Cl+Ca(OH)2=2NH3 +2H2O+CaCl2
