化学反应中能量变化[上学期]
文档属性
| 名称 | 化学反应中能量变化[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 217.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-12 20:54:00 | ||
图片预览









文档简介
课件39张PPT。第三节:化学反应中的能量变化 复习化学反应过程中放出或吸收的热量。 放热反应和吸热反应: 有热量放出的化学反应叫放热反应。 如: 所有的燃烧反应,所有的中和反应,铝热反应,金属与酸反应等吸收热量的化学反应叫吸热反应。 如Ba(OH)2·8H2O与NH4Cl的反应,盐的水解反应,灼热的碳与二氧化碳的反应等反应热:[练习]1、下列变化中,属于放热反应的是( )A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B[练习] 2、下列变化中,属于吸热反应的是( )
A.氨催化氧化生成NO
B.酸碱中和
C.酯化反应
D.焦炭与高温水蒸气反应 D[练习] 3.下列变化中,属于吸热反应的是( )
①液氨气化②将胆矾加热变为白色粉末③稀释浓硫酸④氨催化氧化生成NO⑤氯酸钾分解制O2⑥酸碱中和生成水⑦氯化铁溶于水显酸性
A.②⑤⑦ B.①③④
C.①②⑤ D.③④⑥A[练习] 4.下列变化过程中会吸收热量的是( )
①硝酸铵溶于水②物质的燃烧③苛性钠溶于水④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③
C.仅②④ D.②③④A当ΔH <0时,为放热反应
表示反应体系给出能量,反应体系的能量降低。 当ΔH >0时,为吸热反应
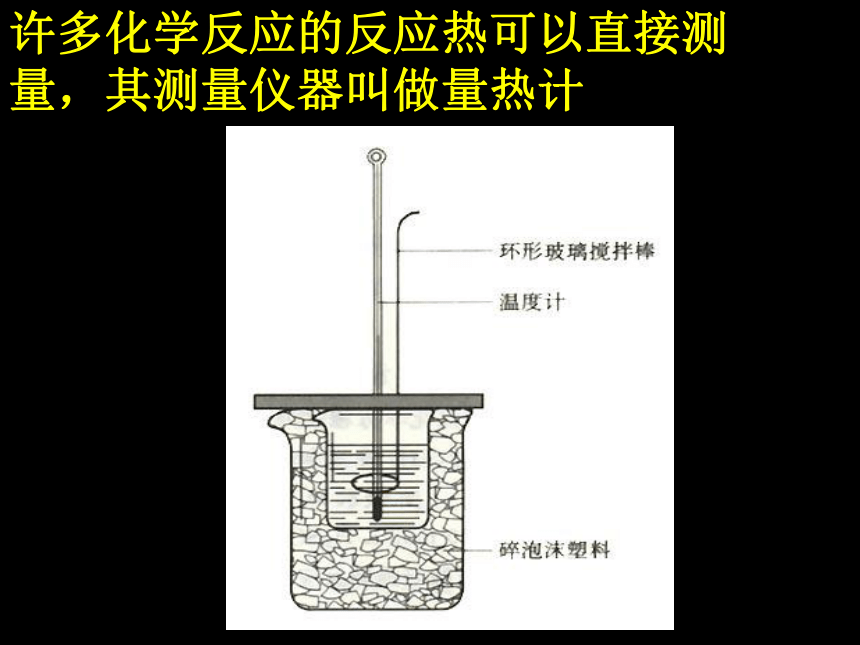
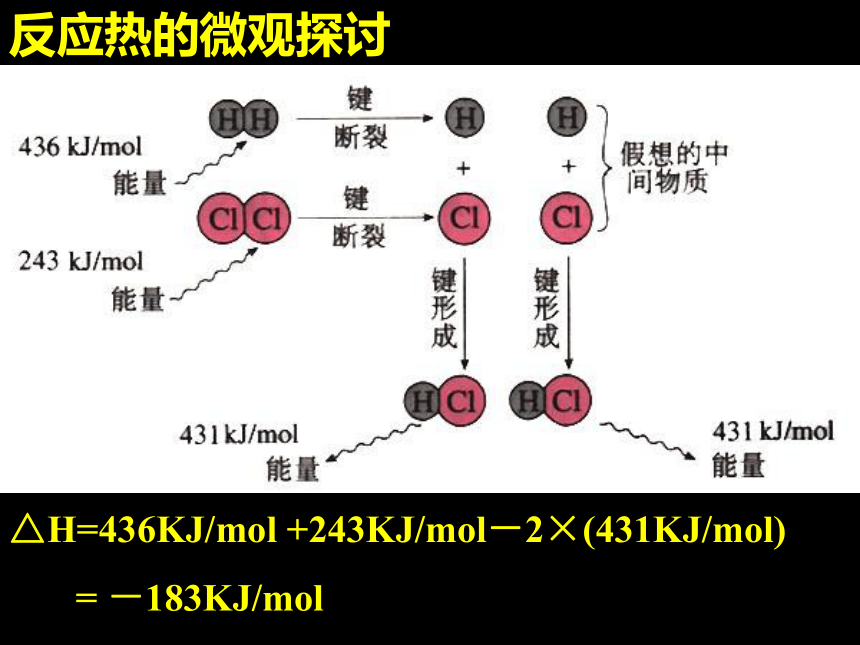
表示反应体系获得能量,反应体系的能量升高。1.概念:反应过程中放出或吸收的热量。 一.反应热2 .表示方法:用符号ΔH 表示,单位kJ/mol许多化学反应的反应热可以直接测量,其测量仪器叫做量热计反应中为什么会有能量的变化?微观:断键、成键作用;宏观:能量守恒作用.反应热的微观探讨△H=436KJ/mol +243KJ/mol-2×(431KJ/mol)
= -183KJ/mol 吸收436
kJ/mol ΔH=436 + 243 —2×431 = —183kJ/mol放出431
kJ/mol吸收243
kJ/mol 化学反应的本质:
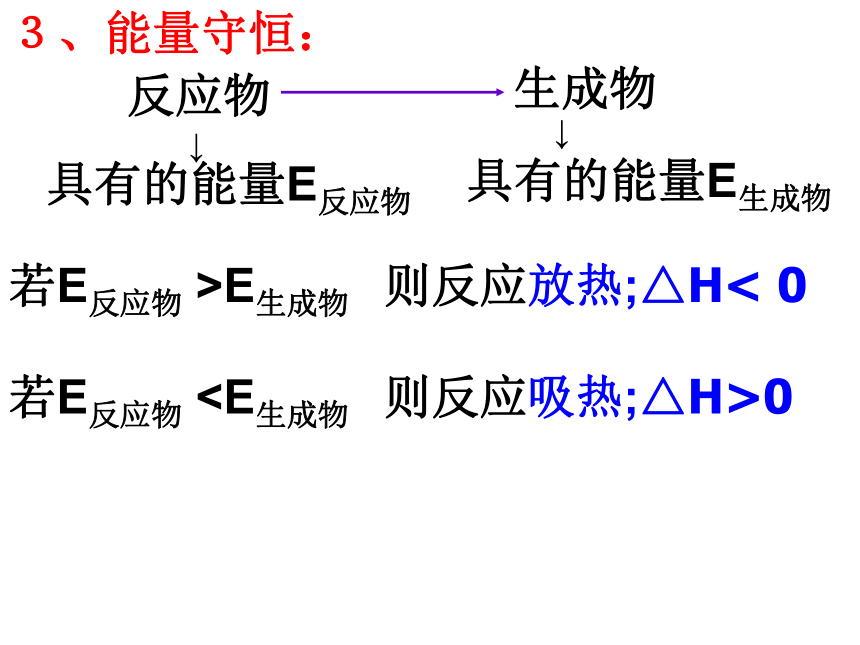
反应物中旧化学键的断裂和生成物中新化学键的形成。前者需要吸热而后者要放出热量。 3、能量守恒: 反应物 生成物 ↓ 具有的能量E反应物 具有的能量E生成物 ↓ 若E反应物 >E生成物 则反应放热;△H< 0若E反应物0 化学反应过程中能量变化示意图当ΔH为“- ”或ΔH<0时,为放热反应;
当ΔH为“ + ”或ΔH>0时,为吸热反应。[练习] (1)已知:H + H ═ H2;△H=-436kJ/mol,则下列叙述正确的是( )
A.H原子的能量高于H2的能量
B.H原子的能量低于H2的能量
C.H原子比H2分子稳定
D.H2分子比H原子稳定A D(2)已知键能:
N≡N △H=-946kJ/mol,
H-H △H=-436kJ/mol,
H-N △H=-391kJ/mol,
从理论上计算反应
N2(g) +3H2(g) 2NH3(g)的△H为( ) A.+1800kJ/mol B.+92kJ/mol C.-92kJ/mol D.-46kJ/mol C[练习] (3)下列叙述正确的是( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量A、C二、热化学方程式 1、定义:表明反应所放出或吸收的热量的化学方程式 。 反应放出或吸收的热量的多少与外界的温度和压强有关,所以需要注明反应的温度与压强,1)要注明温度和压强: 2、书写热化学方程式应注意的几点 不注明时指的是101kPa和25℃时的数据。因为物质的聚集状态不同所含的能量也不同。 固态 液态吸热气态吸热吸热2)反应物和生成物要注明聚集状态:∴H2O(l)═H2O(g);△H=+44kJ/mol 3)热化学方程式中各物质前的化学计量数表示的是物质的物质的量而不表示分子个数,因而必要时可用分数。一般出现分数时是以某一反应物或生成物为“1mol”时,其它物质才出现的。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol 2H2 (g) + O2(g)=2H2O(l);△H=-571.6kJ/mol4) △H的表示:
热化学方程式中的△H一定要注明“+”与“-” , “-”代表放热 ,“+”代表吸热。
特别注意:无论热化学方程式中各物质的化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的计量数成正比例。方程式与反应热之间用“;”隔开。3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或
吸收的热量。质→量→能[例]1、写出下列反应的热化学方程式(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量 C(s)+H2O(g)=CO(g)+H2(g);△H=+131.3kJ/mol(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量 2Cu(s)+O2(g)=2CuO(s); △H=-314kJ/mol[例]2、2.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6kJ,则C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);
△H=-2589.6kJ/mol练习3:(2003·江苏)已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g) ;
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l) ;
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l) ;
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l) ;
△H= - 48.40kJ·mol -1BB4.已知:C(s)+O2(g) = CO2(g);ΔH=-393.5 kJ/mol,
2H2(g)+O2(g) = 2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为( )
A.1∶1 B.1∶2
C.2∶3 D.3∶2A5、298K,101kPa时,合成氨反应的热化学方程式N2(g)+3H2(g)=2NH3(g);
△H=-92.38kJ/mol。
在该温度下,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么? 该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态, 1 mol N2(g)和3 mol H2(g)不能完全反应生成2 mol NH3(g),因而放出的热量总小于92.38kJ三、盖斯定律及其应用
C COΔH1
ΔH2ΔH3 CO2ΔH3=ΔH1 + ΔH2 盖斯定律——化学反应不管是一步完成还是分几步完成,其反应热是相同的。C(s)+ O2(g)═ CO2(g);
△H=-393.5KJ/mol ①①-②得:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:P4(s、白磷)+5O2(g)=P4O10(s); = -2983.2 kJ/molP(s、红磷)+5/4O2(g)=1/4P4O10(s); = -738.5kJ/mol试写出白磷转化为红磷的热化学方程式_____________________。练习2、铝在纯氧中燃烧,每生成1gAl2O3(固)放出QkJ热量,写出其热化学方程式 4Al(s)+3O2(g)=2Al2O3(s) ;ΔH=-204QkJ·mol-11、将12.7克固态碘与氢气完全反应生成碘化氢气体时,必须吸收2.604千焦的热量,其热化学方程式为 I2(s)+H2(g)=2HI(g); △H=+52.08KJ/molA3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A. H2O(g)=H2(g)+1/2O2(g); ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(l);
ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g); ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(g);
ΔH=+484kJ·mol-1 4、在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)=2CO2(g);△H=-566KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890KJ/mol
由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧时,释放的热量为( )
A.2912KJ B.2953KJ
C.3236KJ D.3867KJ BD高考分析
反应热在教材中的篇幅较少,高考内容主要包括:
1.书写热化学方程式或判断热化学方程式的正误;
2.有关反应热的计算;
3.比较反应热的大小教学目标:
1.使学生理解反应热的涵义.
2.使学生掌握热化学方程式的书写和应用.
3.培养学生的自学能力.灵活运用知识分析问题的能力
重点:反应热的涵义,热化学方程式的书写和应用.
难点: △H的“+”与“-”;热化学方程式的书写化学反应中的能量的变化反应热含义与键能的关系表示
方法种类单位:kJ/mol符号:△H燃烧热中和热热化学方程式意义书写方法有关计算再见
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B[练习] 2、下列变化中,属于吸热反应的是( )
A.氨催化氧化生成NO
B.酸碱中和
C.酯化反应
D.焦炭与高温水蒸气反应 D[练习] 3.下列变化中,属于吸热反应的是( )
①液氨气化②将胆矾加热变为白色粉末③稀释浓硫酸④氨催化氧化生成NO⑤氯酸钾分解制O2⑥酸碱中和生成水⑦氯化铁溶于水显酸性
A.②⑤⑦ B.①③④
C.①②⑤ D.③④⑥A[练习] 4.下列变化过程中会吸收热量的是( )
①硝酸铵溶于水②物质的燃烧③苛性钠溶于水④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③
C.仅②④ D.②③④A当ΔH <0时,为放热反应
表示反应体系给出能量,反应体系的能量降低。 当ΔH >0时,为吸热反应
表示反应体系获得能量,反应体系的能量升高。1.概念:反应过程中放出或吸收的热量。 一.反应热2 .表示方法:用符号ΔH 表示,单位kJ/mol许多化学反应的反应热可以直接测量,其测量仪器叫做量热计反应中为什么会有能量的变化?微观:断键、成键作用;宏观:能量守恒作用.反应热的微观探讨△H=436KJ/mol +243KJ/mol-2×(431KJ/mol)
= -183KJ/mol 吸收436
kJ/mol ΔH=436 + 243 —2×431 = —183kJ/mol放出431
kJ/mol吸收243
kJ/mol 化学反应的本质:
反应物中旧化学键的断裂和生成物中新化学键的形成。前者需要吸热而后者要放出热量。 3、能量守恒: 反应物 生成物 ↓ 具有的能量E反应物 具有的能量E生成物 ↓ 若E反应物 >E生成物 则反应放热;△H< 0若E反应物
当ΔH为“ + ”或ΔH>0时,为吸热反应。[练习] (1)已知:H + H ═ H2;△H=-436kJ/mol,则下列叙述正确的是( )
A.H原子的能量高于H2的能量
B.H原子的能量低于H2的能量
C.H原子比H2分子稳定
D.H2分子比H原子稳定A D(2)已知键能:
N≡N △H=-946kJ/mol,
H-H △H=-436kJ/mol,
H-N △H=-391kJ/mol,
从理论上计算反应
N2(g) +3H2(g) 2NH3(g)的△H为( ) A.+1800kJ/mol B.+92kJ/mol C.-92kJ/mol D.-46kJ/mol C[练习] (3)下列叙述正确的是( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量A、C二、热化学方程式 1、定义:表明反应所放出或吸收的热量的化学方程式 。 反应放出或吸收的热量的多少与外界的温度和压强有关,所以需要注明反应的温度与压强,1)要注明温度和压强: 2、书写热化学方程式应注意的几点 不注明时指的是101kPa和25℃时的数据。因为物质的聚集状态不同所含的能量也不同。 固态 液态吸热气态吸热吸热2)反应物和生成物要注明聚集状态:∴H2O(l)═H2O(g);△H=+44kJ/mol 3)热化学方程式中各物质前的化学计量数表示的是物质的物质的量而不表示分子个数,因而必要时可用分数。一般出现分数时是以某一反应物或生成物为“1mol”时,其它物质才出现的。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol 2H2 (g) + O2(g)=2H2O(l);△H=-571.6kJ/mol4) △H的表示:
热化学方程式中的△H一定要注明“+”与“-” , “-”代表放热 ,“+”代表吸热。
特别注意:无论热化学方程式中各物质的化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的计量数成正比例。方程式与反应热之间用“;”隔开。3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或
吸收的热量。质→量→能[例]1、写出下列反应的热化学方程式(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量 C(s)+H2O(g)=CO(g)+H2(g);△H=+131.3kJ/mol(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态), 放出78.5 kJ的热量 2Cu(s)+O2(g)=2CuO(s); △H=-314kJ/mol[例]2、2.00gC2H2完全燃烧生成液态水和CO2放出的热量为99.6kJ,则C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);
△H=-2589.6kJ/mol练习3:(2003·江苏)已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g) ;
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l) ;
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l) ;
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l) ;
△H= - 48.40kJ·mol -1BB4.已知:C(s)+O2(g) = CO2(g);ΔH=-393.5 kJ/mol,
2H2(g)+O2(g) = 2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为( )
A.1∶1 B.1∶2
C.2∶3 D.3∶2A5、298K,101kPa时,合成氨反应的热化学方程式N2(g)+3H2(g)=2NH3(g);
△H=-92.38kJ/mol。
在该温度下,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么? 该反应是可逆反应,在密闭容器中进行该反应将达到平衡状态, 1 mol N2(g)和3 mol H2(g)不能完全反应生成2 mol NH3(g),因而放出的热量总小于92.38kJ三、盖斯定律及其应用
C COΔH1
ΔH2ΔH3 CO2ΔH3=ΔH1 + ΔH2 盖斯定律——化学反应不管是一步完成还是分几步完成,其反应热是相同的。C(s)+ O2(g)═ CO2(g);
△H=-393.5KJ/mol ①①-②得:同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知:P4(s、白磷)+5O2(g)=P4O10(s); = -2983.2 kJ/molP(s、红磷)+5/4O2(g)=1/4P4O10(s); = -738.5kJ/mol试写出白磷转化为红磷的热化学方程式_____________________。练习2、铝在纯氧中燃烧,每生成1gAl2O3(固)放出QkJ热量,写出其热化学方程式 4Al(s)+3O2(g)=2Al2O3(s) ;ΔH=-204QkJ·mol-11、将12.7克固态碘与氢气完全反应生成碘化氢气体时,必须吸收2.604千焦的热量,其热化学方程式为 I2(s)+H2(g)=2HI(g); △H=+52.08KJ/molA3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A. H2O(g)=H2(g)+1/2O2(g); ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(l);
ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g); ΔH=+242kJ·mol-1
2H2(g)+O2(g)=2H2O(g);
ΔH=+484kJ·mol-1 4、在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g)+O2(g)=2CO2(g);△H=-566KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);
△H=-890KJ/mol
由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧时,释放的热量为( )
A.2912KJ B.2953KJ
C.3236KJ D.3867KJ BD高考分析
反应热在教材中的篇幅较少,高考内容主要包括:
1.书写热化学方程式或判断热化学方程式的正误;
2.有关反应热的计算;
3.比较反应热的大小教学目标:
1.使学生理解反应热的涵义.
2.使学生掌握热化学方程式的书写和应用.
3.培养学生的自学能力.灵活运用知识分析问题的能力
重点:反应热的涵义,热化学方程式的书写和应用.
难点: △H的“+”与“-”;热化学方程式的书写化学反应中的能量的变化反应热含义与键能的关系表示
方法种类单位:kJ/mol符号:△H燃烧热中和热热化学方程式意义书写方法有关计算再见
