碳族章节复习全[下学期]
图片预览








文档简介
课件26张PPT。碳族元素
专题复习思考题:
BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在GBO中,锗处于其最高价态 ②在GBO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构 ③GBO可看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在GBO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空: (1)锗和铋的元素符号分别是 和 。 (2)GBO晶体的化学式是 。 (3)GBO晶体中所含铋氧化物的化学式是 。碳、硅思考并回答:
1. 碳族元素在元素周期表中的
位置及其名称和元素符号
2. 碳族元素的结构特点和性
质相似性及递变性的关系.
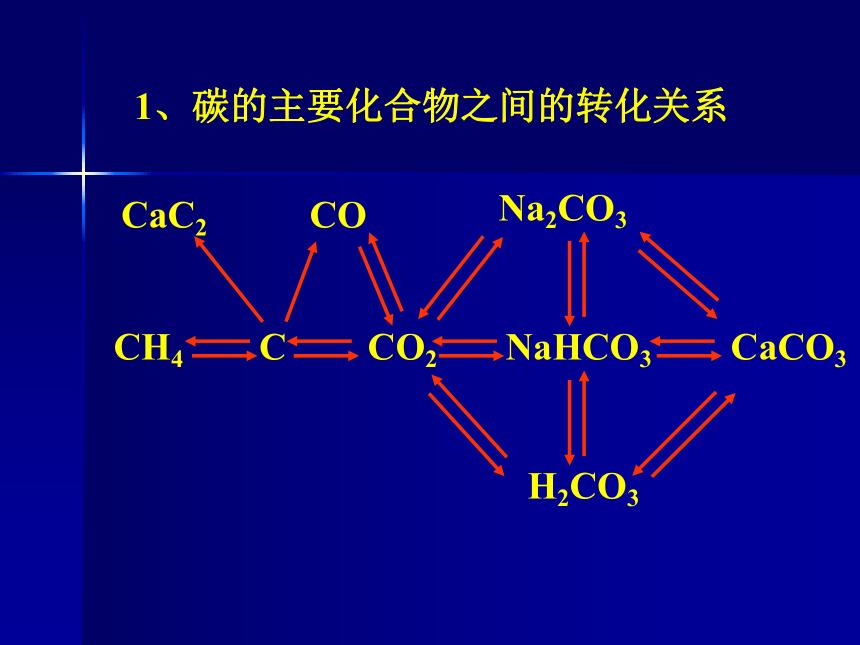
碳族元素特点:1、形成化合物最多的一族2、单质晶体类型最多的一族分子晶体、原子晶体、金属晶体,过渡晶体3、易形成共价化合物一族4、半导体比较集中的一族5、无机非金属材料比较集中的一族1、碳的主要化合物之间的转化关系 2、碳单质 金刚石:原子晶体,无色透明固体,很高的熔 沸点和硬度,不导电。C60: 分子晶体,熔沸点低。 (1)物理性质:无定性碳: 非晶体,黑色固体,吸附性。 (2)化学性质:a. 较强的还原性 (加热或点燃)
与O2;H2O;HNO3;CuO等的反应b.较弱的氧化性:(常温下化学性质稳定)还原性:Si>C 一氧化碳 二氧化碳无色无味难溶于水
的剧毒气体。类属:不成盐氧化物价态:较强还原性无色无味可溶于水
的气体。类属:酸性氧化物价态:较弱的氧化性CO2+2OH-==CO32-+H2OCO2+Na2O==Na2CO3CO2+2Mg==C+2MgOCO2 + C == 2COCO+CuO==CO2+CuCO+FeO==CO2+Fe制法:用途:燃料、还原剂
化工原料用途:灭火剂、致冷剂、
人工降雨、饮料、制纯碱
尿素CO制法:实验室:工业:CO2制法:实验室:CaCO3+2HCl=CO2 ↑ +CaCl2 工业:3、含氧酸及盐 碳酸 碳酸盐 碳酸酸式盐主要物
理性质 只存在于
水溶液中 不大多溶于
水的固体 大多溶于
水的固体 主要化
学性质 酸性
(二元弱酸)受热分解与酸反应酸反应受热分解受热分解沉淀反应与碱反应规律:1、稳定性(多元弱酸) 正盐>酸式盐>酸特例:溶解度 Na2CO3> NaHCO32、溶解度 酸式盐>正盐与二.硅及其化合物思考如何证明碳酸是弱电解质?二、硅及其化合物 与氟气反应与氯气反应与氧气反应Si + 4HF==2H2 + SiF4 ↑与氢氟酸反应Si + 2NaOH + H2O== Na2SiO3 + 2H2 ↑ 与氢氧化钠溶液反应1、硅单质(化学性质不活泼)纯硅的制法:二、硅及其化合物 与氟气反应与氯气反应与氧气反应Si + 4HF==2H2 + SiF4 ↑与氢氟酸反应Si + 2NaOH + H2O== Na2SiO3 + 2H2 ↑ 与氢氧化钠溶液反应1、硅单质(化学性质不活泼)纯硅的制法:2、硅:(工业制备原理方法与步骤) 二
氧
化
硅粗
硅粗
四
氯
化
硅纯
四
氯
化
硅高
纯
硅i、跟碱及碱性氧化物反应 SiO2 +2NaOH==Na2SiO3 +H2O
(实验室里盛放碱液的试剂瓶常用橡皮塞,而不用玻璃塞。)
ii、跟炭反应 SiO2 +2C==Si +2CO
iii、跟碳酸盐起反应 SiO2 + CaCO3 == CaSiO3 + CO2
iv、跟氢氟酸反应 SiO2 + 4HF==SiF4 + 2H2O
(氢氟酸用塑料瓶装,不能用玻璃瓶装)晶体(石英、水晶)——结构与金刚石相似
非晶体(硅藻土)(2)化学性质 SiO2化学性质:(a)常温与氢氟酸(SiO2很不活泼,HF是惟一 能跟其反应的酸)4HF+SiO2==SiF4↑+2H2O(b)酸性氧化物:不溶于水,也不与水反应。2NaOH+SiO2==Na2SiO3+H2O与强碱反应:
与碱性氧化物反应:(不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。) 常用于雕刻玻璃
HF不能存放于玻璃瓶练习:请分别写出CO2、SiO2与H2O、CaO、Na2O、Ca(OH)2反应的化学方程式。CO2+H2O=H2CO3 SiO2+H2O=不反应
CO2+Na2O=Na2CO3 SiO2+Na2O=Na2SiO3
CO2+CaO=CaCO3 SiO2+CaO=CaSiO3
CO2+Ca(OH)2=CaCO3+H2O
SiO2+Ca(OH)2=CaSiO3+H2O
水晶(电子工业、光学仪器和工艺品);二氧化硅(光导纤维、石英玻璃);石英砂(玻璃原料、建筑材料)四、硅酸和硅酸盐硅酸不溶于水,是一种酸,它的酸性比碳酸还要弱。Na2SiO3 + 2HCl+H2O == 2NaCl +H4SiO4 硅酸盐可以用金属氧化物的形式表示。
高岭石 Al2(Si2O5)(OH)4正长石 KAlSi3O8(3)用途:石英、玛瑙、水晶硅酸钠 Na2SiO3三、硅酸(H2SiO3)(2)制取:Na2SiO3+2HCl=2NaCl+H2SiO3↓白色胶状强酸制弱酸(1)性质:① 白色胶状,难溶② 弱酸性(酸性 H2SiO3 < H2CO3)③ 脱水形成硅胶Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(用作干燥剂)实验4-1原理练习强酸弱酸复分解反应制酸一般规律:较强酸制取较弱酸,弱酸不能制取强酸。怎样证明?四.硅酸(H2SiO3)思考:1.二氧化硅不溶于水,不跟水反应,如何从二氧化硅来制备H2SiO3是一种很弱的酸,比碳酸的酸性还弱Na2SiO3+2HCl=2NaCl+H2SiO3↓实验4-1Na2SiO3(aq)中滴入酚酞变红色,慢慢滴入HCl(aq),有絮状沉淀生成,红色消失Na2SiO3(aq)显碱性,H2SiO3酸性很弱,几乎不溶于水。强酸弱酸复分解反应制酸一般规律:较强酸制取较弱酸,弱酸不能制取强酸。如:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓说明碳酸酸性比硅酸强 练习4、硅酸盐工业(1)玻璃石灰石、纯碱、二氧化硅原料Na2SiO3 、CaSiO3 、SiO2原理主要成份种类用途 普通玻璃、石英玻璃、钢化玻璃(2)水泥 原料 主要过程 主要成份 性能用途 粘土、石灰石、填加料原料的粉碎和混合
生料的高温融烧
熟料的粉碎硅酸二钙 、硅酸三钙、 铝酸三钙水硬性、建筑材料、钢筋混凝土 无机非金属材料 材 料金属材料 高分子材料 传统非金属材料 新型无机非金属材料 新型无机非金属材料:超导材料、光导纤维、高温结构材料硅酸盐材料:水泥、玻璃、陶瓷陶瓷:土器、瓷器、炻器课堂练习1、CO2通入下列各溶液中,不可能产生沉淀的是( )
A、 Na2SiO3 B、石灰水
C、饱和Na2CO3 D、CaCl2D 1、制造光导纤维的主要原料是( )
A.晶体硅 B.二氧化硅 C.石墨 D.硅酸钠
2、下列各组物质有关性质关系的比较,正确的是( )
A.稳定性:CO2 > SiO2B.酸性:H2SiO3 > H2CO3
C.熔点:SiO2 > CO2(干冰) D.导电能力:Si > Cu
3、下列物质中,不能用玻璃瓶来盛装的是( )
A.烧碱溶液 B.浓硫酸 C.氢氟酸 D.碳酸钠溶液
4、要除去SiO2中的CaO杂质,最适宜的试剂是( )
A.纯碱溶液 B 盐酸 C 硫酸 D 苛性钠溶液
5、加热熔融烧碱时应使用下列哪种坩埚( )
A.石英坩埚 B.普通玻璃坩埚 C.铁坩埚 D.陶瓷坩埚BCCBC7、把下列式子改写成氧化物的形式:
A、正长石KAlSi3O8___________________。
B、石棉CaMg3Si4O12____________________。
C、蛇纹石H4Mg3Si2O9_________________。K2O·2Al2O3·6SiO2CaO·3MgO·4SiO23MgO·2SiO2·2H2O6、下列离子方程式中,书写正确的是( )
A、硅酸和氢氧化钾溶液反应:
H2SiO3+2OH-=SiO32-+2H2O
B、铝和氢氧化钠溶液反应:
Al+2OH-+H2O=AlO2-+2H2↑
C、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+CO2↑
D、饱和碳酸钠溶液中通入过量的CO2:
CO32-+H2O+CO2=2HCO3-A好好学习天天向上
专题复习思考题:
BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:①在GBO中,锗处于其最高价态 ②在GBO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构 ③GBO可看作是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在GBO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空: (1)锗和铋的元素符号分别是 和 。 (2)GBO晶体的化学式是 。 (3)GBO晶体中所含铋氧化物的化学式是 。碳、硅思考并回答:
1. 碳族元素在元素周期表中的
位置及其名称和元素符号
2. 碳族元素的结构特点和性
质相似性及递变性的关系.
碳族元素特点:1、形成化合物最多的一族2、单质晶体类型最多的一族分子晶体、原子晶体、金属晶体,过渡晶体3、易形成共价化合物一族4、半导体比较集中的一族5、无机非金属材料比较集中的一族1、碳的主要化合物之间的转化关系 2、碳单质 金刚石:原子晶体,无色透明固体,很高的熔 沸点和硬度,不导电。C60: 分子晶体,熔沸点低。 (1)物理性质:无定性碳: 非晶体,黑色固体,吸附性。 (2)化学性质:a. 较强的还原性 (加热或点燃)
与O2;H2O;HNO3;CuO等的反应b.较弱的氧化性:(常温下化学性质稳定)还原性:Si>C 一氧化碳 二氧化碳无色无味难溶于水
的剧毒气体。类属:不成盐氧化物价态:较强还原性无色无味可溶于水
的气体。类属:酸性氧化物价态:较弱的氧化性CO2+2OH-==CO32-+H2OCO2+Na2O==Na2CO3CO2+2Mg==C+2MgOCO2 + C == 2COCO+CuO==CO2+CuCO+FeO==CO2+Fe制法:用途:燃料、还原剂
化工原料用途:灭火剂、致冷剂、
人工降雨、饮料、制纯碱
尿素CO制法:实验室:工业:CO2制法:实验室:CaCO3+2HCl=CO2 ↑ +CaCl2 工业:3、含氧酸及盐 碳酸 碳酸盐 碳酸酸式盐主要物
理性质 只存在于
水溶液中 不大多溶于
水的固体 大多溶于
水的固体 主要化
学性质 酸性
(二元弱酸)受热分解与酸反应酸反应受热分解受热分解沉淀反应与碱反应规律:1、稳定性(多元弱酸) 正盐>酸式盐>酸特例:溶解度 Na2CO3> NaHCO32、溶解度 酸式盐>正盐与二.硅及其化合物思考如何证明碳酸是弱电解质?二、硅及其化合物 与氟气反应与氯气反应与氧气反应Si + 4HF==2H2 + SiF4 ↑与氢氟酸反应Si + 2NaOH + H2O== Na2SiO3 + 2H2 ↑ 与氢氧化钠溶液反应1、硅单质(化学性质不活泼)纯硅的制法:二、硅及其化合物 与氟气反应与氯气反应与氧气反应Si + 4HF==2H2 + SiF4 ↑与氢氟酸反应Si + 2NaOH + H2O== Na2SiO3 + 2H2 ↑ 与氢氧化钠溶液反应1、硅单质(化学性质不活泼)纯硅的制法:2、硅:(工业制备原理方法与步骤) 二
氧
化
硅粗
硅粗
四
氯
化
硅纯
四
氯
化
硅高
纯
硅i、跟碱及碱性氧化物反应 SiO2 +2NaOH==Na2SiO3 +H2O
(实验室里盛放碱液的试剂瓶常用橡皮塞,而不用玻璃塞。)
ii、跟炭反应 SiO2 +2C==Si +2CO
iii、跟碳酸盐起反应 SiO2 + CaCO3 == CaSiO3 + CO2
iv、跟氢氟酸反应 SiO2 + 4HF==SiF4 + 2H2O
(氢氟酸用塑料瓶装,不能用玻璃瓶装)晶体(石英、水晶)——结构与金刚石相似
非晶体(硅藻土)(2)化学性质 SiO2化学性质:(a)常温与氢氟酸(SiO2很不活泼,HF是惟一 能跟其反应的酸)4HF+SiO2==SiF4↑+2H2O(b)酸性氧化物:不溶于水,也不与水反应。2NaOH+SiO2==Na2SiO3+H2O与强碱反应:
与碱性氧化物反应:(不能用磨口玻璃塞盛碱性溶液,如NaOH、KOH、Na2CO3、Na2SiO3等溶液。) 常用于雕刻玻璃
HF不能存放于玻璃瓶练习:请分别写出CO2、SiO2与H2O、CaO、Na2O、Ca(OH)2反应的化学方程式。CO2+H2O=H2CO3 SiO2+H2O=不反应
CO2+Na2O=Na2CO3 SiO2+Na2O=Na2SiO3
CO2+CaO=CaCO3 SiO2+CaO=CaSiO3
CO2+Ca(OH)2=CaCO3+H2O
SiO2+Ca(OH)2=CaSiO3+H2O
水晶(电子工业、光学仪器和工艺品);二氧化硅(光导纤维、石英玻璃);石英砂(玻璃原料、建筑材料)四、硅酸和硅酸盐硅酸不溶于水,是一种酸,它的酸性比碳酸还要弱。Na2SiO3 + 2HCl+H2O == 2NaCl +H4SiO4 硅酸盐可以用金属氧化物的形式表示。
高岭石 Al2(Si2O5)(OH)4正长石 KAlSi3O8(3)用途:石英、玛瑙、水晶硅酸钠 Na2SiO3三、硅酸(H2SiO3)(2)制取:Na2SiO3+2HCl=2NaCl+H2SiO3↓白色胶状强酸制弱酸(1)性质:① 白色胶状,难溶② 弱酸性(酸性 H2SiO3 < H2CO3)③ 脱水形成硅胶Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(用作干燥剂)实验4-1原理练习强酸弱酸复分解反应制酸一般规律:较强酸制取较弱酸,弱酸不能制取强酸。怎样证明?四.硅酸(H2SiO3)思考:1.二氧化硅不溶于水,不跟水反应,如何从二氧化硅来制备H2SiO3是一种很弱的酸,比碳酸的酸性还弱Na2SiO3+2HCl=2NaCl+H2SiO3↓实验4-1Na2SiO3(aq)中滴入酚酞变红色,慢慢滴入HCl(aq),有絮状沉淀生成,红色消失Na2SiO3(aq)显碱性,H2SiO3酸性很弱,几乎不溶于水。强酸弱酸复分解反应制酸一般规律:较强酸制取较弱酸,弱酸不能制取强酸。如:Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓说明碳酸酸性比硅酸强 练习4、硅酸盐工业(1)玻璃石灰石、纯碱、二氧化硅原料Na2SiO3 、CaSiO3 、SiO2原理主要成份种类用途 普通玻璃、石英玻璃、钢化玻璃(2)水泥 原料 主要过程 主要成份 性能用途 粘土、石灰石、填加料原料的粉碎和混合
生料的高温融烧
熟料的粉碎硅酸二钙 、硅酸三钙、 铝酸三钙水硬性、建筑材料、钢筋混凝土 无机非金属材料 材 料金属材料 高分子材料 传统非金属材料 新型无机非金属材料 新型无机非金属材料:超导材料、光导纤维、高温结构材料硅酸盐材料:水泥、玻璃、陶瓷陶瓷:土器、瓷器、炻器课堂练习1、CO2通入下列各溶液中,不可能产生沉淀的是( )
A、 Na2SiO3 B、石灰水
C、饱和Na2CO3 D、CaCl2D 1、制造光导纤维的主要原料是( )
A.晶体硅 B.二氧化硅 C.石墨 D.硅酸钠
2、下列各组物质有关性质关系的比较,正确的是( )
A.稳定性:CO2 > SiO2B.酸性:H2SiO3 > H2CO3
C.熔点:SiO2 > CO2(干冰) D.导电能力:Si > Cu
3、下列物质中,不能用玻璃瓶来盛装的是( )
A.烧碱溶液 B.浓硫酸 C.氢氟酸 D.碳酸钠溶液
4、要除去SiO2中的CaO杂质,最适宜的试剂是( )
A.纯碱溶液 B 盐酸 C 硫酸 D 苛性钠溶液
5、加热熔融烧碱时应使用下列哪种坩埚( )
A.石英坩埚 B.普通玻璃坩埚 C.铁坩埚 D.陶瓷坩埚BCCBC7、把下列式子改写成氧化物的形式:
A、正长石KAlSi3O8___________________。
B、石棉CaMg3Si4O12____________________。
C、蛇纹石H4Mg3Si2O9_________________。K2O·2Al2O3·6SiO2CaO·3MgO·4SiO23MgO·2SiO2·2H2O6、下列离子方程式中,书写正确的是( )
A、硅酸和氢氧化钾溶液反应:
H2SiO3+2OH-=SiO32-+2H2O
B、铝和氢氧化钠溶液反应:
Al+2OH-+H2O=AlO2-+2H2↑
C、碳酸氢钙溶液跟稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+CO2↑
D、饱和碳酸钠溶液中通入过量的CO2:
CO32-+H2O+CO2=2HCO3-A好好学习天天向上
同课章节目录
