高1化学第6章单元复习[下学期]
图片预览


文档简介
(共19张PPT)
复习课
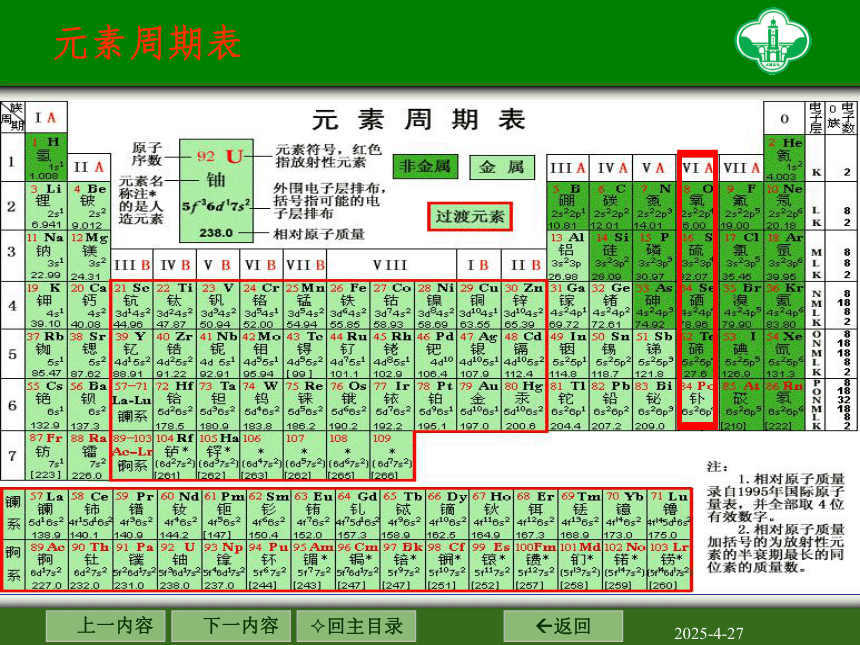
元素周期表
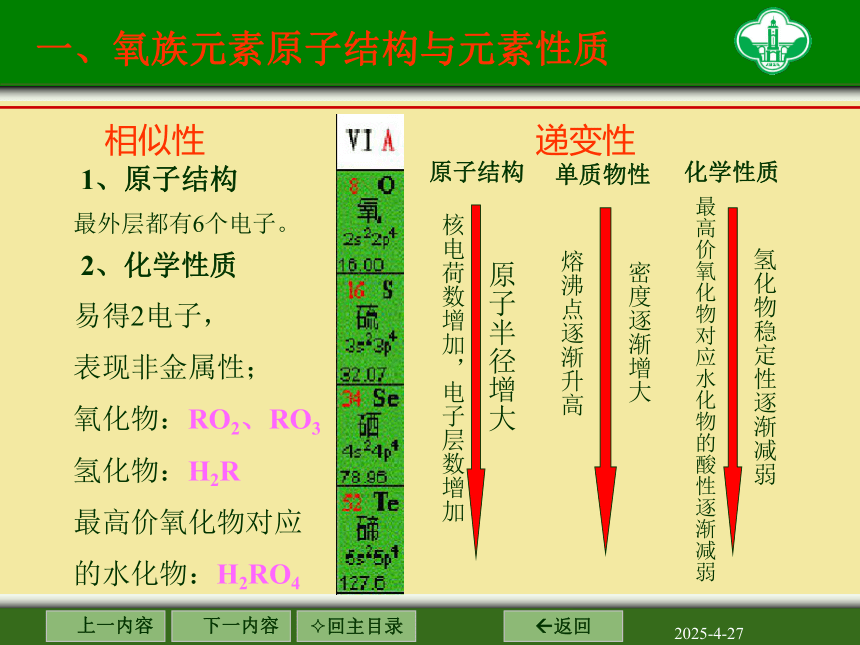
相似性
递变性
1、原子结构
最外层都有6个电子。
2、化学性质
原子结构
单质物性
化学性质
核电荷数增加,电子层数增加
原子半径增大
熔沸点逐渐升高
密度逐渐增大
氢化物稳定性逐渐减弱
最高价氧化物对应水化物的酸性逐渐减弱
一、氧族元素原子结构与元素性质
易得2电子,
表现非金属性;
氧化物:RO2、RO3
氢化物:H2R
最高价氧化物对应
的水化物:H2RO4
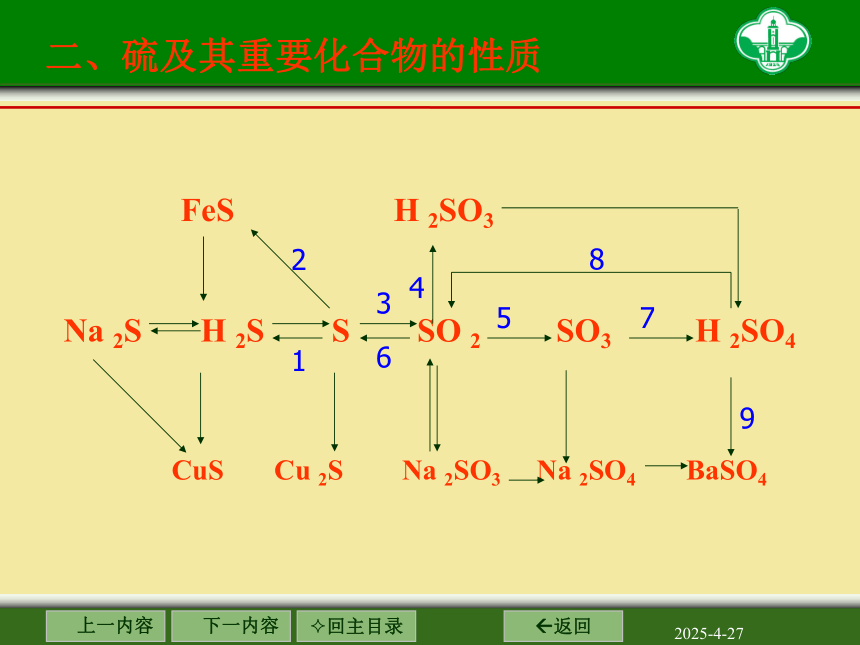
FeS H 2SO3
Na 2S H 2S S SO 2 SO3 H 2SO4
CuS Cu 2S Na 2SO3 Na 2SO4 BaSO4
1
2
3
4
6
5
7
9
8
二、硫及其重要化合物的性质
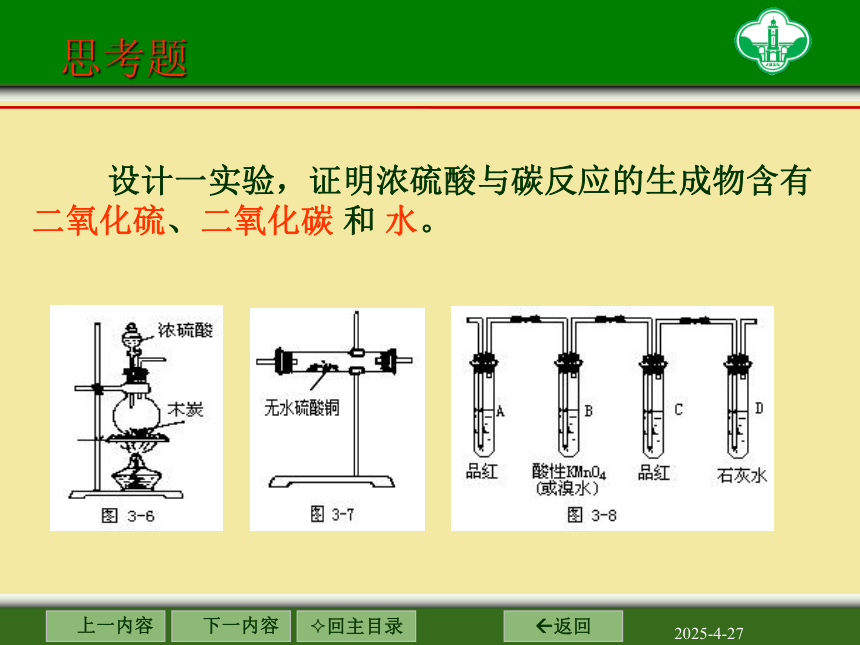
思考题
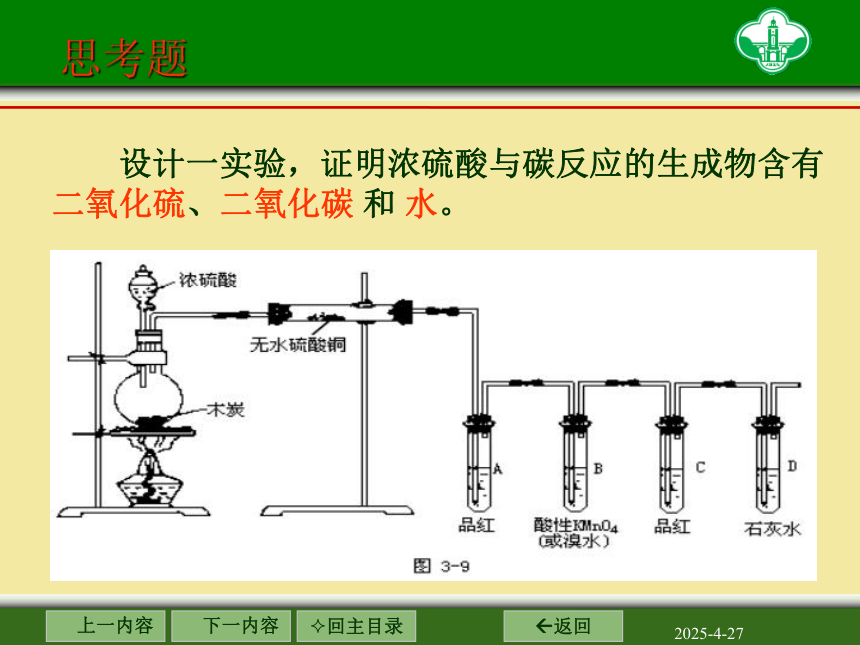
设计一实验,证明浓硫酸与碳反应的生成物含有二氧化硫、二氧化碳 和 水。
思考题
设计一实验,证明浓硫酸与碳反应的生成物含有二氧化硫、二氧化碳 和 水。
无水硫酸铜
品红溶液
品红溶液
酸性高锰酸钾溶液
石灰水
证明含SO2
除去SO2
证明无SO2
证明含CO2
证明含水
思考题
变蓝色
褪色
褪色
不褪色
变浑浊
三位学生设计了三个方案,并都认为,如果观察到的现象
和自己设计的方案一致,即可确证试液中有SO42-
方案甲:试液 白色 沉淀不溶解
方案乙:试液 无沉淀 白色沉淀
方案丙:试液 无沉淀 白色沉淀
试评述上述三种方案是否严谨,并说明理由。
BaCl2溶液
足量稀盐酸
BaCl2溶液
足量稀盐酸
Ba(NO3)2溶液
足量稀硝酸
如有Ag+ ,会有AgCl白色沉淀生成,它不溶于水,不溶于酸。
先加盐酸无沉淀,排除Ag+的存在,再加BaCl2溶液,在
酸性溶液中生成白色沉淀,证明有SO42-。
如有SO32- , 会被硝酸氧化成SO42- ,加Ba(NO3)2溶液生成
白色沉淀。
最佳方案
三、同素异形体
同素异形体:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
金刚石
石墨
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。强调是原子间的互称,如 。
同素异形体是由同一种元素形成的几种性质不同的单质。强调是特定物质单质间的互称,如O2和O3,金刚石和石墨等。
四、过氧化氢
物理性质:无色粘稠液体,水溶液俗称双氧水。
化学性质:弱酸性、氧化性、还原性、不稳定性
2H2O2 2H2O + O2 ↑
MnO2
用途:氧化剂、漂白剂、消毒剂、
实验室制取氧气。
1.臭氧的物理性质:
特殊臭味的淡蓝色气体,密度比空气大,比氧气易溶于水,液态呈深蓝色,固态呈紫黑色,熔沸点比空气、氧气高。
2.臭氧的化学性质:
(1) 2O3=3O2
(2)极强的氧化性,可氧化 Ag、 Hg等
用于漂白,消毒。
3.空气中的臭氧与臭氧层
3O2放电2O3
五、臭氧小结
1.对氧、硫、硒、碲四种元素,下列说法中不正确的是( )
(A)最外层电子数相等
(B)原子半径依次增大
(C)由于核电荷数增大,核对最外层电子引力也依次增大
(D)阳离子的还原性依次增大
C
课堂练习
课堂练习
2.下列关于硒的叙述中,不正确的是( )(A)硒可以跟钠组成化合物Na2Se
(B)硒化氢的水溶液呈强酸性
(C)亚硒酸是一种中强酸
(D)硒化氢在空气中燃烧生成二氧化硒
B
3.下列氢化物的还原性由强到弱排列顺序中,正确的是( )
(A)H2Se > H2S > HI > HBr > HCl
(B)H2S > H2Se > HI > HBr > HCl
(C)HI > HBr > HCl > H2S > H2Se
(D)H2Se > H2S > HCl > HBr > HI
A
课堂练习
课堂练习
4﹑下列离子方程式正确的是( )
硫化亚铁和稀硫酸的反应:S2-+2H+=H2S
B. 澄清石灰水与盐酸的反应:OH- + H + =H2O
C. 氢氧化钡溶液与稀硫酸的反应:
Ba2++OH—+H++SO42 -=BaSO4 +H2O
D.碳酸氢钙溶液和足量的氢氧化钠溶液反应:
Ca2++HCO3- + OH- =CaCO3 +H2O
B
5.向50mL 18mol/L的硫酸中加入足量的铜片加热,充分反应后,被还原的硫酸是( )
A.小于0.45mol
B.0.45mol
C.介于0.45mol和0.90mol之间
D.大于0.90mol
A
课堂练习
课堂练习
6.路桥某工厂每天要烧掉含硫1.6%的烟煤10吨,排放出的SO2严重地污染环境。如果变废为宝,把这些SO2回收利用,那么,在理论上该厂每天可生产98%的浓硫酸多少吨?
解:设每天可生产98%的浓硫酸 x 吨
S ~ H2SO4
32 98
10t×1.6% x × 98%
解得: x = 0.5t
答:理论上该厂每天可生产98%的浓硫酸0.5吨。
复习课
元素周期表
相似性
递变性
1、原子结构
最外层都有6个电子。
2、化学性质
原子结构
单质物性
化学性质
核电荷数增加,电子层数增加
原子半径增大
熔沸点逐渐升高
密度逐渐增大
氢化物稳定性逐渐减弱
最高价氧化物对应水化物的酸性逐渐减弱
一、氧族元素原子结构与元素性质
易得2电子,
表现非金属性;
氧化物:RO2、RO3
氢化物:H2R
最高价氧化物对应
的水化物:H2RO4
FeS H 2SO3
Na 2S H 2S S SO 2 SO3 H 2SO4
CuS Cu 2S Na 2SO3 Na 2SO4 BaSO4
1
2
3
4
6
5
7
9
8
二、硫及其重要化合物的性质
思考题
设计一实验,证明浓硫酸与碳反应的生成物含有二氧化硫、二氧化碳 和 水。
思考题
设计一实验,证明浓硫酸与碳反应的生成物含有二氧化硫、二氧化碳 和 水。
无水硫酸铜
品红溶液
品红溶液
酸性高锰酸钾溶液
石灰水
证明含SO2
除去SO2
证明无SO2
证明含CO2
证明含水
思考题
变蓝色
褪色
褪色
不褪色
变浑浊
三位学生设计了三个方案,并都认为,如果观察到的现象
和自己设计的方案一致,即可确证试液中有SO42-
方案甲:试液 白色 沉淀不溶解
方案乙:试液 无沉淀 白色沉淀
方案丙:试液 无沉淀 白色沉淀
试评述上述三种方案是否严谨,并说明理由。
BaCl2溶液
足量稀盐酸
BaCl2溶液
足量稀盐酸
Ba(NO3)2溶液
足量稀硝酸
如有Ag+ ,会有AgCl白色沉淀生成,它不溶于水,不溶于酸。
先加盐酸无沉淀,排除Ag+的存在,再加BaCl2溶液,在
酸性溶液中生成白色沉淀,证明有SO42-。
如有SO32- , 会被硝酸氧化成SO42- ,加Ba(NO3)2溶液生成
白色沉淀。
最佳方案
三、同素异形体
同素异形体:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
金刚石
石墨
对比同素异形体和同位素
同位素指质子数相同、中子数不同的同一元素的不同原子。强调是原子间的互称,如 。
同素异形体是由同一种元素形成的几种性质不同的单质。强调是特定物质单质间的互称,如O2和O3,金刚石和石墨等。
四、过氧化氢
物理性质:无色粘稠液体,水溶液俗称双氧水。
化学性质:弱酸性、氧化性、还原性、不稳定性
2H2O2 2H2O + O2 ↑
MnO2
用途:氧化剂、漂白剂、消毒剂、
实验室制取氧气。
1.臭氧的物理性质:
特殊臭味的淡蓝色气体,密度比空气大,比氧气易溶于水,液态呈深蓝色,固态呈紫黑色,熔沸点比空气、氧气高。
2.臭氧的化学性质:
(1) 2O3=3O2
(2)极强的氧化性,可氧化 Ag、 Hg等
用于漂白,消毒。
3.空气中的臭氧与臭氧层
3O2放电2O3
五、臭氧小结
1.对氧、硫、硒、碲四种元素,下列说法中不正确的是( )
(A)最外层电子数相等
(B)原子半径依次增大
(C)由于核电荷数增大,核对最外层电子引力也依次增大
(D)阳离子的还原性依次增大
C
课堂练习
课堂练习
2.下列关于硒的叙述中,不正确的是( )(A)硒可以跟钠组成化合物Na2Se
(B)硒化氢的水溶液呈强酸性
(C)亚硒酸是一种中强酸
(D)硒化氢在空气中燃烧生成二氧化硒
B
3.下列氢化物的还原性由强到弱排列顺序中,正确的是( )
(A)H2Se > H2S > HI > HBr > HCl
(B)H2S > H2Se > HI > HBr > HCl
(C)HI > HBr > HCl > H2S > H2Se
(D)H2Se > H2S > HCl > HBr > HI
A
课堂练习
课堂练习
4﹑下列离子方程式正确的是( )
硫化亚铁和稀硫酸的反应:S2-+2H+=H2S
B. 澄清石灰水与盐酸的反应:OH- + H + =H2O
C. 氢氧化钡溶液与稀硫酸的反应:
Ba2++OH—+H++SO42 -=BaSO4 +H2O
D.碳酸氢钙溶液和足量的氢氧化钠溶液反应:
Ca2++HCO3- + OH- =CaCO3 +H2O
B
5.向50mL 18mol/L的硫酸中加入足量的铜片加热,充分反应后,被还原的硫酸是( )
A.小于0.45mol
B.0.45mol
C.介于0.45mol和0.90mol之间
D.大于0.90mol
A
课堂练习
课堂练习
6.路桥某工厂每天要烧掉含硫1.6%的烟煤10吨,排放出的SO2严重地污染环境。如果变废为宝,把这些SO2回收利用,那么,在理论上该厂每天可生产98%的浓硫酸多少吨?
解:设每天可生产98%的浓硫酸 x 吨
S ~ H2SO4
32 98
10t×1.6% x × 98%
解得: x = 0.5t
答:理论上该厂每天可生产98%的浓硫酸0.5吨。
同课章节目录
