氧族复习[下学期]
图片预览




文档简介
课件16张PPT。 第六章 硫和硫的化合物知识目标:1、复习和巩固硫及其化合物的知识
2、了解二氧化硫的性质、用途
3、掌握浓硫酸的性质及硫酸根离子的检验能力目标: 1、培养学生实验设计能力
2、培养学生应用知识解决问题的能力
3、培养学生变通意识重点和难点:1、二氧化硫、浓硫酸的化学性质
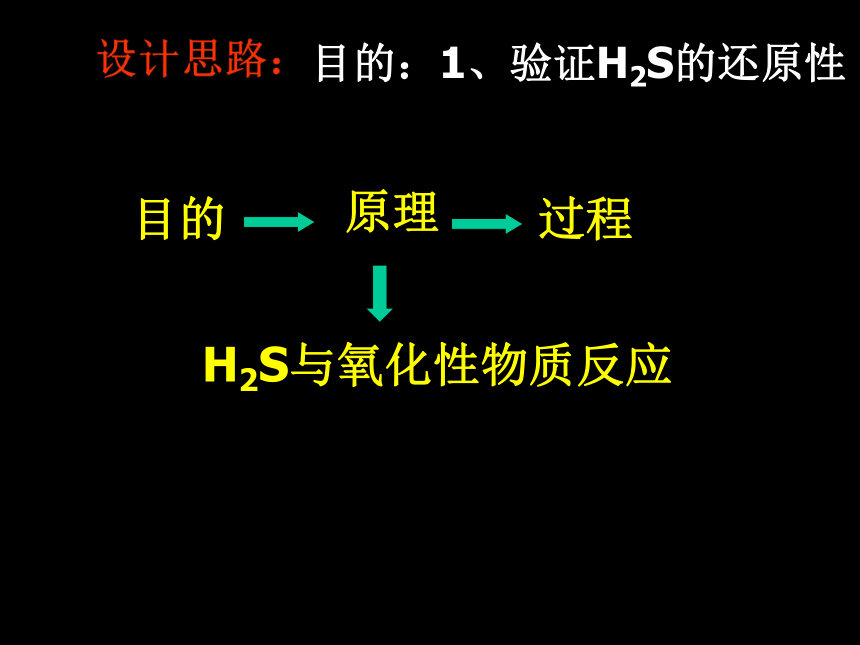
2、硫酸根离子的检验根据我们在第六章所学的知识设计实验目的:1、验证H2S的还原性
2、验证SO2的酸性、氧化性、还原性、漂白性
3、验证浓硫酸的特性
4、SO42-离子的检验
药品:FeS及其它任意不含S的试剂或物质
仪器:任意
要求:设计思路体现知识的网络化 提示: 1、实验设计思路:目的—原理——过程
2、前面生成的物质可以做为后面的反应物
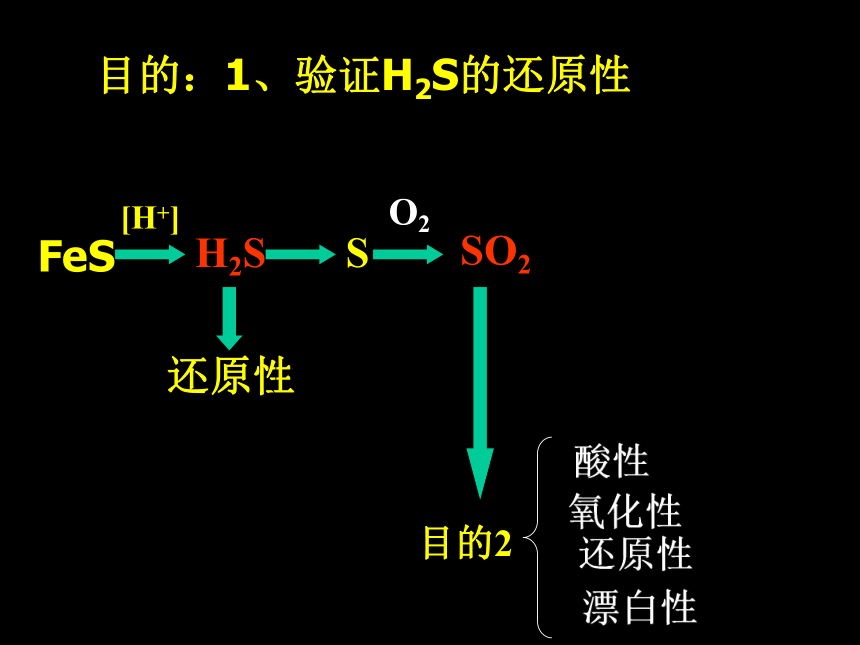
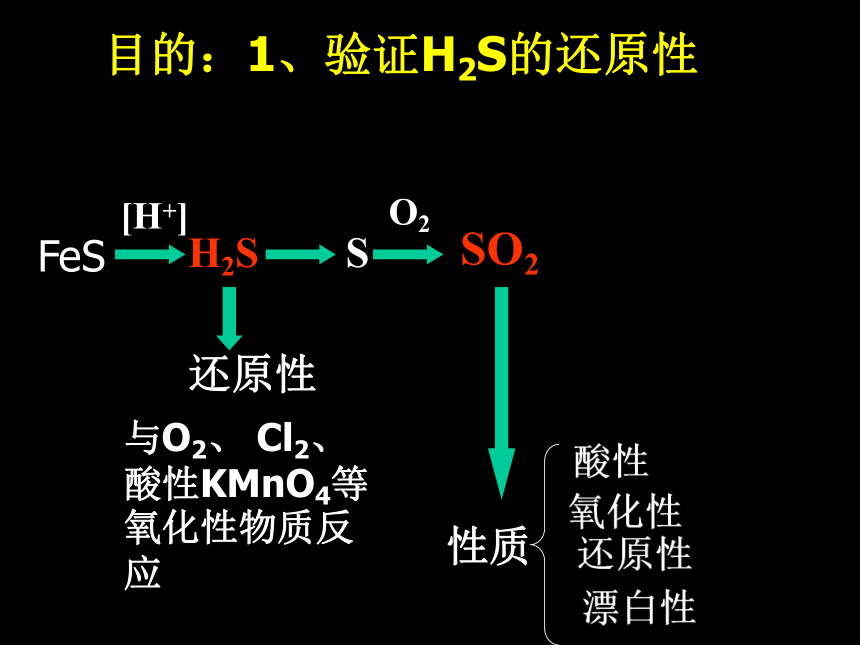
3、忽略具体仪器,只考虑知识过程目的:1、验证H2S的还原性目的H2S与氧化性物质反应设计思路:目的:1、验证H2S的还原性2H2S +O2H2S +Cl22H2S +3O2=2H2O +2S=2H2O +SO2=2HCl +SH2S还原性与O2, Cl2, 酸性KMnO4等氧化性物质反应SSO2目的2目的:1、验证H2S的还原性FeS[H+]H2S还原性O2与O2、 Cl2、酸性KMnO4等氧化性物质反应SSO2性质O2目的:1、验证H2S的还原性SO2氧化性的验证:SO2还原性的验证:如O2、 Cl2、 酸性KMnO4等如 H2S和还原性物质反应和氧化性性物质反应FeS[H+]H2S还原性O2与O2、Cl2、酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2品红目的3
目的4FeS[H+]H2S还原性O2与O2、 Cl2、 酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2H2SO4品红FeS[H+]H2S还原性O2与O2、 Cl2、酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2H2SO4H2O特性脱水性吸水性强氧化性蔗糖五水硫酸铜铜和碳SO42-离子的检验品红FeS[H+]H2S还原性O2与O2、 Cl2、 酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2H2SO4H2O特性脱水性吸水性强氧化性蔗糖无水硫酸铜铜和碳SO42-离子的检验品红评述上述方案是否严密,并说明理由.√有一包粉末,其中可能有Na2CO3、NaCl、K2SO4、CuCl2、K2CO3、BaCl2、Na2SO4。现按下列步骤进行实验:(1)将粉末加入水中,得无色溶液 和白色沉淀,过滤。(2)取滤液做焰色反应,火焰呈黄色,隔蓝色钴玻璃观察,未见淡紫色。(3)将滤出的沉淀置于试管中加入稀HNO3,有无色气体生成,沉淀 部分溶解。
结论:一定有的物质: 。
一定不含有的物质: 。
尚不肯定的物质: 。 BaCl2、Na2SO4 Na2CO3CuCl2、K2CO3 K2SO4 NaCl 为除去CO2气体中混有的少量杂质SO2气体,应选用的试剂是( ).
A、饱和Na2SO3溶液
B、饱和NaHCO3溶液
C、饱和NaOH溶液
D、饱和Na2CO3溶液B 已知A是一种有刺激性气味的无色气体,能使品红试液褪色;B是一种黄绿色气体;E、F均为不溶于水也不溶于酸的白色固体。下图是几种物质间相互转化的关系。 气体B气体AC和D的无色溶液等物质的量在水溶液中反应滴入Ba(OH)2溶液至沉淀完全析出白色沉淀 无色溶液白色沉淀 H白色沉淀 F加入AgNO3溶液 通入Ba(OH)2试回答下列问题:(1)A是 ,B是 (写化学式)(2)写出实验室制取气体B的化学方程式 .(3)写出A、B等物质的量在水溶液中反应方程式 。(4)试分析气体A使品红试液褪色的原理 。
2、了解二氧化硫的性质、用途
3、掌握浓硫酸的性质及硫酸根离子的检验能力目标: 1、培养学生实验设计能力
2、培养学生应用知识解决问题的能力
3、培养学生变通意识重点和难点:1、二氧化硫、浓硫酸的化学性质
2、硫酸根离子的检验根据我们在第六章所学的知识设计实验目的:1、验证H2S的还原性
2、验证SO2的酸性、氧化性、还原性、漂白性
3、验证浓硫酸的特性
4、SO42-离子的检验
药品:FeS及其它任意不含S的试剂或物质
仪器:任意
要求:设计思路体现知识的网络化 提示: 1、实验设计思路:目的—原理——过程
2、前面生成的物质可以做为后面的反应物
3、忽略具体仪器,只考虑知识过程目的:1、验证H2S的还原性目的H2S与氧化性物质反应设计思路:目的:1、验证H2S的还原性2H2S +O2H2S +Cl22H2S +3O2=2H2O +2S=2H2O +SO2=2HCl +SH2S还原性与O2, Cl2, 酸性KMnO4等氧化性物质反应SSO2目的2目的:1、验证H2S的还原性FeS[H+]H2S还原性O2与O2、 Cl2、酸性KMnO4等氧化性物质反应SSO2性质O2目的:1、验证H2S的还原性SO2氧化性的验证:SO2还原性的验证:如O2、 Cl2、 酸性KMnO4等如 H2S和还原性物质反应和氧化性性物质反应FeS[H+]H2S还原性O2与O2、Cl2、酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2品红目的3
目的4FeS[H+]H2S还原性O2与O2、 Cl2、 酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2H2SO4品红FeS[H+]H2S还原性O2与O2、 Cl2、酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2H2SO4H2O特性脱水性吸水性强氧化性蔗糖五水硫酸铜铜和碳SO42-离子的检验品红FeS[H+]H2S还原性O2与O2、 Cl2、 酸性KMnO4等氧化性物质反应SSO2性质漂白性酸性氧化性还原性SO2+ H2SSO2+ H2OSO2+ O2SO3O2H2SO4H2O特性脱水性吸水性强氧化性蔗糖无水硫酸铜铜和碳SO42-离子的检验品红评述上述方案是否严密,并说明理由.√有一包粉末,其中可能有Na2CO3、NaCl、K2SO4、CuCl2、K2CO3、BaCl2、Na2SO4。现按下列步骤进行实验:(1)将粉末加入水中,得无色溶液 和白色沉淀,过滤。(2)取滤液做焰色反应,火焰呈黄色,隔蓝色钴玻璃观察,未见淡紫色。(3)将滤出的沉淀置于试管中加入稀HNO3,有无色气体生成,沉淀 部分溶解。
结论:一定有的物质: 。
一定不含有的物质: 。
尚不肯定的物质: 。 BaCl2、Na2SO4 Na2CO3CuCl2、K2CO3 K2SO4 NaCl 为除去CO2气体中混有的少量杂质SO2气体,应选用的试剂是( ).
A、饱和Na2SO3溶液
B、饱和NaHCO3溶液
C、饱和NaOH溶液
D、饱和Na2CO3溶液B 已知A是一种有刺激性气味的无色气体,能使品红试液褪色;B是一种黄绿色气体;E、F均为不溶于水也不溶于酸的白色固体。下图是几种物质间相互转化的关系。 气体B气体AC和D的无色溶液等物质的量在水溶液中反应滴入Ba(OH)2溶液至沉淀完全析出白色沉淀 无色溶液白色沉淀 H白色沉淀 F加入AgNO3溶液 通入Ba(OH)2试回答下列问题:(1)A是 ,B是 (写化学式)(2)写出实验室制取气体B的化学方程式 .(3)写出A、B等物质的量在水溶液中反应方程式 。(4)试分析气体A使品红试液褪色的原理 。
同课章节目录
