卤族复习课[下学期]
图片预览





文档简介
课件17张PPT。WELCOME TO MY CLASS高中化学组
俞章华第四章《卤素》复习 (结合第五章有关知识) 教学目标:
1、掌握以氯元素为核心的卤素的性质及其递变规律,进一步加深对“结构决定性质”的理解;
2、认识卤素的单质及其重要化合物的特殊性,掌握氯气的制备方法。
教学重点:卤素的共性及递变性的表现及其内在原因。一、卤素单质物理性质的变化规律F2 Cl2 Br2 I2逐 渐 增 大逐 渐 升 高单质
颜色
状态
密度
熔沸点
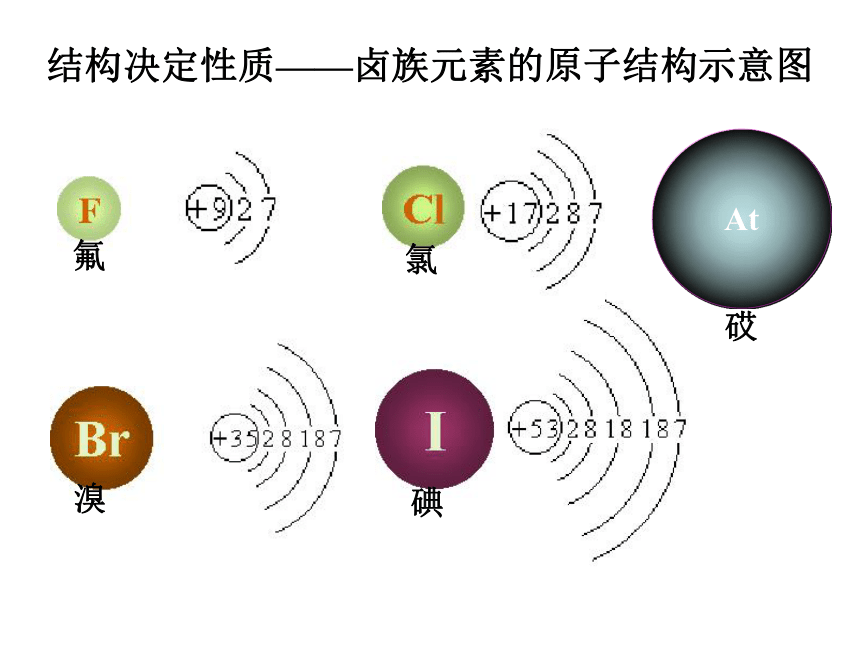
碘氯溴结构决定性质——卤族元素的原子结构示意图氟1.原子半径2.得电子能力3.元素非金属性强弱比较i.与氢化合的难易程度
ii.氢化物的稳定性
iii.最高价氧化物对应的水化物的酸性的强弱
iV .与同一变价金属反应化合价的高低
V.相互间的置换反应
练习:
1.卤素原子最外层的电子数都是____个,在化学反应中卤素原子容易得到______个电子。在卤化物中,卤素最常见的化合价是______价。
2.下列关于卤族元素的说法中,不正确的是( ??)
A.单质的熔点和沸点随核电荷数的增加逐渐升高
B.单质的颜色随核电荷数的增加逐渐加深
C.单质的氧化性随核电荷数的增加逐渐减弱
D.氢化物的稳定性随核电荷数的增加逐渐增强 71-1D3.下列氯化物中,不能直接利用金属与单质的反应得到的是(?? )
A.FeCl3 B.CuCl2 C.NaCl D.FeCl2
4.下列关于卤族元素(从Cl→I)性质递变的叙述,正确的是( )
(1)单质的氧化性增强; (2)单质的颜色加深;
(3)气态氢化物稳定性增强; (4)单质的沸点升高;
(5)离子的半径增大。
A. (1)(2)(3) B.(2)(3)(4)
C.(2)(4)(5) D.(1)(3)(5)
5.在卤族元素中,氧化性最强的是______,原子半径最小的是______。在卤化氢中,最稳定的是______。FFHFDC三、氯气的化学性质(1)与金属反应,写出与Na、Fe、Cu反应的化学方程式。(2)与非金属反应,写出与H2、P反应的化学方程式(4)氯气与碱的反应
a.尾气(Cl2)处理
b.漂白粉制取
漂白粉的生效2NaOH + Cl2 == NaCl+ NaClO + H2O2Ca(OH)2 + 2Cl2 == CaCl2+Ca(ClO)2+2H2OCa(ClO)2+H2O+CO2 == CaCO3↓+2HClO(3)与水的反应 方程式为:
新制氯水成分
分子:
离子:
性质:
久置氯水成分 分子: 性质:
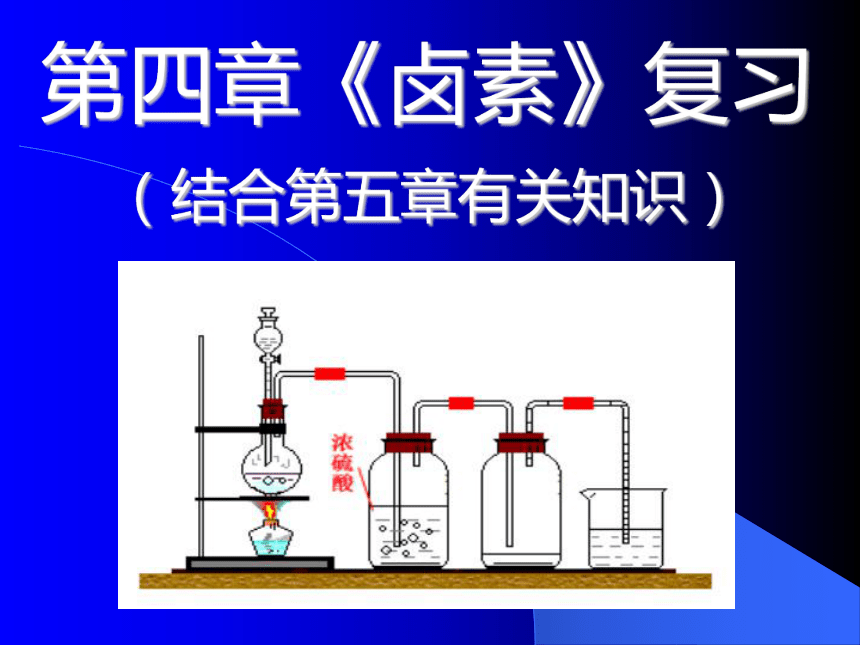
离子:Cl2+H2O=HCl+HClOCl2、H2O、HClO(为什么没有HCl分子?)H+、Cl-、ClO-(另有水电离形成的微量OH-存在)强氧化性、酸性(多种漂白剂原理比较)酸性H2OH+、 Cl - 四、氯气的实验室制法拓展思考:分析该方程的化合价变化,请同学们找到一种合理的代替MnO2作为实验室制取氯气原料的药品,并说明理由。
备选药品:
NaCl、K2SO4、KMnO4。Exercise: 1 .下列物质中,能使淀粉碘化钾溶液变蓝的是( ) A、氯水 B、碘水 C、KBr D、KI 2 .向含有NaBr和KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是?( ) A.NaCl和KI B.NaCl、KCl和I2 C.KCl和NaBr D.KCl和NaCl 3 .下列物质中,不能使有色布条褪色的是( ) A.次氯酸钠溶液 B.次氯酸钙溶液 C.氯水 D.氯化钙 ABDD4 .下列说法是否正确?为什么?
(1)氯水的pH值小于7。
(2)燃烧不一定要有氧气参加,任何发光放热的剧烈的化学反应都可以叫做燃烧。
(3)氯气不能使干燥的有
色布条褪色,液氯却能使
干燥的有色布条褪色。 五、卤族元素的特性(补充)课堂反馈:
1 .下列关于氯气的描述中,正确的是?( )
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铁丝在氯气中燃烧,生成FeCl2
C.有氯气参加的化学反应必须在溶液中进行
D.钠在氯气中燃烧生成白色固体NaCl
2 .下列物质中,属于纯净物的是( )
A.氯水 B.氯化氢 C.液氯 D.漂粉精
3 .将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素可能是( ) A.Cu B.Zn C.Na D.AlBCABD作业:1、完成以下反应的化学方程式,并
写出相应的离子方程。2、用双线桥法分析实验室制氯气的方程式谢谢
俞章华第四章《卤素》复习 (结合第五章有关知识) 教学目标:
1、掌握以氯元素为核心的卤素的性质及其递变规律,进一步加深对“结构决定性质”的理解;
2、认识卤素的单质及其重要化合物的特殊性,掌握氯气的制备方法。
教学重点:卤素的共性及递变性的表现及其内在原因。一、卤素单质物理性质的变化规律F2 Cl2 Br2 I2逐 渐 增 大逐 渐 升 高单质
颜色
状态
密度
熔沸点
碘氯溴结构决定性质——卤族元素的原子结构示意图氟1.原子半径2.得电子能力3.元素非金属性强弱比较i.与氢化合的难易程度
ii.氢化物的稳定性
iii.最高价氧化物对应的水化物的酸性的强弱
iV .与同一变价金属反应化合价的高低
V.相互间的置换反应
练习:
1.卤素原子最外层的电子数都是____个,在化学反应中卤素原子容易得到______个电子。在卤化物中,卤素最常见的化合价是______价。
2.下列关于卤族元素的说法中,不正确的是( ??)
A.单质的熔点和沸点随核电荷数的增加逐渐升高
B.单质的颜色随核电荷数的增加逐渐加深
C.单质的氧化性随核电荷数的增加逐渐减弱
D.氢化物的稳定性随核电荷数的增加逐渐增强 71-1D3.下列氯化物中,不能直接利用金属与单质的反应得到的是(?? )
A.FeCl3 B.CuCl2 C.NaCl D.FeCl2
4.下列关于卤族元素(从Cl→I)性质递变的叙述,正确的是( )
(1)单质的氧化性增强; (2)单质的颜色加深;
(3)气态氢化物稳定性增强; (4)单质的沸点升高;
(5)离子的半径增大。
A. (1)(2)(3) B.(2)(3)(4)
C.(2)(4)(5) D.(1)(3)(5)
5.在卤族元素中,氧化性最强的是______,原子半径最小的是______。在卤化氢中,最稳定的是______。FFHFDC三、氯气的化学性质(1)与金属反应,写出与Na、Fe、Cu反应的化学方程式。(2)与非金属反应,写出与H2、P反应的化学方程式(4)氯气与碱的反应
a.尾气(Cl2)处理
b.漂白粉制取
漂白粉的生效2NaOH + Cl2 == NaCl+ NaClO + H2O2Ca(OH)2 + 2Cl2 == CaCl2+Ca(ClO)2+2H2OCa(ClO)2+H2O+CO2 == CaCO3↓+2HClO(3)与水的反应 方程式为:
新制氯水成分
分子:
离子:
性质:
久置氯水成分 分子: 性质:
离子:Cl2+H2O=HCl+HClOCl2、H2O、HClO(为什么没有HCl分子?)H+、Cl-、ClO-(另有水电离形成的微量OH-存在)强氧化性、酸性(多种漂白剂原理比较)酸性H2OH+、 Cl - 四、氯气的实验室制法拓展思考:分析该方程的化合价变化,请同学们找到一种合理的代替MnO2作为实验室制取氯气原料的药品,并说明理由。
备选药品:
NaCl、K2SO4、KMnO4。Exercise: 1 .下列物质中,能使淀粉碘化钾溶液变蓝的是( ) A、氯水 B、碘水 C、KBr D、KI 2 .向含有NaBr和KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干,并灼烧所得的物质,最后剩余的固体物质是?( ) A.NaCl和KI B.NaCl、KCl和I2 C.KCl和NaBr D.KCl和NaCl 3 .下列物质中,不能使有色布条褪色的是( ) A.次氯酸钠溶液 B.次氯酸钙溶液 C.氯水 D.氯化钙 ABDD4 .下列说法是否正确?为什么?
(1)氯水的pH值小于7。
(2)燃烧不一定要有氧气参加,任何发光放热的剧烈的化学反应都可以叫做燃烧。
(3)氯气不能使干燥的有
色布条褪色,液氯却能使
干燥的有色布条褪色。 五、卤族元素的特性(补充)课堂反馈:
1 .下列关于氯气的描述中,正确的是?( )
A.Cl2以液态形式存在时可称作氯水或液氯
B.红热的铁丝在氯气中燃烧,生成FeCl2
C.有氯气参加的化学反应必须在溶液中进行
D.钠在氯气中燃烧生成白色固体NaCl
2 .下列物质中,属于纯净物的是( )
A.氯水 B.氯化氢 C.液氯 D.漂粉精
3 .将某元素的单质0.1mol与Cl2充分反应后,生成物的质量比原单质的质量增加了7.1g,这种元素可能是( ) A.Cu B.Zn C.Na D.AlBCABD作业:1、完成以下反应的化学方程式,并
写出相应的离子方程。2、用双线桥法分析实验室制氯气的方程式谢谢
同课章节目录
