第一章复习[上学期]
图片预览





文档简介
课件15张PPT。第一章 化学反应及能量变化第一节 氧化还原反应第二节 离子反应第三节 化学反应中的能量变化第一节 氧化还原反应
一.化学反应类型
分解 化合 置换 复分解1`根据反应物`生成物的类别,以及反应前物质种类 的多少,从形式上划分。2`从反应中物质是否得氧或失氧分为:氧化反应`还原反应。氧化反应即能夺得含氧化合物中的氧的反应。还原反应即含氧化合物中的氧被夺去的反应。注:氧化反应与还原反应相互依存,同时发生3`根据是否有电子转移分为:氧化还原反应非氧化还原反应二`氧化还原反应1`概念:1.一种物质被氧化,同时另一种物质被还原的反应。2.有元素化合价升降的反应都是氧化还原反应。氧化反应:物质所含元素化合价升高的反应。这
种物质是还原剂。还原反应:物质所含元素化合价升高的反应。这
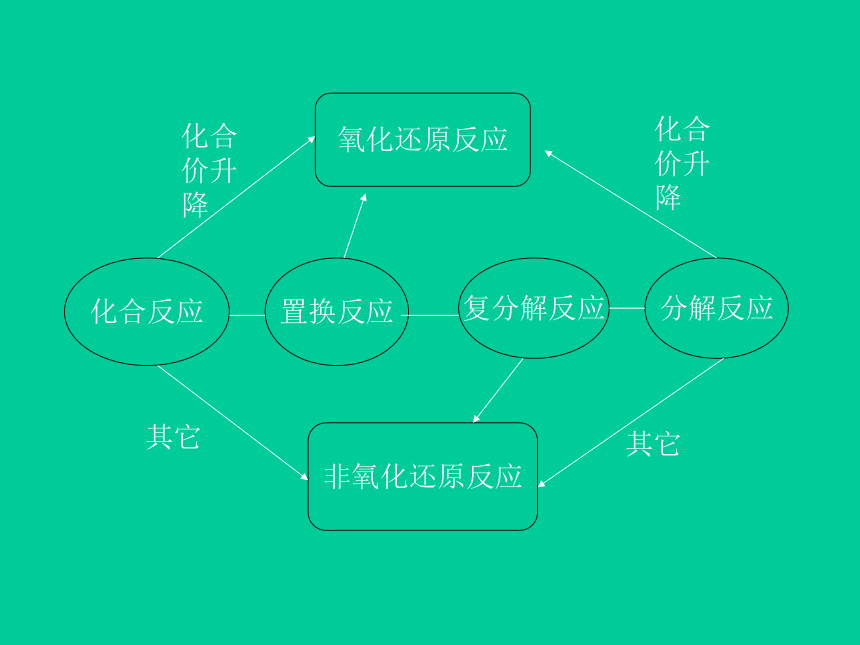
种物质是氧化剂。+200+1化合价升高被氧化化合价降低被还原 CuO: 氧化剂 H2: 还原剂2`氧化还原反应的特征:反应前后有元素化合价的升降3`四种反应类型与氧化还原反应的关系见下页图CuO+H2==Cu+H2O氧化还原反应化合反应置换反应复分解反应分解反应非氧化还原反应化合价升降化合价升降其它其它 注:1.有单质参加或生成的化学反应不一定是氧化还原反应。(正确)
2.肯定一种元素被氧化,另一种元素被还原。(错误)
3. 没有单质参加的化合反应不是氧化还原反应。(错误)4 .氧化还原反应的本质:电子转移
氧化反应:物质失去电子的反应。这种物质是还原剂。
还原反应:物质得到电子的反应。这种物质是氧化剂。
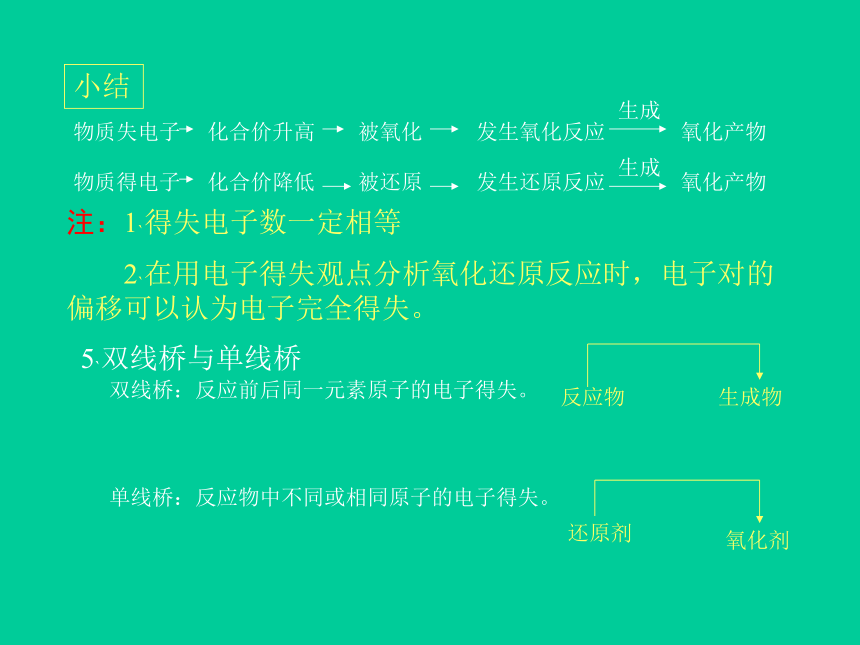
小结物质失电子 化合价升高 被氧化 发生氧化反应 氧化产物生成物质得电子 化合价降低 被还原 发生还原反应 氧化产物 生成注:1`得失电子数一定相等
2`在用电子得失观点分析氧化还原反应时,电子对的偏移可以认为电子完全得失。5`双线桥与单线桥双线桥:反应前后同一元素原子的电子得失。单线桥:反应物中不同或相同原子的电子得失。反应物生成物还原剂氧化剂三`氧化剂和还原剂 1`氧化剂:具有氧化性,易得电子,高价态物质。
(1)活泼的非金属单质:O2 , Cl2 , F2
(2)高价的氧化物:CuO , Fe2O3 , WO3 ,CO2
(3)高价的含氧酸及其盐: KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
(4)某些阳离子:Cu2+ , Fe3+ , H+
2`还原剂具有还原性,失电子,低价态物质(1)活泼的金属单质:K , Na , Mg , Fe , Al
(2)某些非金属单质:H2 , C
(3)变价元素的低价态物质:CO , Cu+
(4)某些阴离子: I-, S2-
另外,具有中间价态的化合物,在氧化还原反应中既能得到电子又能
失去电子,既能做氧化剂又能做还原剂,所以既有氧化性又有还原性。
注:氧化还原反应发生的条件
氧化性:氧化剂大于氧化产物; 还原性:还原剂大于还原产物第二节 离子反应一`强电解质和弱电解质
1`电解质非电解质
凡是在水溶液或熔化状态能导电的化合物都是电解质。
无论是在水溶液或熔化状态下都不能导电的化合物叫非电解质注:(1)酸碱盐都是电解质(2)某些金属氧化物:Na2O , CaO ,
(3)NH3 , CO2水溶液导电,但NH3 , CO2 是非电解质。(4)Cu 既不是电解质也不是非电解质(5)有机化合物几乎都是非电解质(6)水是电解质2`强弱电解质(1)导电能力实验溶液中自由移动离子浓度不同电解质的电离程度不同电解质有强弱之分(2)强电解质:在水溶液中完全电离成离子
强碱:NaOH=Na++OH-
强酸 :H2SO4=2H++SO4大多数盐: KAl(SO4)2=K++Al3++2SO42-注:BaCO3 , BaSO4 等属于难溶性物质,但溶解部分完全电离,是强电解质。(3)弱电解质:在水溶液中部分电离成离子弱 酸: CH3COOHCH3COO-+H+弱碱:NH3?H2O=NH4++OH-
少数盐:HgCl2=Hg2++2Cl-
水: H2O=2H++O2-二`离子反应1`离子反应:电解质在溶液中所起的反应,实际上是离子之间的反应,这样的反应属于离子反应。
凡是有离子参加或生成的反应都属于离子反应。2`离子方程式(1)书写步骤:[1]写:BaCl2+CuSO4=CuCl2+BaSO4[2]拆:Ba2++2Cl-+Cu2++SO42-=BaSO4 +Cu2++2Cl-[3]删;[4]查; Ba2++SO42-=BaSO4原子个数是否守恒,电荷数量是否守恒。(2)概念;用实际参加反应的离子的符号来表示离子反应的方程式。(3)书写离子方程式应该写成分子的物质[1]难溶性物质:AgX(AgCl , AgBr , AgI ) ,BaCO3 , CaCO3 , BaSO4 , PbSO4
Mg(OH)2 , Al(OH)3 , Fe(OH)3 , Cu(OH)2 , FeS , CuS , PbS, Ag2S , ZnS[2]难电离物质:弱酸;H2CO3 , CH3COOH , H3PO4 , HF , HClO , H2S ,H2SO3 , H2SiO3弱碱:NH3?H2O 水:H2O[3]单质,氧化物及全部气体物质(4)离子方程式的特点:[1]表示实际参加反应的离子所引起的变化。[2]不仅表示某几种离子所发生的反应,而且还表示同一类型的反应。(5)由离子方程式写出一个化学方程式。
规律:[1]分子式照抄不变阳离子配NO3-或Cl-
[2]阴离子配Na+改成正确的分子式(6)注意;
[1]不是离子反应不写离子方程式不是在溶液或熔化状态下进行的复分解反应是离子反应,不写离子方程式[2]微溶性物质;反应物若是稀溶液写成离子;若是悬浊液写成分子。生成物直接写成分子。[3]要考虑阴阳离子的配比,不可对方程式进行局部约减。4]原子个数要守恒,电荷[数`得失电子数要守恒。[5]酸式酸根离子除HSO4-写成H++SO42-以外,其余HCO3- , HSO3- , H2PO4-HS- , HPO42-弱酸的酸式酸根均原封不动。(7)复分解反应类型离子反应发生的条件生成[1]难溶性物质[2]难电离物质[3]气体(8)离子共存不共存生成难溶性物质,难电离物质,气体。发生氧化还原反应MnO4- , ClO- , ClO3- , Cr2O72- , NO3 与 S2- , I- , Br- 都不共存。氧化性离子与还原性离子不能共存。CO32- , SO42-无氧化性,H2SO4(浓 )有强氧化性; Cl-只有遇到强氧化剂MnO4-才具有还原性。第三节 化学反应中的能量变化一`化学反应中的能量变化1`化学反应伴随着能量变化2`放热反应[1]定义;放出热量的反应。[2]原因:反应物的总能量高于生成物的总能量。[3]例:多数化合反应;酸碱中和反应;金属单质与酸的反应。[4]其他的放热反应:非静摩擦,某些物质溶于水。3`吸热反应[1]概念:吸收热量的反应[2]原因:反应物能量低于生成物能量。[3]例:分解反应;
C+CO2==2CO H2+I2==2HI N2+O2==2NO
C+H2O==H2+CO Ba(OH)2+2NH4Cl==BaCl2+2NH3?H2O高温放电高温[4]其他:NH4Cl,NH4NO3溶于水吸热;干冰汽化冰熔化吸热。二`燃料的充分燃烧1`化石燃料是有限的2`燃料必须充分燃烧条件有充足的空气(但不是过多,否则将带走部分热量。燃料与空气要有足够大的接触面积。3`洁净煤技术煤的汽化液化C(s)+H2O(g)=H2(g)+CO(g)高温水煤气:H2 , CO , CH4 , CO2 液体:CH3OH(甲醇) 酸雨:含硫燃料燃烧时产生SO2 , SO2与空气中的O2在粉尘做催化 剂的作用下,生成SO3. SO3与H2O生成H2SO4 ,随雨雪下落到地面,形成酸雨。
一.化学反应类型
分解 化合 置换 复分解1`根据反应物`生成物的类别,以及反应前物质种类 的多少,从形式上划分。2`从反应中物质是否得氧或失氧分为:氧化反应`还原反应。氧化反应即能夺得含氧化合物中的氧的反应。还原反应即含氧化合物中的氧被夺去的反应。注:氧化反应与还原反应相互依存,同时发生3`根据是否有电子转移分为:氧化还原反应非氧化还原反应二`氧化还原反应1`概念:1.一种物质被氧化,同时另一种物质被还原的反应。2.有元素化合价升降的反应都是氧化还原反应。氧化反应:物质所含元素化合价升高的反应。这
种物质是还原剂。还原反应:物质所含元素化合价升高的反应。这
种物质是氧化剂。+200+1化合价升高被氧化化合价降低被还原 CuO: 氧化剂 H2: 还原剂2`氧化还原反应的特征:反应前后有元素化合价的升降3`四种反应类型与氧化还原反应的关系见下页图CuO+H2==Cu+H2O氧化还原反应化合反应置换反应复分解反应分解反应非氧化还原反应化合价升降化合价升降其它其它 注:1.有单质参加或生成的化学反应不一定是氧化还原反应。(正确)
2.肯定一种元素被氧化,另一种元素被还原。(错误)
3. 没有单质参加的化合反应不是氧化还原反应。(错误)4 .氧化还原反应的本质:电子转移
氧化反应:物质失去电子的反应。这种物质是还原剂。
还原反应:物质得到电子的反应。这种物质是氧化剂。
小结物质失电子 化合价升高 被氧化 发生氧化反应 氧化产物生成物质得电子 化合价降低 被还原 发生还原反应 氧化产物 生成注:1`得失电子数一定相等
2`在用电子得失观点分析氧化还原反应时,电子对的偏移可以认为电子完全得失。5`双线桥与单线桥双线桥:反应前后同一元素原子的电子得失。单线桥:反应物中不同或相同原子的电子得失。反应物生成物还原剂氧化剂三`氧化剂和还原剂 1`氧化剂:具有氧化性,易得电子,高价态物质。
(1)活泼的非金属单质:O2 , Cl2 , F2
(2)高价的氧化物:CuO , Fe2O3 , WO3 ,CO2
(3)高价的含氧酸及其盐: KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
(4)某些阳离子:Cu2+ , Fe3+ , H+
2`还原剂具有还原性,失电子,低价态物质(1)活泼的金属单质:K , Na , Mg , Fe , Al
(2)某些非金属单质:H2 , C
(3)变价元素的低价态物质:CO , Cu+
(4)某些阴离子: I-, S2-
另外,具有中间价态的化合物,在氧化还原反应中既能得到电子又能
失去电子,既能做氧化剂又能做还原剂,所以既有氧化性又有还原性。
注:氧化还原反应发生的条件
氧化性:氧化剂大于氧化产物; 还原性:还原剂大于还原产物第二节 离子反应一`强电解质和弱电解质
1`电解质非电解质
凡是在水溶液或熔化状态能导电的化合物都是电解质。
无论是在水溶液或熔化状态下都不能导电的化合物叫非电解质注:(1)酸碱盐都是电解质(2)某些金属氧化物:Na2O , CaO ,
(3)NH3 , CO2水溶液导电,但NH3 , CO2 是非电解质。(4)Cu 既不是电解质也不是非电解质(5)有机化合物几乎都是非电解质(6)水是电解质2`强弱电解质(1)导电能力实验溶液中自由移动离子浓度不同电解质的电离程度不同电解质有强弱之分(2)强电解质:在水溶液中完全电离成离子
强碱:NaOH=Na++OH-
强酸 :H2SO4=2H++SO4大多数盐: KAl(SO4)2=K++Al3++2SO42-注:BaCO3 , BaSO4 等属于难溶性物质,但溶解部分完全电离,是强电解质。(3)弱电解质:在水溶液中部分电离成离子弱 酸: CH3COOHCH3COO-+H+弱碱:NH3?H2O=NH4++OH-
少数盐:HgCl2=Hg2++2Cl-
水: H2O=2H++O2-二`离子反应1`离子反应:电解质在溶液中所起的反应,实际上是离子之间的反应,这样的反应属于离子反应。
凡是有离子参加或生成的反应都属于离子反应。2`离子方程式(1)书写步骤:[1]写:BaCl2+CuSO4=CuCl2+BaSO4[2]拆:Ba2++2Cl-+Cu2++SO42-=BaSO4 +Cu2++2Cl-[3]删;[4]查; Ba2++SO42-=BaSO4原子个数是否守恒,电荷数量是否守恒。(2)概念;用实际参加反应的离子的符号来表示离子反应的方程式。(3)书写离子方程式应该写成分子的物质[1]难溶性物质:AgX(AgCl , AgBr , AgI ) ,BaCO3 , CaCO3 , BaSO4 , PbSO4
Mg(OH)2 , Al(OH)3 , Fe(OH)3 , Cu(OH)2 , FeS , CuS , PbS, Ag2S , ZnS[2]难电离物质:弱酸;H2CO3 , CH3COOH , H3PO4 , HF , HClO , H2S ,H2SO3 , H2SiO3弱碱:NH3?H2O 水:H2O[3]单质,氧化物及全部气体物质(4)离子方程式的特点:[1]表示实际参加反应的离子所引起的变化。[2]不仅表示某几种离子所发生的反应,而且还表示同一类型的反应。(5)由离子方程式写出一个化学方程式。
规律:[1]分子式照抄不变阳离子配NO3-或Cl-
[2]阴离子配Na+改成正确的分子式(6)注意;
[1]不是离子反应不写离子方程式不是在溶液或熔化状态下进行的复分解反应是离子反应,不写离子方程式[2]微溶性物质;反应物若是稀溶液写成离子;若是悬浊液写成分子。生成物直接写成分子。[3]要考虑阴阳离子的配比,不可对方程式进行局部约减。4]原子个数要守恒,电荷[数`得失电子数要守恒。[5]酸式酸根离子除HSO4-写成H++SO42-以外,其余HCO3- , HSO3- , H2PO4-HS- , HPO42-弱酸的酸式酸根均原封不动。(7)复分解反应类型离子反应发生的条件生成[1]难溶性物质[2]难电离物质[3]气体(8)离子共存不共存生成难溶性物质,难电离物质,气体。发生氧化还原反应MnO4- , ClO- , ClO3- , Cr2O72- , NO3 与 S2- , I- , Br- 都不共存。氧化性离子与还原性离子不能共存。CO32- , SO42-无氧化性,H2SO4(浓 )有强氧化性; Cl-只有遇到强氧化剂MnO4-才具有还原性。第三节 化学反应中的能量变化一`化学反应中的能量变化1`化学反应伴随着能量变化2`放热反应[1]定义;放出热量的反应。[2]原因:反应物的总能量高于生成物的总能量。[3]例:多数化合反应;酸碱中和反应;金属单质与酸的反应。[4]其他的放热反应:非静摩擦,某些物质溶于水。3`吸热反应[1]概念:吸收热量的反应[2]原因:反应物能量低于生成物能量。[3]例:分解反应;
C+CO2==2CO H2+I2==2HI N2+O2==2NO
C+H2O==H2+CO Ba(OH)2+2NH4Cl==BaCl2+2NH3?H2O高温放电高温[4]其他:NH4Cl,NH4NO3溶于水吸热;干冰汽化冰熔化吸热。二`燃料的充分燃烧1`化石燃料是有限的2`燃料必须充分燃烧条件有充足的空气(但不是过多,否则将带走部分热量。燃料与空气要有足够大的接触面积。3`洁净煤技术煤的汽化液化C(s)+H2O(g)=H2(g)+CO(g)高温水煤气:H2 , CO , CH4 , CO2 液体:CH3OH(甲醇) 酸雨:含硫燃料燃烧时产生SO2 , SO2与空气中的O2在粉尘做催化 剂的作用下,生成SO3. SO3与H2O生成H2SO4 ,随雨雪下落到地面,形成酸雨。
同课章节目录
