氮族复习课件[上学期]
图片预览







文档简介
课件40张PPT。氮族元素复习 画出 7N 和15P 的原子结构示意图。7N 15P 33As 51Sb 83Bi原子结构的异同点:2,5 电子排布: 根据砷、锑、铋元素在周期表中的位置,画出它
们的原子结构示意图。2,8,52,8,18,52,8,18,18,52,8,18,32,18,5同:最外层5个电子 — ⅤA族 异: 随核电荷数增大,电子层数增多,原子半径增大。一、氮族元素思考与练习氮族元素化合价有何相似?有何不同?请写出氮元素氧化物和氢化物的化学式磷的常见化合物中磷元素的化合价有多种价态,最高正价+5价,负化合价-3价(非金属)
P、As为-3,+3,+5价;Sb、Bi为+3,+5价;
N表现-3,+1→+5价。亚硝酐
(HNO2)硝酐
(HNO3)思考与练习笑气怎样证明氮、磷、砷元素的非金属性逐渐减弱?氮
磷
砷N2O5 HNO3 电子层数增加,原子半径增大,获得电子的
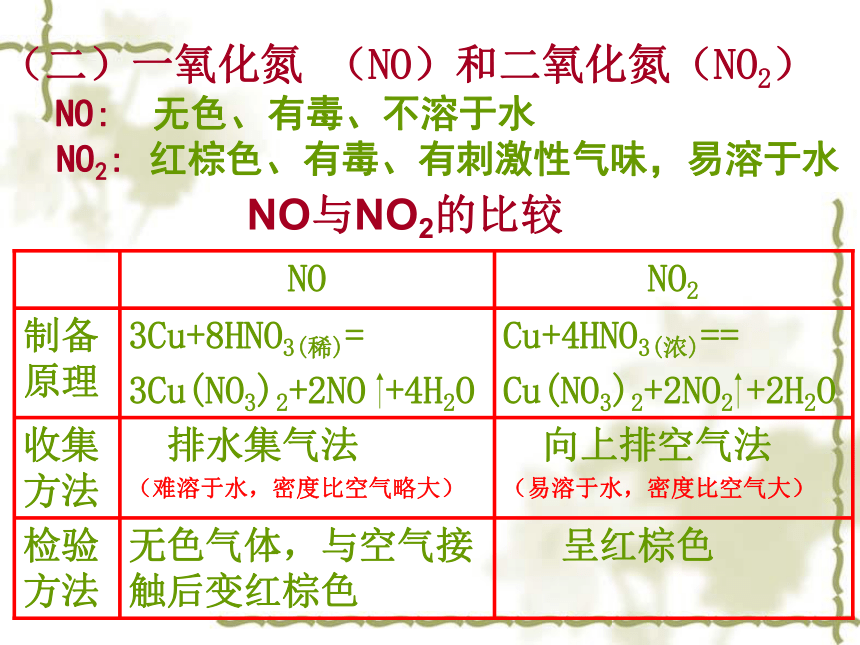
趋势逐渐减弱,所以非金属性逐渐减弱。P2O5 H3PO4As2O5 H3AsO4酸性减弱NH3PH3AsH3稳定性降低为什么氮、磷、砷元素的非金属性逐渐减弱?(一)氮 气(N2)物理性质:结 构:化学性质:用 途:制 备: 纯净的氮气是一种无色、无味的气体。难溶于水,密度比空气略小。 3Mg+N2 = Mg3N21.合成氨 2 .保护气 3 .冷冻剂液化空气二、氮及其化合物(很稳定)动画演示NO与NO2的比较(二)一氧化氮 (NO)和二氧化氮(NO2)NO:无色、有毒、不溶于水NO2:红棕色、有毒、有刺激性气味,易溶于水是一种无色、有刺激性气味的气体。易液化、极易溶于水(1:700)。NH3 + HCl = NH4Cl8NH3 + 3Cl2 = N2 + 6NH4Cl6NO + 4NH3 = 5N2 + 6H2O 物理性质:结 构:化学性质: 用 途: NH3检验:1.制硝酸、铵盐、纯碱 2.致冷剂 3.有机合成原料(三)氨、铵盐氨气与挥发性酸(如浓硝酸,浓盐酸)反应冒白烟a.使湿润的红色石蕊试纸变蓝
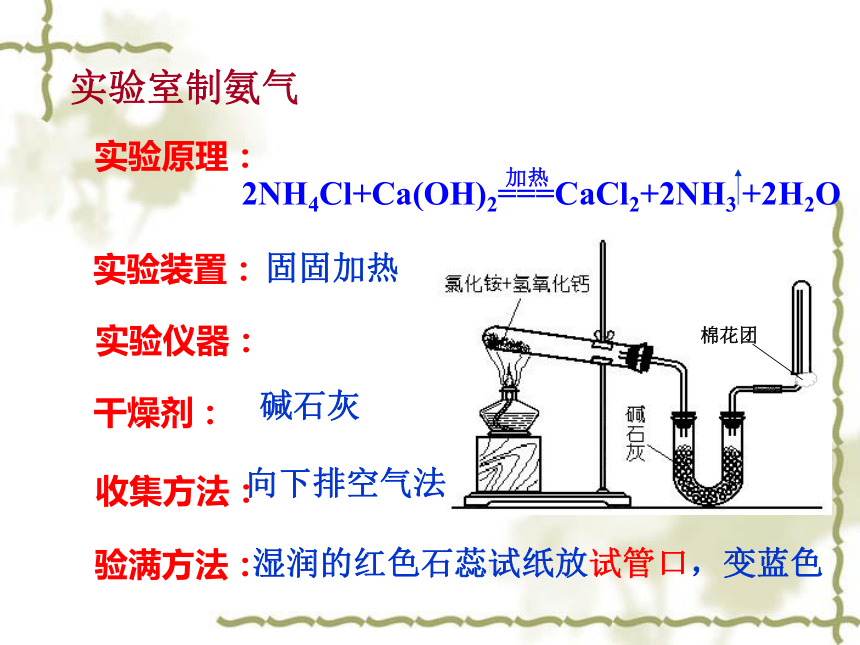
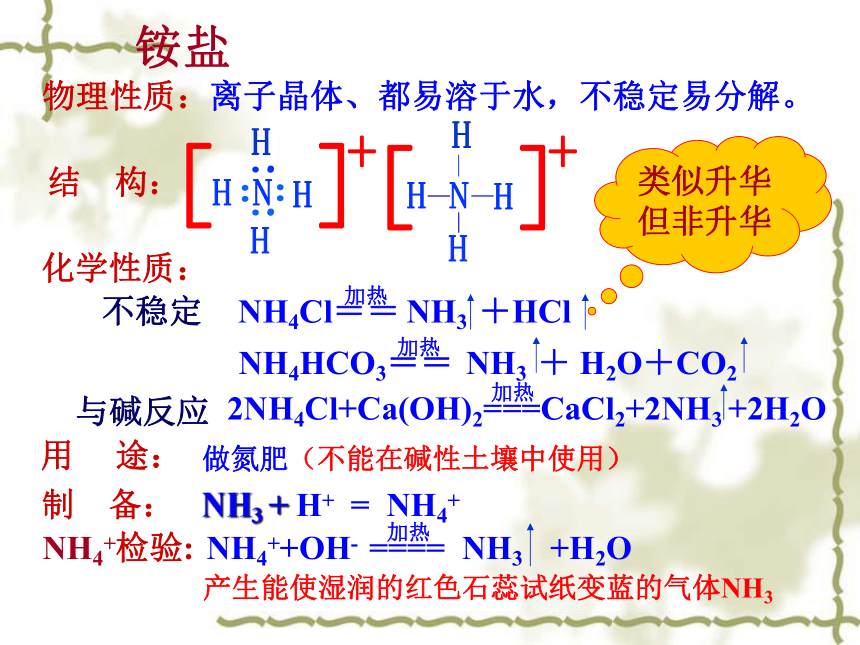
b.用蘸浓盐酸的玻璃棒放试管口,冒白烟2NH3 + H2SO4 = (NH4)2SO4实验室制氨气实验装置:实验原理:固固加热实验仪器:收集方法:向下排空气法干燥剂:碱石灰验满方法:湿润的红色石蕊试纸放试管口,变蓝色离子晶体、都易溶于水,不稳定易分解。NH3 + H+ = NH4+ 物理性质:结 构:化学性质: 用 途: 制 备:NH4+检验:做氮肥(不能在碱性土壤中使用)铵盐产生能使湿润的红色石蕊试纸变蓝的气体NH3类似升华
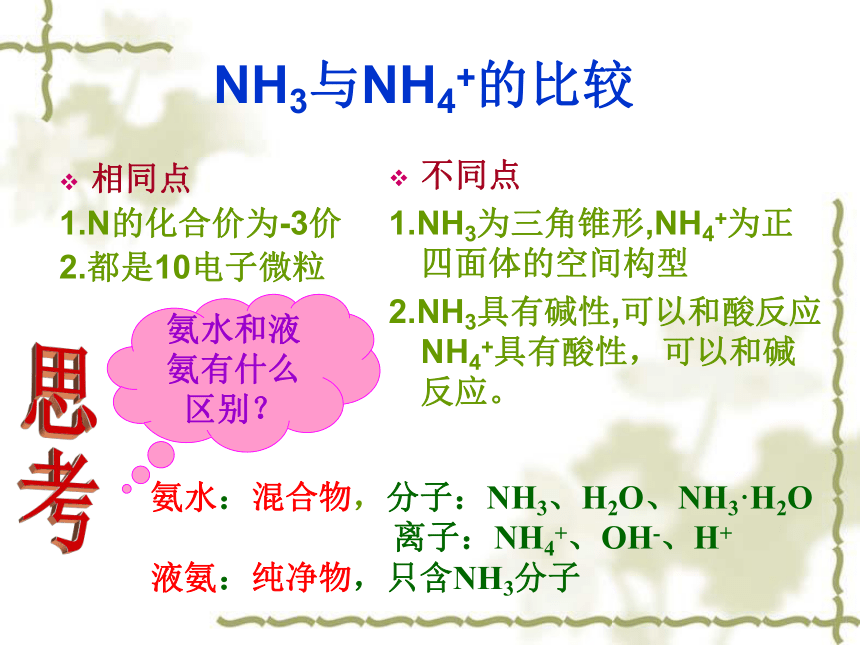
但非升华不稳定与碱反应NH3与NH4+的比较相同点
1.N的化合价为-3价
2.都是10电子微粒不同点
1.NH3为三角锥形,NH4+为正四面体的空间构型
2.NH3具有碱性,可以和酸反应NH4+具有酸性,可以和碱反应。思考氨水和液氨有什么区别?氨水:混合物,分子:NH3、H2O、NH3·H2O
离子:NH4+、OH-、H+
液氨:纯净物,只含NH3分子物理性质:化学性质:纯硝酸是无色、易挥发、有刺激性气味的液体。浓硝酸浓度约为69%,“发烟硝酸”浓度为98%以上。(四)硝酸 和硝酸盐2、不稳定性3、强氧化性:能与很多金属、非金属、和还原性物质反应。1、酸的通性1).稀硝酸能使紫色的石蕊试液变红
2).硝酸能与某些金属氧化物起反应
2HNO3+CuO=Cu(NO3)2+H2O
3).硝酸能与某些盐起反应
2HNO3 +CaCO3=Ca(NO3)2+CO2↑+H2O
4).硝酸能与碱起反应
HNO3+NaOH=NaNO3+H2O硝酸※※※.铜与浓硝酸反应:反应①现象溶液变蓝有红棕色的气体产生铜片溶解,常温下反应剧烈※※※.铜与稀硝酸反应:现象有无色的气体产生铜片溶解溶液变蓝思考硝酸和铜反应,体现了硝酸的什么性质?
制得等质量的硝酸铜消耗的硝酸哪个多?酸性和氧化性浓硝酸多
浓硝酸损失1/2
稀硝酸损失1/4硝酸能与大部分金属反应(除金、铂): 反应(Fe不足)(Fe过量)常温下Al、Fe在浓HNO3中钝化硝酸能与许多非金属反应:如C和S等。硝酸与金属反应总结 Fe、Al、等金属和稀HNO3能反应,但在冷的浓HNO3中钝化。
不活泼金属与硝酸反应时金属被氧化成相应的硝酸盐(最高价态),浓HNO3的还原产物一般是NO2,稀HNO3还原产物一般是NO。
浓HNO3不能氧化金和铂,但1体积浓HNO3和 3体积浓HCl组成的王水却能溶解金和铂。☆☆☆如何鉴别真假黄金??例:Fe(NO3)2能在溶液中稳定存在,但如果在
溶液中加入盐酸,溶液将由浅绿色变为棕
黄色.这说明Fe2+被NO3-/H+氧化成了Fe3+.硝酸和硫酸性质比较:硝酸的用途:硝酸是一种重要的化工原料,它可以
制造染料、炸药、硝酸盐,还可以做
塑料等。在实验室里,硝酸是一种重
要的化学试剂。硝酸的制备: 硝酸的工业制法----氨的催化氧化法工艺流程 反应原理 设备NO氧化成NO2 2NO+O2=2NO2 冷却器硝酸的生成 3NO2+H2O=2HNO3+NO 吸收塔1.一氧化氮和二氧化氮全部转化为硝酸的关系式?4NO2+O2+2H2O=4HNO32.怎样除去尾气中的氮氧化物?NO2 +NO+2NaOH=2NaNO2+H2O思考4NO+3O2+2H2O=4HNO3雷雨发庄稼有关氮的氧化物的计算:1、NO2溶于水或NO2、N2混合溶于水1)一定状况下一盛有一定体积NO2的试管倒扣
在水中,一段时间后,气体体积减少了20ml,
则原NO2的体积为 ml水柱上升为试管
体积的 。2)标况下,盛有NO2和N2以1:1混合气体
的试管倒扣在水中,充分反应后余气体积
占原体积 。302/32/32、NO2和O2混合溶于水1)在一烧瓶中将NO2和O2以4:1的体积比(标
准状况)混合,倒置于足量水中充分反应后所得
溶液的物质的量浓度为 mol/L2)将12mlNO2和O2的混合气体通入足量的水
中,充分反应后余气2ml(气体均在相同状态
下测定)求原各气体的体积。0.036NO2 8ml、O2 4ml或NO2 10.8ml、O2 1.2ml解:设烧瓶的体积为vL。
4NO2+O2+2H2O=4HNO3
4 1 4
4v/5×22.4 4v/5×22.4
C(HNO3)=n/V
=( 4v/5×22.4 )/v
=(4/5)×(1/22.4)
=0.036(mol/L)
1)标况下NO和O2以4:3混合,充满一
试管倒扣在水中,所得溶液物质的量浓
度为 mol/L。3、NO和O2的混合溶于水2)一定条件下,16mlNO和O2混合充满
试管倒扣水中余气为2ml求NO占原气体
的多少。0.026NO 8ml、O2 8ml或NO 10ml、O2 6ml4、NO、NO2混合溶于水1)标况下NO2和NO按3:1混合充满试管
倒扣水中,余气占原体积的 。2)30mlNO和NO2混合气体充满试管,
一段时间后余气为16ml求原气体中各种
气体的体积。1/2NO2 21ml、NO 9ml硝酸的计算1.92克Cu与定量的浓HNO3作用,当收集到气体1.12L(标况),铜恰好全部作用.则反应中HNO3消耗__mol 被还原的HNO3 __mol,转移电子__mol在锌跟稀硝酸反应时,若参加反应的锌与消耗的硝酸的物质的量之比为1:2.5时,则被还原的硝酸和未被还原的硝酸的物质的量之比为___
A 2:5 B 1:4 C 1:5 D 1:9 磷酸盐矿物
动物骨骼、脑髓、神经组织
植物的果实和幼芽磷的化学性质
较活泼,在自然
界中以化合态
的形式存在(一)磷的存在三、磷及其化合物(二)磷的两种同素异形体由同一种元素成性质不同的多种单质。 a.同素异形体的物理性质不同,化学性质相似。
b.同素异形体在一定条件下能相互转化。
这种转化为化学变化。特征:红磷和白磷 单质 白磷 红磷分子结构 颜色、状态 密度(g/cm-3) 溶解性 毒性 着火点 还原性 保存 相互转化 P4正四面体结构复杂白色蜡状固体 暗红色粉末 1.82不溶于水,易溶于CS2 不溶于水,也不溶于CS2剧毒 低 40℃,易自燃易被氧化,发磷光保存在冷水中(少量) 2.34无毒高 240℃,可燃不易被氧化贮存在密闭瓶中1、与氧气反应: P2O5是酸性氧化物,具有强烈的
吸水性,常做干燥剂。偏磷酸磷酸(三)磷的化学性质2、与氯气反应:无色液体→雾白色固体→白烟实验现象:白色烟雾PH3不稳定,可自燃3、与氢气反应:(四)磷的用途1.下列过程属于人工固氮的是
合成氨 B.由氨制 尿素
C.闪电时大气中氮的氧化物的生成
D. 从空气中分离出氮气随堂检测2. 下列各组离子在水溶液中能大量共存,但用盐酸酸化后就不能大量共存的是( )
A.NH4+、Al3+、Cl-、NO3-
B. Na+、NH4+、Fe2+、NO3-
C. Al3+、Na+、AlO2-、Cl-
D. Ca2+、K+、NO3-、HCO3-随堂检测3.将14g Fe粉投入一定量的稀硝酸里,Fe粉完全溶解并得到4.48 L (标况) NO,则反应后的溶液中Fe的存在形式是( )
只有Fe3+ B. Fe3+和Fe2+并存
C. 只有Fe2+ D.Fe3+和Fe2+的物质的量比为2:3随堂检测4.下列反应中硝酸既表现酸性又表现氧化性的是 ( )
A.Al(OH)3+3HNO3=Al(NO3)3+3H2O
B.FeO+4HNO3(浓)= Fe(NO3)3 +NO2↑+2H2O
C.C+4HNO3(浓)= CO2↑+4NO2↑+2H2O
D.3Cu+8HNO3(稀)=3Cu(NO3) 2+2NO↑4H2O 随堂检测5.二氧化氮和溴蒸汽都是红棕色气体,可用于鉴别它们的试剂( )
A、硝酸银溶液 B、湿润的石蕊试纸
C、氢氧化钠溶液 D、湿润淀粉碘化钾试纸6.一定条件下,将NO和O2以体积比1:1混合,
所得气体的平均相对分子质量可能为( )
A、31 B、41.3 C、略小于41.3 D、大于41.3随堂检测7.红磷和白磷在一定条件下可以相互转化,这一变化属于( )
A 物理变化
B 化学变化
C 氧化-还原反应
D 非氧化-还原反应 随堂检测“三年”太久,只争朝夕!
祝愿同学们
期末考试
取得
好成绩!再见!白 磷红 磷红磷、Sb2S3KClO3、MnO2、 S化学式
们的原子结构示意图。2,8,52,8,18,52,8,18,18,52,8,18,32,18,5同:最外层5个电子 — ⅤA族 异: 随核电荷数增大,电子层数增多,原子半径增大。一、氮族元素思考与练习氮族元素化合价有何相似?有何不同?请写出氮元素氧化物和氢化物的化学式磷的常见化合物中磷元素的化合价有多种价态,最高正价+5价,负化合价-3价(非金属)
P、As为-3,+3,+5价;Sb、Bi为+3,+5价;
N表现-3,+1→+5价。亚硝酐
(HNO2)硝酐
(HNO3)思考与练习笑气怎样证明氮、磷、砷元素的非金属性逐渐减弱?氮
磷
砷N2O5 HNO3 电子层数增加,原子半径增大,获得电子的
趋势逐渐减弱,所以非金属性逐渐减弱。P2O5 H3PO4As2O5 H3AsO4酸性减弱NH3PH3AsH3稳定性降低为什么氮、磷、砷元素的非金属性逐渐减弱?(一)氮 气(N2)物理性质:结 构:化学性质:用 途:制 备: 纯净的氮气是一种无色、无味的气体。难溶于水,密度比空气略小。 3Mg+N2 = Mg3N21.合成氨 2 .保护气 3 .冷冻剂液化空气二、氮及其化合物(很稳定)动画演示NO与NO2的比较(二)一氧化氮 (NO)和二氧化氮(NO2)NO:无色、有毒、不溶于水NO2:红棕色、有毒、有刺激性气味,易溶于水是一种无色、有刺激性气味的气体。易液化、极易溶于水(1:700)。NH3 + HCl = NH4Cl8NH3 + 3Cl2 = N2 + 6NH4Cl6NO + 4NH3 = 5N2 + 6H2O 物理性质:结 构:化学性质: 用 途: NH3检验:1.制硝酸、铵盐、纯碱 2.致冷剂 3.有机合成原料(三)氨、铵盐氨气与挥发性酸(如浓硝酸,浓盐酸)反应冒白烟a.使湿润的红色石蕊试纸变蓝
b.用蘸浓盐酸的玻璃棒放试管口,冒白烟2NH3 + H2SO4 = (NH4)2SO4实验室制氨气实验装置:实验原理:固固加热实验仪器:收集方法:向下排空气法干燥剂:碱石灰验满方法:湿润的红色石蕊试纸放试管口,变蓝色离子晶体、都易溶于水,不稳定易分解。NH3 + H+ = NH4+ 物理性质:结 构:化学性质: 用 途: 制 备:NH4+检验:做氮肥(不能在碱性土壤中使用)铵盐产生能使湿润的红色石蕊试纸变蓝的气体NH3类似升华
但非升华不稳定与碱反应NH3与NH4+的比较相同点
1.N的化合价为-3价
2.都是10电子微粒不同点
1.NH3为三角锥形,NH4+为正四面体的空间构型
2.NH3具有碱性,可以和酸反应NH4+具有酸性,可以和碱反应。思考氨水和液氨有什么区别?氨水:混合物,分子:NH3、H2O、NH3·H2O
离子:NH4+、OH-、H+
液氨:纯净物,只含NH3分子物理性质:化学性质:纯硝酸是无色、易挥发、有刺激性气味的液体。浓硝酸浓度约为69%,“发烟硝酸”浓度为98%以上。(四)硝酸 和硝酸盐2、不稳定性3、强氧化性:能与很多金属、非金属、和还原性物质反应。1、酸的通性1).稀硝酸能使紫色的石蕊试液变红
2).硝酸能与某些金属氧化物起反应
2HNO3+CuO=Cu(NO3)2+H2O
3).硝酸能与某些盐起反应
2HNO3 +CaCO3=Ca(NO3)2+CO2↑+H2O
4).硝酸能与碱起反应
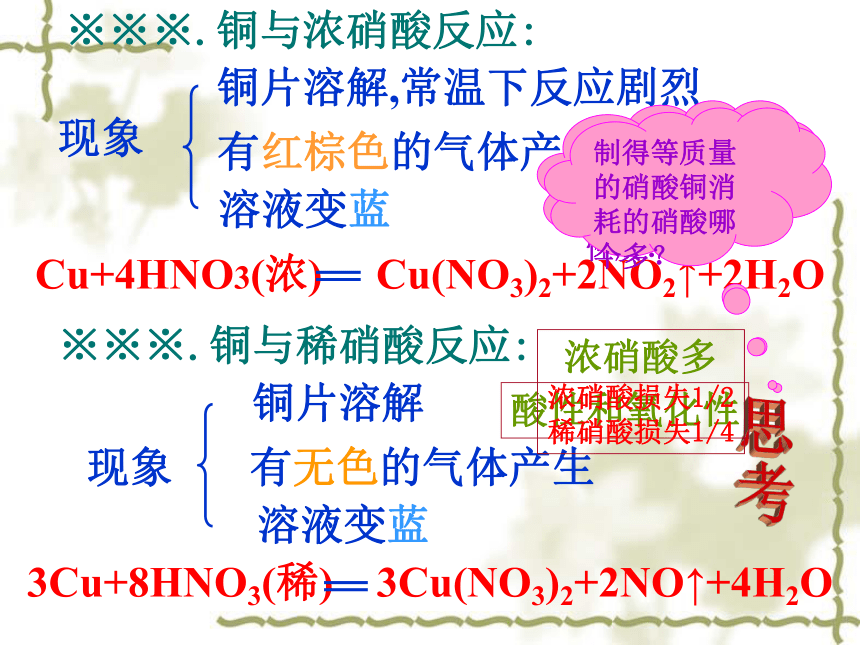
HNO3+NaOH=NaNO3+H2O硝酸※※※.铜与浓硝酸反应:反应①现象溶液变蓝有红棕色的气体产生铜片溶解,常温下反应剧烈※※※.铜与稀硝酸反应:现象有无色的气体产生铜片溶解溶液变蓝思考硝酸和铜反应,体现了硝酸的什么性质?
制得等质量的硝酸铜消耗的硝酸哪个多?酸性和氧化性浓硝酸多
浓硝酸损失1/2
稀硝酸损失1/4硝酸能与大部分金属反应(除金、铂): 反应(Fe不足)(Fe过量)常温下Al、Fe在浓HNO3中钝化硝酸能与许多非金属反应:如C和S等。硝酸与金属反应总结 Fe、Al、等金属和稀HNO3能反应,但在冷的浓HNO3中钝化。
不活泼金属与硝酸反应时金属被氧化成相应的硝酸盐(最高价态),浓HNO3的还原产物一般是NO2,稀HNO3还原产物一般是NO。
浓HNO3不能氧化金和铂,但1体积浓HNO3和 3体积浓HCl组成的王水却能溶解金和铂。☆☆☆如何鉴别真假黄金??例:Fe(NO3)2能在溶液中稳定存在,但如果在
溶液中加入盐酸,溶液将由浅绿色变为棕
黄色.这说明Fe2+被NO3-/H+氧化成了Fe3+.硝酸和硫酸性质比较:硝酸的用途:硝酸是一种重要的化工原料,它可以
制造染料、炸药、硝酸盐,还可以做
塑料等。在实验室里,硝酸是一种重
要的化学试剂。硝酸的制备: 硝酸的工业制法----氨的催化氧化法工艺流程 反应原理 设备NO氧化成NO2 2NO+O2=2NO2 冷却器硝酸的生成 3NO2+H2O=2HNO3+NO 吸收塔1.一氧化氮和二氧化氮全部转化为硝酸的关系式?4NO2+O2+2H2O=4HNO32.怎样除去尾气中的氮氧化物?NO2 +NO+2NaOH=2NaNO2+H2O思考4NO+3O2+2H2O=4HNO3雷雨发庄稼有关氮的氧化物的计算:1、NO2溶于水或NO2、N2混合溶于水1)一定状况下一盛有一定体积NO2的试管倒扣
在水中,一段时间后,气体体积减少了20ml,
则原NO2的体积为 ml水柱上升为试管
体积的 。2)标况下,盛有NO2和N2以1:1混合气体
的试管倒扣在水中,充分反应后余气体积
占原体积 。302/32/32、NO2和O2混合溶于水1)在一烧瓶中将NO2和O2以4:1的体积比(标
准状况)混合,倒置于足量水中充分反应后所得
溶液的物质的量浓度为 mol/L2)将12mlNO2和O2的混合气体通入足量的水
中,充分反应后余气2ml(气体均在相同状态
下测定)求原各气体的体积。0.036NO2 8ml、O2 4ml或NO2 10.8ml、O2 1.2ml解:设烧瓶的体积为vL。
4NO2+O2+2H2O=4HNO3
4 1 4
4v/5×22.4 4v/5×22.4
C(HNO3)=n/V
=( 4v/5×22.4 )/v
=(4/5)×(1/22.4)
=0.036(mol/L)
1)标况下NO和O2以4:3混合,充满一
试管倒扣在水中,所得溶液物质的量浓
度为 mol/L。3、NO和O2的混合溶于水2)一定条件下,16mlNO和O2混合充满
试管倒扣水中余气为2ml求NO占原气体
的多少。0.026NO 8ml、O2 8ml或NO 10ml、O2 6ml4、NO、NO2混合溶于水1)标况下NO2和NO按3:1混合充满试管
倒扣水中,余气占原体积的 。2)30mlNO和NO2混合气体充满试管,
一段时间后余气为16ml求原气体中各种
气体的体积。1/2NO2 21ml、NO 9ml硝酸的计算1.92克Cu与定量的浓HNO3作用,当收集到气体1.12L(标况),铜恰好全部作用.则反应中HNO3消耗__mol 被还原的HNO3 __mol,转移电子__mol在锌跟稀硝酸反应时,若参加反应的锌与消耗的硝酸的物质的量之比为1:2.5时,则被还原的硝酸和未被还原的硝酸的物质的量之比为___
A 2:5 B 1:4 C 1:5 D 1:9 磷酸盐矿物
动物骨骼、脑髓、神经组织
植物的果实和幼芽磷的化学性质
较活泼,在自然
界中以化合态
的形式存在(一)磷的存在三、磷及其化合物(二)磷的两种同素异形体由同一种元素成性质不同的多种单质。 a.同素异形体的物理性质不同,化学性质相似。
b.同素异形体在一定条件下能相互转化。
这种转化为化学变化。特征:红磷和白磷 单质 白磷 红磷分子结构 颜色、状态 密度(g/cm-3) 溶解性 毒性 着火点 还原性 保存 相互转化 P4正四面体结构复杂白色蜡状固体 暗红色粉末 1.82不溶于水,易溶于CS2 不溶于水,也不溶于CS2剧毒 低 40℃,易自燃易被氧化,发磷光保存在冷水中(少量) 2.34无毒高 240℃,可燃不易被氧化贮存在密闭瓶中1、与氧气反应: P2O5是酸性氧化物,具有强烈的
吸水性,常做干燥剂。偏磷酸磷酸(三)磷的化学性质2、与氯气反应:无色液体→雾白色固体→白烟实验现象:白色烟雾PH3不稳定,可自燃3、与氢气反应:(四)磷的用途1.下列过程属于人工固氮的是
合成氨 B.由氨制 尿素
C.闪电时大气中氮的氧化物的生成
D. 从空气中分离出氮气随堂检测2. 下列各组离子在水溶液中能大量共存,但用盐酸酸化后就不能大量共存的是( )
A.NH4+、Al3+、Cl-、NO3-
B. Na+、NH4+、Fe2+、NO3-
C. Al3+、Na+、AlO2-、Cl-
D. Ca2+、K+、NO3-、HCO3-随堂检测3.将14g Fe粉投入一定量的稀硝酸里,Fe粉完全溶解并得到4.48 L (标况) NO,则反应后的溶液中Fe的存在形式是( )
只有Fe3+ B. Fe3+和Fe2+并存
C. 只有Fe2+ D.Fe3+和Fe2+的物质的量比为2:3随堂检测4.下列反应中硝酸既表现酸性又表现氧化性的是 ( )
A.Al(OH)3+3HNO3=Al(NO3)3+3H2O
B.FeO+4HNO3(浓)= Fe(NO3)3 +NO2↑+2H2O
C.C+4HNO3(浓)= CO2↑+4NO2↑+2H2O
D.3Cu+8HNO3(稀)=3Cu(NO3) 2+2NO↑4H2O 随堂检测5.二氧化氮和溴蒸汽都是红棕色气体,可用于鉴别它们的试剂( )
A、硝酸银溶液 B、湿润的石蕊试纸
C、氢氧化钠溶液 D、湿润淀粉碘化钾试纸6.一定条件下,将NO和O2以体积比1:1混合,
所得气体的平均相对分子质量可能为( )
A、31 B、41.3 C、略小于41.3 D、大于41.3随堂检测7.红磷和白磷在一定条件下可以相互转化,这一变化属于( )
A 物理变化
B 化学变化
C 氧化-还原反应
D 非氧化-还原反应 随堂检测“三年”太久,只争朝夕!
祝愿同学们
期末考试
取得
好成绩!再见!白 磷红 磷红磷、Sb2S3KClO3、MnO2、 S化学式
同课章节目录
