氨的复习[上学期]
图片预览








文档简介
课件24张PPT。章节知识小结氮族元素氮族元素的位置、性质
3 、递变性:
核电荷数依次———,
核外电子层数依次——,原子半径——
↓
得电子能力逐渐——,失电子能力逐渐——。
↓ ↓
非金属性逐渐——, 金属性逐渐——。
N、P、As、Sb、Bi五增大增多增大减弱增强减弱增强1 、第VA主族: _________________
2 、通性:外层都为____电子自 上 而 下练习
下列关系中,不正确的是( )
A、非金属性:N>P>As
B、酸性:H3AsO4>H3PO4>HNO3
C、稳定性:H2O>NH3>PH3
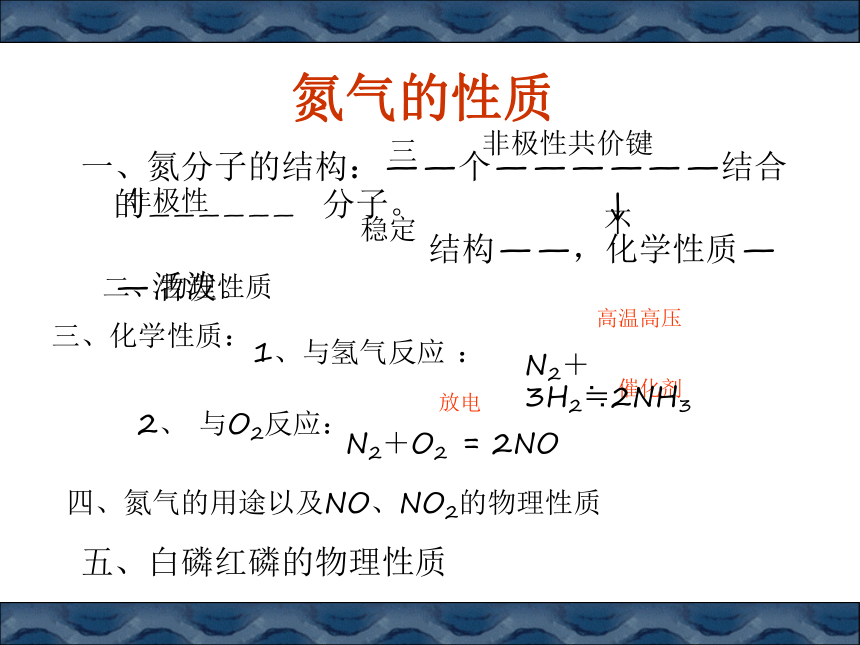
D、还原性:PH3>H2S>NH3B氮气的性质一、氮分子的结构:——个——————结合的—————— 分子。 ↓
结构——,化学性质——活泼。
非极性共价键三非极性稳定不二、物理性质高温高压催化剂
放电
三、化学性质:
四、氮气的用途以及NO、NO2的物理性质五、白磷红磷的物理性质1、与氢气反应 :N2+3H2≒2NH3
2、 与O2反应:N2+O2 = 2NO
练习
氧气与氮气的沸点,前者与后者的关系( )
A、大于 B、小于 C、等于 D、不确定A氮的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5
(1)、氮的氧化物都有毒,都是大气污染物
(2)、除NO2为红棕色外,其他均是无色气体
(3)、 N2O3是HNO2酸酐,N2O5是HNO3酸酐
(4)、 NO2 ≒ N2O4
练习
1.如何鉴别NO2和Br2蒸气?
用水或硝酸银溶液。但不能用淀粉KI试纸
2.一支试管中充有20mLNO气体,倒置在水槽中,向其中通入一定量O2,试管最终剩余气体4mL,则通入氧气的体积可能是( ) 4NO+3O2+2H2O=4HNO3
剩余气体可能是NO也可能是O219ml或 12ml氨
大量白烟大量白烟实质:NH3+H+ = NH4+一、物理性质:极易溶于水,无色,刺激性气味,液氨汽化吸热的应用。二、化学性质:(极易溶于水)NH3+H2O≒NH3·H2O≒NH4++OH-(碱性)2、与酸的反应:
NH3+HCL = NH4CL————
NH3+HNO3 = NH4NO3————
2 NH3+H2SO4 = (NH4)2SO4
3、氨与氧气的反应: 4NH3+5O2 = 4NO+H2O(注意反应条件)三、氨的用途
氨水与液氨、一水合氨的区别氨溶于水,少部分仍以________的形式存在。大部分与水结合成 ——————,该分子继续电离出————和—————
氨分子NH4·H2ONH4+OH-NH3H2ONH4·H2ONH4+OH-H+一水合氨为纯净物,弱电解质,电离显碱性
___________________________________________氨水中存在的分子和离子:练习
1.下列叙述中错误的是( )
A、离子化合物中不可能有非极性键
B、离子键只存在于离子化合物中,不存在于共价化合物中
C、由极性键结合的分子不一定是极性分子
D、非极性分子中一定含有非极性键
2.只能用排水法收集的气体是( )
A、NH3 B、HCl C、NO2 D、NOADD铵盐由NH4+和酸根离子构成的化合物
都是离子晶体,都易溶于水。
加热
NH4CL = NH3↑+HCL↑(现象)非氧化性酸(如盐酸)的铵盐受热放出氨气,
氧化性酸(如硝酸)的铵盐受热发生氧化还原反应。NH4++OH- = NH3+H2O一、定义:二、通性:三、化学性质:1、受热分解
△铵盐分解规律:2、铵盐与碱的反应:(※所有铵盐都可发生此反应)NH4CL+NaOH = NaCL+NH3↑+H2O
铵根离子的检验
取少量该晶体于小试管中,向内滴加适量NaOH溶液,加热,若有使湿润的红色石蕊试纸变蓝的气体生成,说明原晶体为铵盐,否则不是。 △
NH4++OH- = NH3↑+H2O
↓
湿润的红色石蕊试纸变蓝
现有一白色晶体,为验证它是否铵盐可设计下列实验:
总结:(NH4+的检验)氨气的实验室制法
固体与固体反应制取气体的装置。向下排空气法。碱石灰。1、原理:2NH4CL+Ca(OH)2=CaCL2+2NH3↑+2H2O△
思考:能否用NH4NO3、NaOH、KOH 2、装置3、收集:4、干燥:思考:能否用浓硫酸、P2O5、无水CaCL2?
思考:1、瓶口棉花团的作用
2、尾气如何处理?
思考:其他制取氨气的方法
(防止空气对流,使收集的氨气更纯净)(用一倒置漏斗置于水面上,防止倒吸)
5、检验: (1)湿润的红色石蕊试纸(变蓝)(2)蘸有浓HCL的玻棒接近瓶口(白烟)加热浓氨水极性分子与非极性分子极性分子:
(1)双原子:
(2)三原子:
(3)四原子:
非极性分子:
(1)双原子:
(2)三原子:
(3)五原子:
不同原子构成的双原子分子HCL等V型分子如H2O、H2S等
三角锥型如NH3
相同原子构成的双原子分子CL2、O2直线型分子如CO2、CS2等
正四面体型分子如CH4、CCL4等 喷泉实验
※1、检验装置的气密性。(圆底烧瓶必须干燥,必须是圆底烧瓶。平底不可)2、盛水烧杯中滴加几滴酚酞试液。3、胶头滴管吸入水4、收集氨气,并赶紧插上双孔塞 5、打开止水阀。 6、挤压胶头
说明:常见可做该实验的有 NH3、HCL——H2O
CO2、SO2——NaOH
液体
烧瓶内气体硝酸
无色,易挥发,刺激性气味的液体。
三大强酸:HCL、H2SO4、HNO3对比学习。一、物理性质:二、化学性质:1、酸的通性 2、不稳定性: △或光
4HNO3 〓 2H2O+4NO2↑+O2↑思考:(1)浓硝酸为什么呈黄色?
(2)如何贮存浓硝酸?
3、强氧化性【几乎能氧化所有金属(除金铂)】
4、王水的配比:浓盐酸 :浓硝酸 〓 3 :1Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2OC+4HNO3=CO2↑+4NO2↑+2H2O说明:NO3-本身并不具有氧化性,只有在酸性条件下才具备酸性。练习:NO3-、I-、Na+、Cu2+在溶液中能否大量共存?练习
1.下列各反应表明了硝酸的什么性质
(1)NaNO3(S)+H2SO4(浓)=Na2SO4+HNO3↑
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
(4)Na2CO3+2HNO3=2NaNO3+CO2↑+H2O
△或光
(5)4HNO3 〓 2H2O+4NO2↑+O2↑(易挥发性)(强氧化性)(酸性)(不稳定性)2、38.4mgCu与适量浓硝酸反应,铜全部作用完,共收集到22.4mL气体(标况),则反应消耗的硝酸的物质的量是( )
A、1.0×10-3mol B、1.6 ×10-3mol
C、2.2 ×10-3mol D、2.4 ×10-3mol
3、在铁和铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸后,充分振荡,剩余金属m2g,则m1和m2的关系是( )
A、m1一定大于m2 B、m1可能等于m2
C、m1一定等于m2 D、m1可能大于m2CA不同酸与金属反应的比较 Zn+2HCL=ZnCL2+H2↑
Fe+H2SO4=FeSO4+H2↑
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
结论:(1)硝酸与金属反应主要是+5价的N得到电子,被还原为NO、NO2等;而盐酸、稀硫酸为H得到电子,放出H2。
2)H+得电子体现酸的氧化性,酸根的中心原子得电子说明该酸为氧化性酸。钝化:铝、铁等在冷的浓硝酸、冷的浓硫酸中会发生钝化现象。章节练习题
1、常温下能共存的一组气体是( )A、NO和O2 B、N2和O2 C、H2和F2 D、NH3和HCLB2、下列物质中,造成光化学烟雾的主要因素是( )A、N2 B、CO2 C、NO2 D、SO2C3、在实验室下列试剂通常保存在棕色试剂瓶中的是( )A、浓硫酸 B 浓硝酸 C 浓盐酸 D 冰醋酸B4、常温下,密闭可盛放浓硝酸或浓硫酸的金属器皿是( )A、 Cu B、Fe C、Zn DAg B5、下列关于氨的用途的说法,错误的是( )A、制氮肥 B、制硝酸 C、作制冷剂 D、作消毒剂D6、既能用浓硫酸又能用碱石灰干燥的气体是( )A、NH3 B、H2 C、SO2 D、CL2B7、NO2与水的反应中,氧化剂与还原剂的质量比为( )A、1 :2 B、2 :1 C、3 :1 D、1 :3A8、一根蘸有浓氨水的玻璃棒靠近另一根蘸有某种酸的玻璃棒,产生大量白烟,所用酸可能是( )A、浓硫酸 B、浓盐酸 C、稀硫酸 D、浓硝酸B、D 9、为保护某些食品的色香味,使其不易变质,同时防止食品受压变形,常在包装袋中充入( )A、CL2 B、O2 C、N2 D、NO2C
3 、递变性:
核电荷数依次———,
核外电子层数依次——,原子半径——
↓
得电子能力逐渐——,失电子能力逐渐——。
↓ ↓
非金属性逐渐——, 金属性逐渐——。
N、P、As、Sb、Bi五增大增多增大减弱增强减弱增强1 、第VA主族: _________________
2 、通性:外层都为____电子自 上 而 下练习
下列关系中,不正确的是( )
A、非金属性:N>P>As
B、酸性:H3AsO4>H3PO4>HNO3
C、稳定性:H2O>NH3>PH3
D、还原性:PH3>H2S>NH3B氮气的性质一、氮分子的结构:——个——————结合的—————— 分子。 ↓
结构——,化学性质——活泼。
非极性共价键三非极性稳定不二、物理性质高温高压催化剂
放电
三、化学性质:
四、氮气的用途以及NO、NO2的物理性质五、白磷红磷的物理性质1、与氢气反应 :N2+3H2≒2NH3
2、 与O2反应:N2+O2 = 2NO
练习
氧气与氮气的沸点,前者与后者的关系( )
A、大于 B、小于 C、等于 D、不确定A氮的氧化物:N2O、NO、N2O3、NO2、N2O4、N2O5
(1)、氮的氧化物都有毒,都是大气污染物
(2)、除NO2为红棕色外,其他均是无色气体
(3)、 N2O3是HNO2酸酐,N2O5是HNO3酸酐
(4)、 NO2 ≒ N2O4
练习
1.如何鉴别NO2和Br2蒸气?
用水或硝酸银溶液。但不能用淀粉KI试纸
2.一支试管中充有20mLNO气体,倒置在水槽中,向其中通入一定量O2,试管最终剩余气体4mL,则通入氧气的体积可能是( ) 4NO+3O2+2H2O=4HNO3
剩余气体可能是NO也可能是O219ml或 12ml氨
大量白烟大量白烟实质:NH3+H+ = NH4+一、物理性质:极易溶于水,无色,刺激性气味,液氨汽化吸热的应用。二、化学性质:(极易溶于水)NH3+H2O≒NH3·H2O≒NH4++OH-(碱性)2、与酸的反应:
NH3+HCL = NH4CL————
NH3+HNO3 = NH4NO3————
2 NH3+H2SO4 = (NH4)2SO4
3、氨与氧气的反应: 4NH3+5O2 = 4NO+H2O(注意反应条件)三、氨的用途
氨水与液氨、一水合氨的区别氨溶于水,少部分仍以________的形式存在。大部分与水结合成 ——————,该分子继续电离出————和—————
氨分子NH4·H2ONH4+OH-NH3H2ONH4·H2ONH4+OH-H+一水合氨为纯净物,弱电解质,电离显碱性
___________________________________________氨水中存在的分子和离子:练习
1.下列叙述中错误的是( )
A、离子化合物中不可能有非极性键
B、离子键只存在于离子化合物中,不存在于共价化合物中
C、由极性键结合的分子不一定是极性分子
D、非极性分子中一定含有非极性键
2.只能用排水法收集的气体是( )
A、NH3 B、HCl C、NO2 D、NOADD铵盐由NH4+和酸根离子构成的化合物
都是离子晶体,都易溶于水。
加热
NH4CL = NH3↑+HCL↑(现象)非氧化性酸(如盐酸)的铵盐受热放出氨气,
氧化性酸(如硝酸)的铵盐受热发生氧化还原反应。NH4++OH- = NH3+H2O一、定义:二、通性:三、化学性质:1、受热分解
△铵盐分解规律:2、铵盐与碱的反应:(※所有铵盐都可发生此反应)NH4CL+NaOH = NaCL+NH3↑+H2O
铵根离子的检验
取少量该晶体于小试管中,向内滴加适量NaOH溶液,加热,若有使湿润的红色石蕊试纸变蓝的气体生成,说明原晶体为铵盐,否则不是。 △
NH4++OH- = NH3↑+H2O
↓
湿润的红色石蕊试纸变蓝
现有一白色晶体,为验证它是否铵盐可设计下列实验:
总结:(NH4+的检验)氨气的实验室制法
固体与固体反应制取气体的装置。向下排空气法。碱石灰。1、原理:2NH4CL+Ca(OH)2=CaCL2+2NH3↑+2H2O△
思考:能否用NH4NO3、NaOH、KOH 2、装置3、收集:4、干燥:思考:能否用浓硫酸、P2O5、无水CaCL2?
思考:1、瓶口棉花团的作用
2、尾气如何处理?
思考:其他制取氨气的方法
(防止空气对流,使收集的氨气更纯净)(用一倒置漏斗置于水面上,防止倒吸)
5、检验: (1)湿润的红色石蕊试纸(变蓝)(2)蘸有浓HCL的玻棒接近瓶口(白烟)加热浓氨水极性分子与非极性分子极性分子:
(1)双原子:
(2)三原子:
(3)四原子:
非极性分子:
(1)双原子:
(2)三原子:
(3)五原子:
不同原子构成的双原子分子HCL等V型分子如H2O、H2S等
三角锥型如NH3
相同原子构成的双原子分子CL2、O2直线型分子如CO2、CS2等
正四面体型分子如CH4、CCL4等 喷泉实验
※1、检验装置的气密性。(圆底烧瓶必须干燥,必须是圆底烧瓶。平底不可)2、盛水烧杯中滴加几滴酚酞试液。3、胶头滴管吸入水4、收集氨气,并赶紧插上双孔塞 5、打开止水阀。 6、挤压胶头
说明:常见可做该实验的有 NH3、HCL——H2O
CO2、SO2——NaOH
液体
烧瓶内气体硝酸
无色,易挥发,刺激性气味的液体。
三大强酸:HCL、H2SO4、HNO3对比学习。一、物理性质:二、化学性质:1、酸的通性 2、不稳定性: △或光
4HNO3 〓 2H2O+4NO2↑+O2↑思考:(1)浓硝酸为什么呈黄色?
(2)如何贮存浓硝酸?
3、强氧化性【几乎能氧化所有金属(除金铂)】
4、王水的配比:浓盐酸 :浓硝酸 〓 3 :1Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2OC+4HNO3=CO2↑+4NO2↑+2H2O说明:NO3-本身并不具有氧化性,只有在酸性条件下才具备酸性。练习:NO3-、I-、Na+、Cu2+在溶液中能否大量共存?练习
1.下列各反应表明了硝酸的什么性质
(1)NaNO3(S)+H2SO4(浓)=Na2SO4+HNO3↑
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
(4)Na2CO3+2HNO3=2NaNO3+CO2↑+H2O
△或光
(5)4HNO3 〓 2H2O+4NO2↑+O2↑(易挥发性)(强氧化性)(酸性)(不稳定性)2、38.4mgCu与适量浓硝酸反应,铜全部作用完,共收集到22.4mL气体(标况),则反应消耗的硝酸的物质的量是( )
A、1.0×10-3mol B、1.6 ×10-3mol
C、2.2 ×10-3mol D、2.4 ×10-3mol
3、在铁和铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸后,充分振荡,剩余金属m2g,则m1和m2的关系是( )
A、m1一定大于m2 B、m1可能等于m2
C、m1一定等于m2 D、m1可能大于m2CA不同酸与金属反应的比较 Zn+2HCL=ZnCL2+H2↑
Fe+H2SO4=FeSO4+H2↑
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
结论:(1)硝酸与金属反应主要是+5价的N得到电子,被还原为NO、NO2等;而盐酸、稀硫酸为H得到电子,放出H2。
2)H+得电子体现酸的氧化性,酸根的中心原子得电子说明该酸为氧化性酸。钝化:铝、铁等在冷的浓硝酸、冷的浓硫酸中会发生钝化现象。章节练习题
1、常温下能共存的一组气体是( )A、NO和O2 B、N2和O2 C、H2和F2 D、NH3和HCLB2、下列物质中,造成光化学烟雾的主要因素是( )A、N2 B、CO2 C、NO2 D、SO2C3、在实验室下列试剂通常保存在棕色试剂瓶中的是( )A、浓硫酸 B 浓硝酸 C 浓盐酸 D 冰醋酸B4、常温下,密闭可盛放浓硝酸或浓硫酸的金属器皿是( )A、 Cu B、Fe C、Zn DAg B5、下列关于氨的用途的说法,错误的是( )A、制氮肥 B、制硝酸 C、作制冷剂 D、作消毒剂D6、既能用浓硫酸又能用碱石灰干燥的气体是( )A、NH3 B、H2 C、SO2 D、CL2B7、NO2与水的反应中,氧化剂与还原剂的质量比为( )A、1 :2 B、2 :1 C、3 :1 D、1 :3A8、一根蘸有浓氨水的玻璃棒靠近另一根蘸有某种酸的玻璃棒,产生大量白烟,所用酸可能是( )A、浓硫酸 B、浓盐酸 C、稀硫酸 D、浓硝酸B、D 9、为保护某些食品的色香味,使其不易变质,同时防止食品受压变形,常在包装袋中充入( )A、CL2 B、O2 C、N2 D、NO2C
同课章节目录
