几种重要金属的复习[上学期]
图片预览


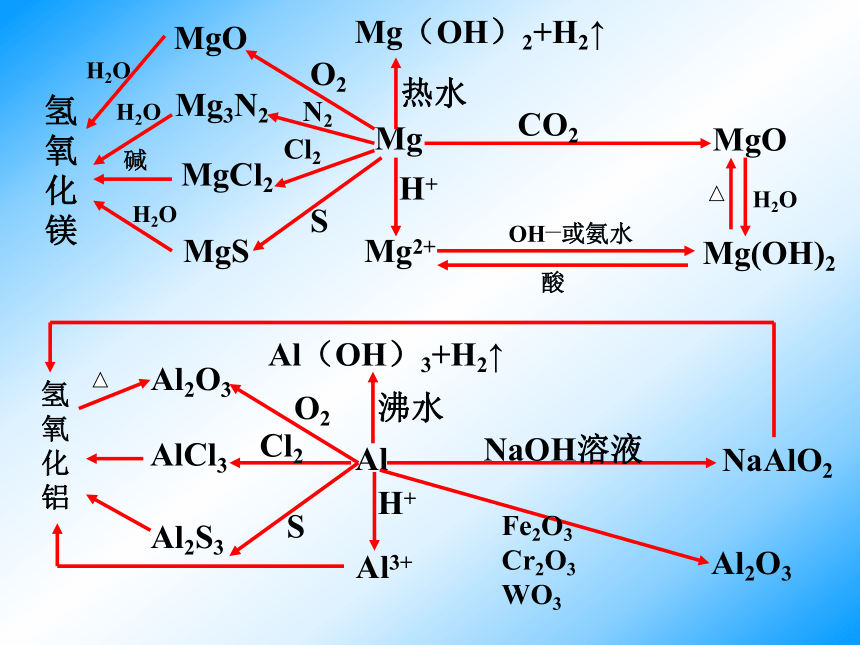






文档简介
课件29张PPT。几种重要金属复习课 知识要点梳理一、镁铝单质概述 思考题根据元素在元素周期表中的“位构性”的关系,对比1.金属镁和铝原子结构上有何异同点?2.金属镁和铝性质上有何异同点? 注意1.镁能与热水反应,而铝要与沸水才能反应;2.常温下,铝能被浓硫酸、浓硝酸钝化,而镁不能; 3.铝能跟强碱溶液反应放出氢气,而镁不能。 例题解析1. 0.1摩镁粉分别在足量的O2、CO2、N2中燃烧,生成固体的质量依次为W1、W2、W3.下列关系式正确的是
(A)W2>W1>W3 (B)W1=W2>W3
(C)W1=W2=W3 (D)W3>W2>W1
(上海高考题) 知识要点梳理二、MgO与Al2O3性质概述 思考题1. MgO与Al2O3性质上有何异同点?2. MgO与Al2O3的实验室及工业制法?用途? 例题解析例1.铝矾土的主要成分是Al2O3、Fe2O3和SiO2。工业上使用盐酸、NaOH、CO2、氨水等,以必要的操作,可从铝矾土中提纯Al2O3以冶炼金属铝。
(1)画出两种操作方案的流程图;
(2)写出有关离子方程式。
知识要点梳理三、Mg(OH)2与Al(OH)3性质概述 思考题1. Mg(OH)2与Al(OH)3性质上有何异同点?2.实验室如何制取Mg(OH)2与Al(OH)3? 例题解析例1.在如下图的转化关系中,A、B、C为单质,其余方框内物质均为化合物,B、X、N常温下均为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、P中均含同一种元素(框图中某些生成物已略去)。请填写下列空白: 1.完成下列方程式: ①②③④2.写出下列物质的电子式: B、X、Z、N3.试拟定工业上由Y制取单质A的反应原理(用化学方程式
表示) 例题解析例2.怎样将氯化铝和氯化铁的混合溶液分离成氯化铝和氯化铁两种溶液?请写出必要的实验操作步骤和有关离子方程式。
知识要点梳理三、Mg(OH)2与Al(OH)3性质概述 思考题1. Mg(OH)2与Al(OH)3性质上有何异同点?2.实验室如何制取Mg(OH)2与Al(OH)3?3.如实验室制得NaAlO2试剂则如何制取Al(OH)3? 知识要点梳理四、“铝三角”3H+H+或
弱酸3OH—
或弱碱OH—4OH—4H+ 思考题1、为什么Al(OH)3既能与酸反应,又能与碱反应?2、根据Al(OH)3的性质,最好用什么材料制备
氢氧化铝?3、在一定量的AlCl3溶液中加入NaOH溶液,
如何确定何时得到最大沉淀量?AlO2-+H++H2O Al(OH)3 Al 3++3OH—加入大量H+时,+
H+
H2O
Al(OH)3基本按碱式电离。+
OH—
H2O
加入大量OH—时,Al(OH)3基本按酸式电离。实验室制Al(OH)3:
2AlCl3+6NH3·H2O=2 Al(OH)3↓+3(NH4)2SO4实验现象:1、开始滴加NaOH时,只 发 生 反 应(1),溶液中不断生成沉淀,到加入的
n(NaOH)= 时 ,
沉淀出现最大量。 2、继续滴加NaOH时发生反应 (2),已经生成的Al(OH)3
重新溶解,当加入的n(NaOH)=
时,Al(OH)3全部溶解。 铝三角知识的应用 思考题: 用4molAl,可以选用盐酸或NaOH溶液,使Al完全转化为Al(OH)3沉淀,可以有几种途径?所需HCl和NaOH的物质的量之和的最小值为多少?
途径1:4molAl4molAl3+4molAl(OH)3途径2:4molAl4molAlO2—4molAl(OH)3途径3:1molAl3molAl1molAl3+3molAlO2—4molAl(OH)3如何用实验的方法检验某无色晶体是明矾?五.铁 三 角Fe3+Fe2+ Fe一)、Fe Fe2+FeS Fe2++ Cu1、Fe Fe2+铁与较弱的氧化剂反应
如:S、Cu2+、非氧化性酸(H+)Fe + Cu2+==Fe + 2H+==Fe2+与具有还原性的物质反应时
可还原成铁,其在炼钢中尤为突出,
如:C、CO、Si、Al、Mn等。2Fe + SiO2Fe + CO22、Fe2+ Fe二) FeFe3+
铁与强氧化剂反应时,
如:Cl2 、HNO3、热浓H2SO4等
反应时,均可生成+3价铁的化合物2FeCl31、Fe Fe3+ +3价铁的化合物与H2、Al、C、CO等还原剂反应均可还原成铁,如:2Fe + 3CO22Fe + Al2O32、Fe3+ Fe1、Fe2+ Fe3+三)、 Fe2+ Fe3+ Fe2+具有还原性,当遇到强氧化
剂时如:O2、Cl2、Br2、KMnO4、
HNO3、浓H2SO4、HClO、K2Cr2O7
等均可生成+3价铁。
2FeCl2 + Cl2==
2FeBr2 + Br2==
4Fe(OH)2 + O2 + 2H2O==2FeCl32FeBr34 Fe(OH)3思考题?在实验室在中如何保存
FeCl2溶液? 当Fe3+ 遇到强还原剂,如:Fe、
Cu、S2-(H2S)、SO32-、I-(HI)
等,均可将它还原成Fe2+,如:2Fe3++H2S==2Fe2++Cu2+2、Fe3+ Fe2+2Fe3++Cu==思考题?1、如果加入过量的H2S气体,
能否产生FeS的沉淀?2、在FeCl3溶液中分别加入Na2S
和H2S气体所产生的沉淀相同吗?
请分别写出它们的化学方程式。
小结:Fe3+Fe2+ Fe1、氧化性:Cl2>Br2 >Fe3+ >I22、还原性Cl- <Br- <Fe2+ <I - <S2-K +<Ca2+ < … < Fe2+ < … < Cu2+ <Fe3+ <Ag+…
练习题在100毫升FeBr2溶液中,通入2.24L的
标准状况下的氯气,充分反应后,溶液中
有1/3的Br-被氧化成溴单质,求原FeBr2
溶液的物质的量浓度。
(A)W2>W1>W3 (B)W1=W2>W3
(C)W1=W2=W3 (D)W3>W2>W1
(上海高考题) 知识要点梳理二、MgO与Al2O3性质概述 思考题1. MgO与Al2O3性质上有何异同点?2. MgO与Al2O3的实验室及工业制法?用途? 例题解析例1.铝矾土的主要成分是Al2O3、Fe2O3和SiO2。工业上使用盐酸、NaOH、CO2、氨水等,以必要的操作,可从铝矾土中提纯Al2O3以冶炼金属铝。
(1)画出两种操作方案的流程图;
(2)写出有关离子方程式。
知识要点梳理三、Mg(OH)2与Al(OH)3性质概述 思考题1. Mg(OH)2与Al(OH)3性质上有何异同点?2.实验室如何制取Mg(OH)2与Al(OH)3? 例题解析例1.在如下图的转化关系中,A、B、C为单质,其余方框内物质均为化合物,B、X、N常温下均为气体,C为黑色固体,D为白色沉淀,A、Y、Z、M、P中均含同一种元素(框图中某些生成物已略去)。请填写下列空白: 1.完成下列方程式: ①②③④2.写出下列物质的电子式: B、X、Z、N3.试拟定工业上由Y制取单质A的反应原理(用化学方程式
表示) 例题解析例2.怎样将氯化铝和氯化铁的混合溶液分离成氯化铝和氯化铁两种溶液?请写出必要的实验操作步骤和有关离子方程式。
知识要点梳理三、Mg(OH)2与Al(OH)3性质概述 思考题1. Mg(OH)2与Al(OH)3性质上有何异同点?2.实验室如何制取Mg(OH)2与Al(OH)3?3.如实验室制得NaAlO2试剂则如何制取Al(OH)3? 知识要点梳理四、“铝三角”3H+H+或
弱酸3OH—
或弱碱OH—4OH—4H+ 思考题1、为什么Al(OH)3既能与酸反应,又能与碱反应?2、根据Al(OH)3的性质,最好用什么材料制备
氢氧化铝?3、在一定量的AlCl3溶液中加入NaOH溶液,
如何确定何时得到最大沉淀量?AlO2-+H++H2O Al(OH)3 Al 3++3OH—加入大量H+时,+
H+
H2O
Al(OH)3基本按碱式电离。+
OH—
H2O
加入大量OH—时,Al(OH)3基本按酸式电离。实验室制Al(OH)3:
2AlCl3+6NH3·H2O=2 Al(OH)3↓+3(NH4)2SO4实验现象:1、开始滴加NaOH时,只 发 生 反 应(1),溶液中不断生成沉淀,到加入的
n(NaOH)= 时 ,
沉淀出现最大量。 2、继续滴加NaOH时发生反应 (2),已经生成的Al(OH)3
重新溶解,当加入的n(NaOH)=
时,Al(OH)3全部溶解。 铝三角知识的应用 思考题: 用4molAl,可以选用盐酸或NaOH溶液,使Al完全转化为Al(OH)3沉淀,可以有几种途径?所需HCl和NaOH的物质的量之和的最小值为多少?
途径1:4molAl4molAl3+4molAl(OH)3途径2:4molAl4molAlO2—4molAl(OH)3途径3:1molAl3molAl1molAl3+3molAlO2—4molAl(OH)3如何用实验的方法检验某无色晶体是明矾?五.铁 三 角Fe3+Fe2+ Fe一)、Fe Fe2+FeS Fe2++ Cu1、Fe Fe2+铁与较弱的氧化剂反应
如:S、Cu2+、非氧化性酸(H+)Fe + Cu2+==Fe + 2H+==Fe2+与具有还原性的物质反应时
可还原成铁,其在炼钢中尤为突出,
如:C、CO、Si、Al、Mn等。2Fe + SiO2Fe + CO22、Fe2+ Fe二) FeFe3+
铁与强氧化剂反应时,
如:Cl2 、HNO3、热浓H2SO4等
反应时,均可生成+3价铁的化合物2FeCl31、Fe Fe3+ +3价铁的化合物与H2、Al、C、CO等还原剂反应均可还原成铁,如:2Fe + 3CO22Fe + Al2O32、Fe3+ Fe1、Fe2+ Fe3+三)、 Fe2+ Fe3+ Fe2+具有还原性,当遇到强氧化
剂时如:O2、Cl2、Br2、KMnO4、
HNO3、浓H2SO4、HClO、K2Cr2O7
等均可生成+3价铁。
2FeCl2 + Cl2==
2FeBr2 + Br2==
4Fe(OH)2 + O2 + 2H2O==2FeCl32FeBr34 Fe(OH)3思考题?在实验室在中如何保存
FeCl2溶液? 当Fe3+ 遇到强还原剂,如:Fe、
Cu、S2-(H2S)、SO32-、I-(HI)
等,均可将它还原成Fe2+,如:2Fe3++H2S==2Fe2++Cu2+2、Fe3+ Fe2+2Fe3++Cu==思考题?1、如果加入过量的H2S气体,
能否产生FeS的沉淀?2、在FeCl3溶液中分别加入Na2S
和H2S气体所产生的沉淀相同吗?
请分别写出它们的化学方程式。
小结:Fe3+Fe2+ Fe1、氧化性:Cl2>Br2 >Fe3+ >I22、还原性Cl- <Br- <Fe2+ <I - <S2-K +<Ca2+ < … < Fe2+ < … < Cu2+ <Fe3+ <Ag+…
练习题在100毫升FeBr2溶液中,通入2.24L的
标准状况下的氯气,充分反应后,溶液中
有1/3的Br-被氧化成溴单质,求原FeBr2
溶液的物质的量浓度。
同课章节目录
