高一上学期期中考试复习[上学期]
图片预览










文档简介
课件54张PPT。中考复习反应实质:有电子得失或电子对的偏移。
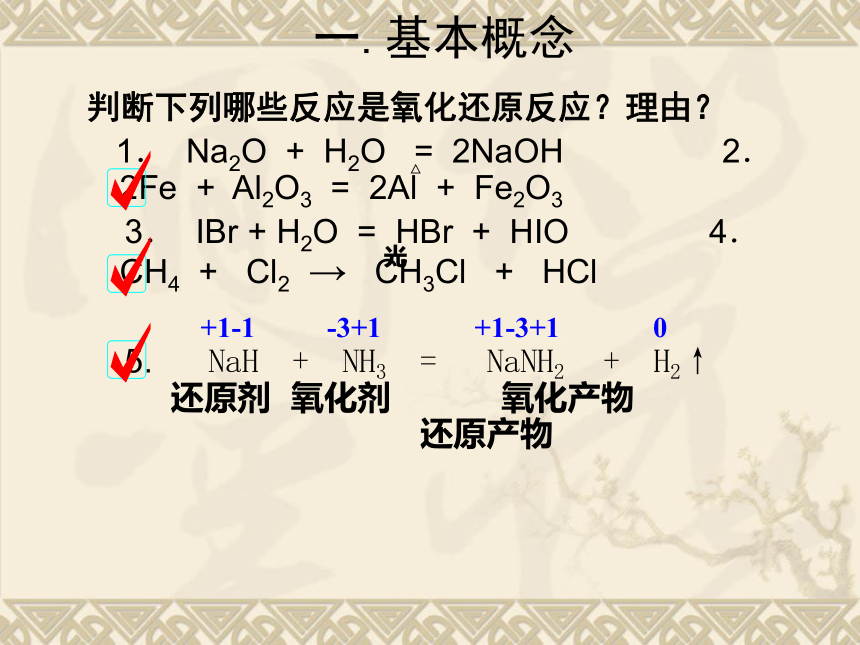
表现特征:元素化合价有升降。一、基本概念 一.基本概念判断下列哪些反应是氧化还原反应?理由?
1.? Na2O + H2O = 2NaOH 2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? IBr + H2O = HBr + HIO 4.? CH4 + Cl2 → CH3Cl + HCl
5. NaH + NH3 = NaNH2 + H2↑
光△ 还原剂 氧化剂 氧化产物
还原产物 +1-1 -3+1 +1-3+1 0下列叙述正确的是:
1.在氧化还原反应中,肯定有一种物质被氧化,另一种物质被还原。
2.没有单质参加的氧化还原反应一定不是氧化还原反应。
3.置换反应一定是氧化还原反应。
4.失电子难的物质容易获得电子。
5.得电子多的物质,它的氧化性强。二.守恒律守恒律——化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。除此之外,质量和原子个数也都守恒。
R2O8n-离子在一定条件下可将Mn2+离子氧化成MnO4-离子。若反应后R2O8n-变成RO42-,又知反应中氧化剂和还原剂的个数之比是5:2,则n值为
A、1????????B、2
C、3??????? D、4B三.价态律最高价——氧化性
最低价——还原性
中间价——既有氧化性又有还原性
物质含有多种元素,其性质是这些元素性质的终合体现。
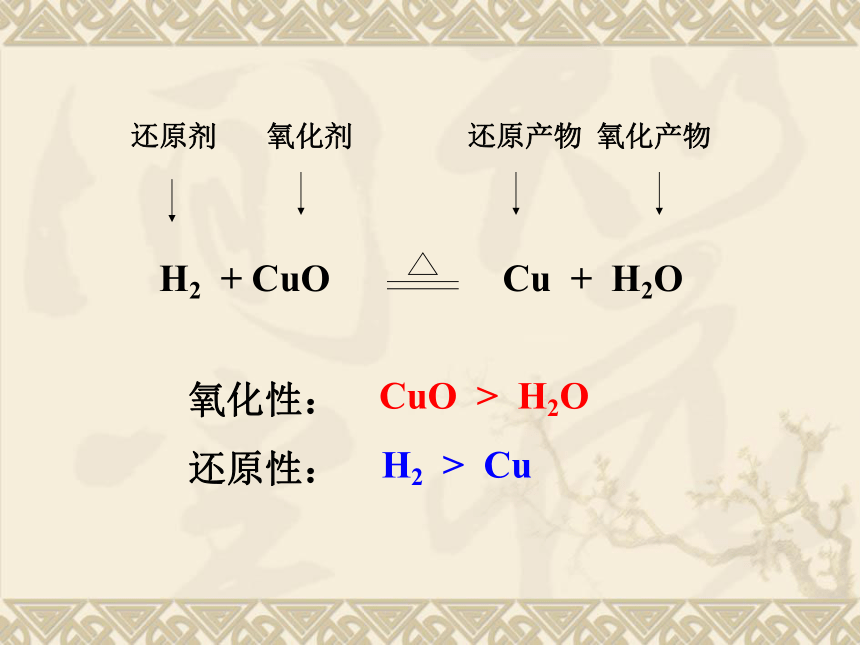
例1、现有下列粒子①S ②S2- ③Na+ ④Fe2+ ⑤H+ ⑥Cu ⑦O2 ⑧HCl ⑨H2O ⑩SO2,其中在氧化还原反应中只能作还原剂的是 ,只能作氧化剂的是 ,既能作氧化剂又能作还原剂的是 。②⑥③⑤⑦①④⑧⑨⑩四.强弱律(1)较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。氧化剂的氧化性大于氧化产物的氧化性还原剂的还原性大于还原产物的还原性氧化性:
还原性: CuO > H2OH2 > CuA(2)根据金属活动性顺序进行判断K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au失电子能力逐渐减弱,还原性逐渐减弱K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ Hg+ Ag+得电子能力逐渐增强,氧化性逐渐增强(3)根据氧化还原反应进行的难易程度(反应条件)的不同进行判断 同种氧化剂和不同的还原剂反应,易发生反应的还原剂的还原性强;同种还原剂和不同的氧化剂反应,易发生反应的氧化剂的氧化性强。
前者比后者容易,可判断氧化性:KMnO4> MnO2 注:部分被氧化,部分被还原
3Cu+8HNO3=3Cu(NO3)2+2NO↑+ 4H2O
指出氧化剂,还原剂,氧化产物、还原产物。
指出被还原和未被还原的HNO3、的质量比。
指出HNO3的作用
五.歧化和归中歧化:同一元素的同一价态发生的氧化还原反应。
归中:同一元素的不同价态发生的氧化还原反应。归中规律同一元素不同价态原子间发生氧化还原反应: 高价态 + 低价态 → 中间价态
可归纳为:两相靠,不相交。
关系为:高到高,低到低。
根据这个规律:便于我们判断氧化产物和还原产物,标明电子转移关系。例如:下列反应中电子转移关系,依据归中规律,应为:KClO3+6HCl===KCl+3Cl2↑+3H2O
电子转移数目不是6e-而是5e-;Cl2既是氧化产物又是还原产物。
六.电解质㈠电解质和非电解质
1.电解质:在水溶液里或熔融状态下能够导电的化合物。例如酸、碱、盐等化合物是电解质。
2.非电解质:无论是在水溶液或熔融状态都不导电的化合物。例如,蔗糖、酒精、CO2、SO2、NH3等化合物是非电解质。
1.下列物质的水溶液能导电而本身不是电解质的是
A.氨气 B.硫酸
C.二氧化碳 D.硫酸钠
2.在某溶液中有K+、H+、SO42-、NO3-,则溶液中溶质的种类最多为
A.2种 B.3种
C.4种 D.5种ACD⑴强电解质:在水溶液里全部电离出离子的电解质叫做强电解质。如大多数盐类、强酸、强碱等。
KNO3、NaCl、CaCO3、BaSO4、NaHCO3、NaHSO4
HCl、HBr、HI、H2SO4、HNO3;
NaOH、KOH、Ba(OH)2、Ca(OH)2……七.强弱电解质⑵弱电解质:在水溶液里只有一部分分子电离出离子的电解质叫做弱电解质。如弱酸、弱碱、水、少数盐等。
HF,HCN,HNO2,HPO3,CH3COOH,
H2S ,H2SO3,H2SiO3,H2CO3;
H3PO4,H3AsO4,H4SiO4 ……
NH3·H2O,AgOH;Cu(OH)2,Zn(OH)2 ,
Sn(OH)2,Fe(OH)2,Pb(OH)2;
Fe(OH)3,Al(OH)3……
(CH3COO)2Pb4. 强、弱电解质对比下列叙述正确的是:
1强电解质的都是离子化合物,弱电解质都是共价化合物。
2.易溶于水的电解质一定是强电解质。
3.两种溶液中,导电能力强的的一定是强电解质。
4.强电解质溶解在水中全部电离。
5.氢氧化钠,硫酸钡,铜,蔗糖,二氧化硫都是强电解质。八.电解质导电导电性的强弱
在相同条件下,只取决于溶液中自由离子的浓度及其所带电荷的多少。八.电解质导电下列物质,当前者少量浓溶液加入后者溶液时,后者溶液导电能力明显增强的是
1.H2SO4,Ba(OH)2
2.NaOH,CH3COOH
3.HCl,Ba(OH)2
4.NaCl,AgNO3九.离子共存离子不能大量共存原因:
1.生成难溶物或微溶物;
2.生成气体或挥发性物质;
3.生成难电离物质
4.发生氧化还原反应:氧化性离子与还原性离子不能大量共存。
5.受酸、碱性环境的影响而不能大量共存。如弱酸根离子在酸性溶液中不能存在;弱酸的酸式根离子在酸性、碱性溶液中均不能存在。
下列各组离子,在强碱性溶液中可以大量共存的是(??? )
A.Cu2+、Cl-、NO3-、Na+
B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-???????????????????????????
D.SO3、NO3-、SO42-、HCO3-
C十.离子方程式书写拆写的原则
1.把易溶于水易电离的强电解质改写成离子
2.气体,单质,难溶的物质保留其化学式
Mg Cl2 CO2 CaCO3 AgCl
3.弱电解质(难电离的物质)保留其化学式
CH3COOH Cu(OH)2
4.氧化物和氮化物都保留其化学式
书写的特殊说明1.微溶的电解质
做反应物时,稀溶液用离子形式表示,悬浊液用化学式形式表示。
①澄清石灰水与碳酸钠溶液反应。
②石灰乳与盐酸反应。
做生成物时,用化学式表示。
①氯化钙溶液与烧碱溶液反应。
②硫酸钠溶液与氯化钙溶液反应。2.对阴、阳离子都参加反应的电解质,其阴、阳离子的个数比一般应符合实际组成。
①硫酸溶液与氢氧化钡溶液反应
3.固体间的反应,一般不写离子方程式;非水溶液中的反应,不能用离子方程式表示。
①碳酸氢钠加热分解
十一.离子方程式的意义CO32-+2H+==CO2 +H2O表示的意义。
可溶性碳酸盐与强酸的反应十二.离子方程式的正误判断下列离子方程式中错误的是(??? )
A.铁跟稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+ ==Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应:
CH3COOH+OH- == CH3COO-+H2O
D.碳酸镁跟强酸应: MgCO3+2H+==Mg2++H2O+CO2↑AB下列反应的离子方程式正确的是(??? )
A.碳酸氢钙溶液跟稀硝酸反应:
HCO3-+H+=H2O+CO2↑
B.饱和石灰水跟稀硝酸反应:
Ca(OH)2+2H+=Ca2++2H2O
C.向稀氨水中加入稀盐酸:
NH3·H2O+H+=NH4++H2O
D.碳酸钙溶于醋酸中:
CaCO3+2H+=Ca2++H2O+CO2↑
A C十三.离子的推断和鉴别有A、B、C、D四种溶液,它们各为K2CO3、K2SO4、H2SO4、Ba(NO3)2中的一种,分别取少量样品进行下列实验,现象为:
在A中加C,无明显变化;
在A中加D,无明显变化;
在B中加D,生成沉淀E,并得到一种溶液;
在B中加C,生成沉淀并得到溶液F;
将少量E加入到过量F中,有气体放出.
(1)写化学式,B是??????????? ___,C是??????????? ___.
(2)如果将A和B混合,有关反应的离子方程式为??????????????????????? _________,将E加入过量F中,有关离子方程式??????????????????????? __________.
∑E(反应物)>∑E (生成物)——放热反应(能量释放)
∑E(反应物)<∑E(生成物)——吸热反应(能量贮存)生成物总能量低反应物总能量低生成物总能量高反应物总能量高
放热反应吸热反应十四.化学反应中的能量变化放热反应的类型:金属与酸的反应是放热反应。所有燃烧的反应是放热反应。酸与碱的中和反应是放热反应。大多数的化合反应是放热反应。生石灰溶于水是放热反应。吸热反应的类型:铵盐与碱的反应是吸热反应。以C、H2、CO作还原剂的氧化还原反应是吸热反应。大多数的分解反应是吸热反应。浓H2SO4、NaOH溶于水是 。放热过程铵盐溶于水是 。吸热过程燃料充分燃烧的条件:有足够多的空气与空气有足够大的接触面积下列说法正确的是:
1任何化学反应都伴有能量变化
2化学反应中的能量变化都表现为热量的变化。
3甲烷的燃烧是放热反应。
4氧化钙和水的反应是吸热反应。
5铝片与盐酸的反应是吸热反应。
6反应物的总能量低于生成物的总能量时,发生吸热反应。十五、钠钠:物性:银白色、硬度小、比水轻(密度小)、熔点低、易传导、导电化性:a.与氧气的反应:常温下生成Na2O,点燃下生成Na2O2
b.与水的反应:现象:浮、溶、游、响、红(酚酞)实质:钠置换水中的氢(置换)c.与酸的反应:直接与H+发生氧还反应(置换)d.与盐的反应:(1)水溶液:先与水反应,生成碱再与盐发生复分解反应(如与CuSO4溶液的反应)
(2)熔融:直接发生置换反应,如跟熔融的TiCl4反应生成钛存在:只以化合态存在,以NaCl为主,还有 Na2SO4、Na2CO3、NaNO3。
保存:密封保存,少量的钠保存在煤油中,较多时用铁桶盛装,石蜡密封。
用途:钾钠合金可以作反应堆的导热剂,用于冶炼金属钛锆铌钽,制造供氧剂(过氧化钠)生氢剂(氢化钠)
制法:电解熔融氯化钠生成金属钠和氯气
钠的化合物
(1)Na2O:白色固体、碱性氧化物、不稳定可以继续被氧化为Na2O2
(2)Na2O2:淡黄色固体,能跟水及CO2反应放出氧气(写出反应方程式)
(3)NaOH:俗名烧碱、火碱、苛性钠,白色固体易溶于水且放热,有强腐蚀性,易潮解(可作干燥剂)
(4)Na2CO3:易溶于水的白色粉末,与酸反应放出CO2,与Ca(OH)2反应生成CaCO3,NaCO3·10H2O易风化,可以制造玻璃、造纸、造皂、洗涤剂。
(5)NaHCO3:可溶于水的白色细小晶体,与酸反应放出CO2 ,与酸的反应速度比Na2CO3快,不稳定加热分解
递
变
性最外层都只有1个电子
核电荷数逐渐增大电子层数逐渐增多原子半径逐渐增大Li Na K Rb Cs
颜 色硬 度导电导热性密度变化熔沸点变化银白色(铯略显金色)柔 软很 强增大趋势
(钾钠反常)依次减小碱金属的物理性质碱金属的化学性质1.与非金属的反应
点燃
2Na+O2======Na2O2
点燃
4Li+O2======2Li2O
与水的反应2Na+2H2O====2NaOH +H2↑
2K+2H2O====2KOH+H2↑
2Rb+2H2O====2RbOH+H2↑
2Cs +2H2O====2CsOH+H2↑碱金属的规律与特例1.通常的合金多呈固态,而钠钾合金却是液态。
2.碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
3.碱金属单质的密度一般随核电荷数增大而递增,但K的密度比Na小。
4.碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。5.碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
6.碱金属的盐一般都易溶于水,但Li2CO3却微溶。
7.一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
8.碳酸盐与碳酸酸式盐的热稳定性一般说来,有下面规律:
①H2CO3②同一主族元素(如碱金属元素)的碳酸盐: Li2CO3③碱金属的碳酸盐>碱土金属的碳酸盐>过度元素的碳酸盐
(如Na2CO3>MgCO3>CuCO3)本章精华 七反应两焰色 2Na + O2 = Na2O2焰色:钠 - 黄色 钾 – 紫色(透过钴玻璃) 2Na + 2H2O = 2NaOH + H2 2Na2O2 + 2H2O = 4NaOH + O22Na2O2 + 2CO2 = 2Na2CO3 + O2NaHCO3 + HCl = NaCl + H2O + CO2NaHCO3 + NaOH = Na2CO3 + H2O 离子方程式的书写电子转移点燃 2NaHCO3 = Na2CO3 + H2O + CO2△洗、烧、蘸、烧洗:目的使铁丝上面的杂质转化为沸点相对较低的氯化物烧:目的是除去铁丝上的杂质蘸:蘸取被灼烧得物质烧:观察其火焰颜色用洁净的铂丝蘸取某无色溶液,进行焰色反应实验,观察火焰呈黄色,则下列判断正确的是
A.一定是钾、钠的混合物
B.一定含K+,可能含Na+
C.一定含Na+,可能含K+
D.既含K+,又含Na+C祝同学们中考取得好成绩!!
表现特征:元素化合价有升降。一、基本概念 一.基本概念判断下列哪些反应是氧化还原反应?理由?
1.? Na2O + H2O = 2NaOH 2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? IBr + H2O = HBr + HIO 4.? CH4 + Cl2 → CH3Cl + HCl
5. NaH + NH3 = NaNH2 + H2↑
光△ 还原剂 氧化剂 氧化产物
还原产物 +1-1 -3+1 +1-3+1 0下列叙述正确的是:
1.在氧化还原反应中,肯定有一种物质被氧化,另一种物质被还原。
2.没有单质参加的氧化还原反应一定不是氧化还原反应。
3.置换反应一定是氧化还原反应。
4.失电子难的物质容易获得电子。
5.得电子多的物质,它的氧化性强。二.守恒律守恒律——化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。除此之外,质量和原子个数也都守恒。
R2O8n-离子在一定条件下可将Mn2+离子氧化成MnO4-离子。若反应后R2O8n-变成RO42-,又知反应中氧化剂和还原剂的个数之比是5:2,则n值为
A、1????????B、2
C、3??????? D、4B三.价态律最高价——氧化性
最低价——还原性
中间价——既有氧化性又有还原性
物质含有多种元素,其性质是这些元素性质的终合体现。
例1、现有下列粒子①S ②S2- ③Na+ ④Fe2+ ⑤H+ ⑥Cu ⑦O2 ⑧HCl ⑨H2O ⑩SO2,其中在氧化还原反应中只能作还原剂的是 ,只能作氧化剂的是 ,既能作氧化剂又能作还原剂的是 。②⑥③⑤⑦①④⑧⑨⑩四.强弱律(1)较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。氧化剂的氧化性大于氧化产物的氧化性还原剂的还原性大于还原产物的还原性氧化性:
还原性: CuO > H2OH2 > CuA(2)根据金属活动性顺序进行判断K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au失电子能力逐渐减弱,还原性逐渐减弱K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ Hg+ Ag+得电子能力逐渐增强,氧化性逐渐增强(3)根据氧化还原反应进行的难易程度(反应条件)的不同进行判断 同种氧化剂和不同的还原剂反应,易发生反应的还原剂的还原性强;同种还原剂和不同的氧化剂反应,易发生反应的氧化剂的氧化性强。
前者比后者容易,可判断氧化性:KMnO4> MnO2 注:部分被氧化,部分被还原
3Cu+8HNO3=3Cu(NO3)2+2NO↑+ 4H2O
指出氧化剂,还原剂,氧化产物、还原产物。
指出被还原和未被还原的HNO3、的质量比。
指出HNO3的作用
五.歧化和归中歧化:同一元素的同一价态发生的氧化还原反应。
归中:同一元素的不同价态发生的氧化还原反应。归中规律同一元素不同价态原子间发生氧化还原反应: 高价态 + 低价态 → 中间价态
可归纳为:两相靠,不相交。
关系为:高到高,低到低。
根据这个规律:便于我们判断氧化产物和还原产物,标明电子转移关系。例如:下列反应中电子转移关系,依据归中规律,应为:KClO3+6HCl===KCl+3Cl2↑+3H2O
电子转移数目不是6e-而是5e-;Cl2既是氧化产物又是还原产物。
六.电解质㈠电解质和非电解质
1.电解质:在水溶液里或熔融状态下能够导电的化合物。例如酸、碱、盐等化合物是电解质。
2.非电解质:无论是在水溶液或熔融状态都不导电的化合物。例如,蔗糖、酒精、CO2、SO2、NH3等化合物是非电解质。
1.下列物质的水溶液能导电而本身不是电解质的是
A.氨气 B.硫酸
C.二氧化碳 D.硫酸钠
2.在某溶液中有K+、H+、SO42-、NO3-,则溶液中溶质的种类最多为
A.2种 B.3种
C.4种 D.5种ACD⑴强电解质:在水溶液里全部电离出离子的电解质叫做强电解质。如大多数盐类、强酸、强碱等。
KNO3、NaCl、CaCO3、BaSO4、NaHCO3、NaHSO4
HCl、HBr、HI、H2SO4、HNO3;
NaOH、KOH、Ba(OH)2、Ca(OH)2……七.强弱电解质⑵弱电解质:在水溶液里只有一部分分子电离出离子的电解质叫做弱电解质。如弱酸、弱碱、水、少数盐等。
HF,HCN,HNO2,HPO3,CH3COOH,
H2S ,H2SO3,H2SiO3,H2CO3;
H3PO4,H3AsO4,H4SiO4 ……
NH3·H2O,AgOH;Cu(OH)2,Zn(OH)2 ,
Sn(OH)2,Fe(OH)2,Pb(OH)2;
Fe(OH)3,Al(OH)3……
(CH3COO)2Pb4. 强、弱电解质对比下列叙述正确的是:
1强电解质的都是离子化合物,弱电解质都是共价化合物。
2.易溶于水的电解质一定是强电解质。
3.两种溶液中,导电能力强的的一定是强电解质。
4.强电解质溶解在水中全部电离。
5.氢氧化钠,硫酸钡,铜,蔗糖,二氧化硫都是强电解质。八.电解质导电导电性的强弱
在相同条件下,只取决于溶液中自由离子的浓度及其所带电荷的多少。八.电解质导电下列物质,当前者少量浓溶液加入后者溶液时,后者溶液导电能力明显增强的是
1.H2SO4,Ba(OH)2
2.NaOH,CH3COOH
3.HCl,Ba(OH)2
4.NaCl,AgNO3九.离子共存离子不能大量共存原因:
1.生成难溶物或微溶物;
2.生成气体或挥发性物质;
3.生成难电离物质
4.发生氧化还原反应:氧化性离子与还原性离子不能大量共存。
5.受酸、碱性环境的影响而不能大量共存。如弱酸根离子在酸性溶液中不能存在;弱酸的酸式根离子在酸性、碱性溶液中均不能存在。
下列各组离子,在强碱性溶液中可以大量共存的是(??? )
A.Cu2+、Cl-、NO3-、Na+
B.Na+、K+、NH4+、Ba2+
C.Br-、S2-、Cl-、CO32-???????????????????????????
D.SO3、NO3-、SO42-、HCO3-
C十.离子方程式书写拆写的原则
1.把易溶于水易电离的强电解质改写成离子
2.气体,单质,难溶的物质保留其化学式
Mg Cl2 CO2 CaCO3 AgCl
3.弱电解质(难电离的物质)保留其化学式
CH3COOH Cu(OH)2
4.氧化物和氮化物都保留其化学式
书写的特殊说明1.微溶的电解质
做反应物时,稀溶液用离子形式表示,悬浊液用化学式形式表示。
①澄清石灰水与碳酸钠溶液反应。
②石灰乳与盐酸反应。
做生成物时,用化学式表示。
①氯化钙溶液与烧碱溶液反应。
②硫酸钠溶液与氯化钙溶液反应。2.对阴、阳离子都参加反应的电解质,其阴、阳离子的个数比一般应符合实际组成。
①硫酸溶液与氢氧化钡溶液反应
3.固体间的反应,一般不写离子方程式;非水溶液中的反应,不能用离子方程式表示。
①碳酸氢钠加热分解
十一.离子方程式的意义CO32-+2H+==CO2 +H2O表示的意义。
可溶性碳酸盐与强酸的反应十二.离子方程式的正误判断下列离子方程式中错误的是(??? )
A.铁跟稀硫酸反应:2Fe+6H+==2Fe3++3H2↑
B.碳酸氢钙溶液跟盐酸反应:
Ca(HCO3)2+2H+ ==Ca2++2H2O+2CO2↑
C.醋酸跟氢氧化钾溶液反应:
CH3COOH+OH- == CH3COO-+H2O
D.碳酸镁跟强酸应: MgCO3+2H+==Mg2++H2O+CO2↑AB下列反应的离子方程式正确的是(??? )
A.碳酸氢钙溶液跟稀硝酸反应:
HCO3-+H+=H2O+CO2↑
B.饱和石灰水跟稀硝酸反应:
Ca(OH)2+2H+=Ca2++2H2O
C.向稀氨水中加入稀盐酸:
NH3·H2O+H+=NH4++H2O
D.碳酸钙溶于醋酸中:
CaCO3+2H+=Ca2++H2O+CO2↑
A C十三.离子的推断和鉴别有A、B、C、D四种溶液,它们各为K2CO3、K2SO4、H2SO4、Ba(NO3)2中的一种,分别取少量样品进行下列实验,现象为:
在A中加C,无明显变化;
在A中加D,无明显变化;
在B中加D,生成沉淀E,并得到一种溶液;
在B中加C,生成沉淀并得到溶液F;
将少量E加入到过量F中,有气体放出.
(1)写化学式,B是??????????? ___,C是??????????? ___.
(2)如果将A和B混合,有关反应的离子方程式为??????????????????????? _________,将E加入过量F中,有关离子方程式??????????????????????? __________.
∑E(反应物)>∑E (生成物)——放热反应(能量释放)
∑E(反应物)<∑E(生成物)——吸热反应(能量贮存)生成物总能量低反应物总能量低生成物总能量高反应物总能量高
放热反应吸热反应十四.化学反应中的能量变化放热反应的类型:金属与酸的反应是放热反应。所有燃烧的反应是放热反应。酸与碱的中和反应是放热反应。大多数的化合反应是放热反应。生石灰溶于水是放热反应。吸热反应的类型:铵盐与碱的反应是吸热反应。以C、H2、CO作还原剂的氧化还原反应是吸热反应。大多数的分解反应是吸热反应。浓H2SO4、NaOH溶于水是 。放热过程铵盐溶于水是 。吸热过程燃料充分燃烧的条件:有足够多的空气与空气有足够大的接触面积下列说法正确的是:
1任何化学反应都伴有能量变化
2化学反应中的能量变化都表现为热量的变化。
3甲烷的燃烧是放热反应。
4氧化钙和水的反应是吸热反应。
5铝片与盐酸的反应是吸热反应。
6反应物的总能量低于生成物的总能量时,发生吸热反应。十五、钠钠:物性:银白色、硬度小、比水轻(密度小)、熔点低、易传导、导电化性:a.与氧气的反应:常温下生成Na2O,点燃下生成Na2O2
b.与水的反应:现象:浮、溶、游、响、红(酚酞)实质:钠置换水中的氢(置换)c.与酸的反应:直接与H+发生氧还反应(置换)d.与盐的反应:(1)水溶液:先与水反应,生成碱再与盐发生复分解反应(如与CuSO4溶液的反应)
(2)熔融:直接发生置换反应,如跟熔融的TiCl4反应生成钛存在:只以化合态存在,以NaCl为主,还有 Na2SO4、Na2CO3、NaNO3。
保存:密封保存,少量的钠保存在煤油中,较多时用铁桶盛装,石蜡密封。
用途:钾钠合金可以作反应堆的导热剂,用于冶炼金属钛锆铌钽,制造供氧剂(过氧化钠)生氢剂(氢化钠)
制法:电解熔融氯化钠生成金属钠和氯气
钠的化合物
(1)Na2O:白色固体、碱性氧化物、不稳定可以继续被氧化为Na2O2
(2)Na2O2:淡黄色固体,能跟水及CO2反应放出氧气(写出反应方程式)
(3)NaOH:俗名烧碱、火碱、苛性钠,白色固体易溶于水且放热,有强腐蚀性,易潮解(可作干燥剂)
(4)Na2CO3:易溶于水的白色粉末,与酸反应放出CO2,与Ca(OH)2反应生成CaCO3,NaCO3·10H2O易风化,可以制造玻璃、造纸、造皂、洗涤剂。
(5)NaHCO3:可溶于水的白色细小晶体,与酸反应放出CO2 ,与酸的反应速度比Na2CO3快,不稳定加热分解
递
变
性最外层都只有1个电子
核电荷数逐渐增大电子层数逐渐增多原子半径逐渐增大Li Na K Rb Cs
颜 色硬 度导电导热性密度变化熔沸点变化银白色(铯略显金色)柔 软很 强增大趋势
(钾钠反常)依次减小碱金属的物理性质碱金属的化学性质1.与非金属的反应
点燃
2Na+O2======Na2O2
点燃
4Li+O2======2Li2O
与水的反应2Na+2H2O====2NaOH +H2↑
2K+2H2O====2KOH+H2↑
2Rb+2H2O====2RbOH+H2↑
2Cs +2H2O====2CsOH+H2↑碱金属的规律与特例1.通常的合金多呈固态,而钠钾合金却是液态。
2.碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
3.碱金属单质的密度一般随核电荷数增大而递增,但K的密度比Na小。
4.碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。5.碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
6.碱金属的盐一般都易溶于水,但Li2CO3却微溶。
7.一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
8.碳酸盐与碳酸酸式盐的热稳定性一般说来,有下面规律:
①H2CO3
(如Na2CO3>MgCO3>CuCO3)本章精华 七反应两焰色 2Na + O2 = Na2O2焰色:钠 - 黄色 钾 – 紫色(透过钴玻璃) 2Na + 2H2O = 2NaOH + H2 2Na2O2 + 2H2O = 4NaOH + O22Na2O2 + 2CO2 = 2Na2CO3 + O2NaHCO3 + HCl = NaCl + H2O + CO2NaHCO3 + NaOH = Na2CO3 + H2O 离子方程式的书写电子转移点燃 2NaHCO3 = Na2CO3 + H2O + CO2△洗、烧、蘸、烧洗:目的使铁丝上面的杂质转化为沸点相对较低的氯化物烧:目的是除去铁丝上的杂质蘸:蘸取被灼烧得物质烧:观察其火焰颜色用洁净的铂丝蘸取某无色溶液,进行焰色反应实验,观察火焰呈黄色,则下列判断正确的是
A.一定是钾、钠的混合物
B.一定含K+,可能含Na+
C.一定含Na+,可能含K+
D.既含K+,又含Na+C祝同学们中考取得好成绩!!
同课章节目录
