第四章复习[上学期]
图片预览









文档简介
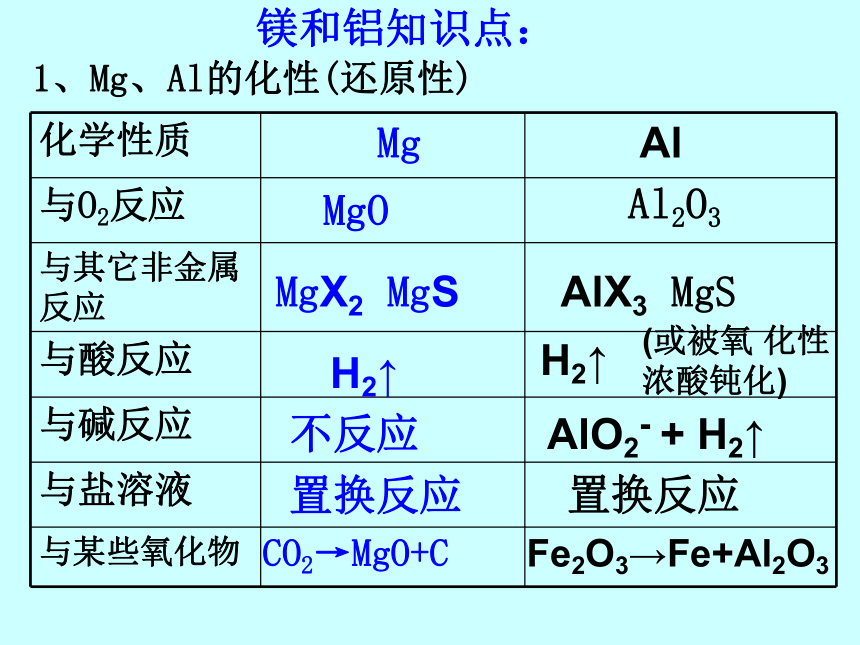
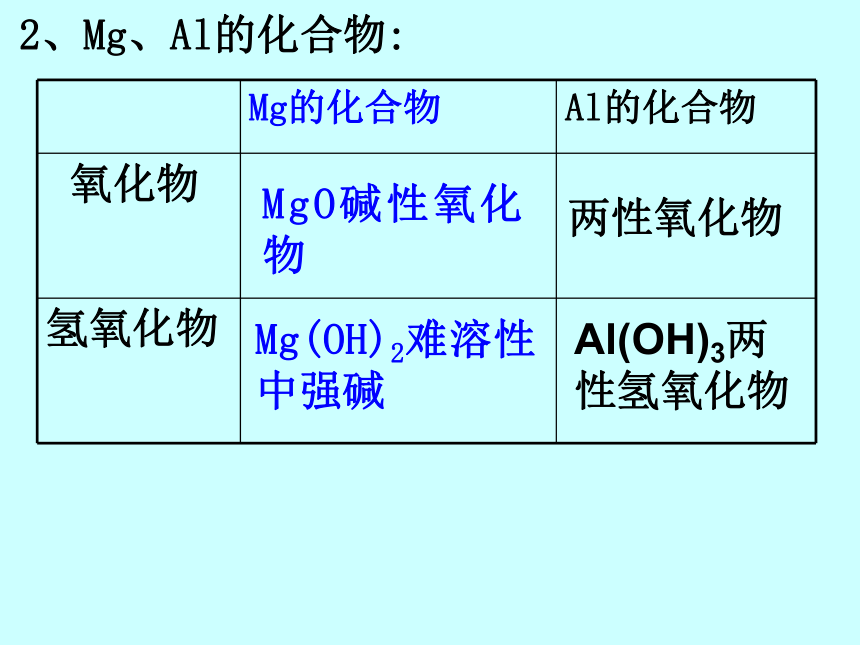
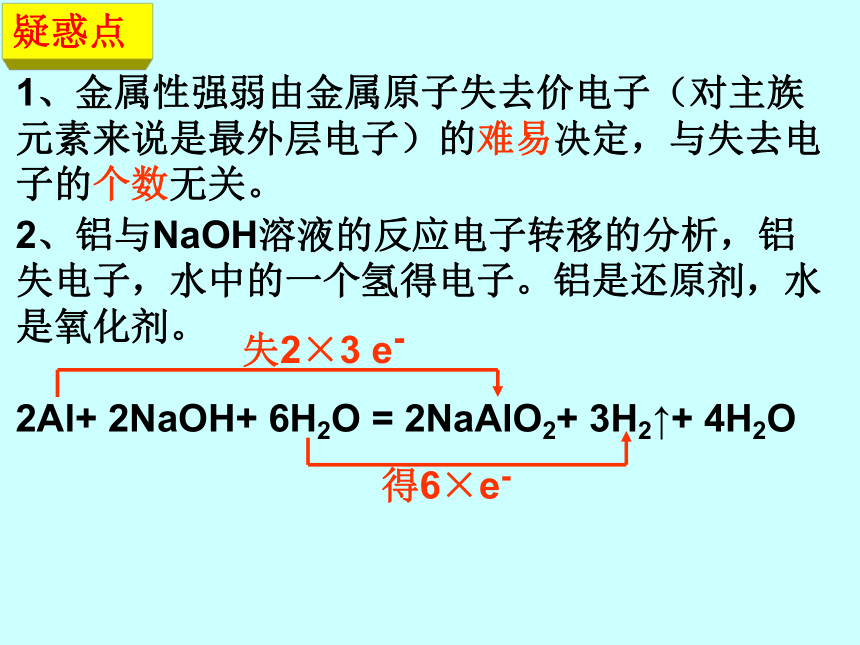
课件37张PPT。几种重要的金属镁 和 铝镁和铝知识点:1、Mg、Al的化性(还原性)MgOAl2O3MgX2 MgSAlX3 MgSH2↑H2↑不反应AlO2- + H2↑置换反应置换反应CO2→MgO+CFe2O3→Fe+Al2O3(或被氧 化性浓酸钝化)2、Mg、Al的化合物:MgO碱性氧化物两性氧化物Mg(OH)2难溶性中强碱 ? Al(OH)3两性氢氧化物疑惑点1、金属性强弱由金属原子失去价电子(对主族元素来说是最外层电子)的难易决定,与失去电子的个数无关。2、铝与NaOH溶液的反应电子转移的分析,铝失电子,水中的一个氢得电子。铝是还原剂,水是氧化剂。
2Al+ 2NaOH+ 6H2O = 2NaAlO2+ 3H2↑+ 4H2O失2×3 e-得6×e-3、Mg(OH)2无两性,只与酸反应,不与碱反应。Al3+和AlO2-不能共存,二者相遇发生如下反应:
3AlO2- + Al3+ + 6H2O = 4Al(OH)3↓若加入碱,,平衡左移, 所以AlO2-存在于碱性环境。若加入酸,平衡右移,所以Al3+存在于酸性环境。5、给出 Al(OH)3 的量,求反应物碱的量的选择题,很可能有两个正确选项,即碱过量或不足。例:100mL 0.60mol/L AlCl3溶液与一定量 0.40mol/L NaOH溶液混合后,得到3.9g 沉淀,求 NaOH 溶液的体积。375mL 475mL1. 镁遇到下列物质不放出H2的是: ( ) ①NH4Cl溶液? ②KOH溶液? ③Na2CO3溶液 ?
④热的醇? ⑤苯? ⑥醋酸溶液? ⑦FeCl3 溶液 ⑧CuSO4 溶液 ⑨ NaH2PO4 ⑩NaHCO3 溶液 (A) ①⑥⑦⑧? (B) ③④⑤⑨⑩?
(C) ②③⑤⑩? (D) ③④⑤⑦
练 习C2、铝热反应说明了
A、铝的密度小、熔点较低
B、氧化铝具有氧化性
C、氧化铁等金属氧化物具有氧化性
D、铝具有还原性
C D3、镁粉中混进少量铝粉,将铝粉除去可选用的试剂是 ( )
4、铝粉中混进少量镁粉,将镁粉除去可选用的试剂是 ( )
A、盐酸B、CuSO4 溶液 C、NaOH 溶液D、浓硝酸 A、盐酸B、CuSO4 溶液 C、NaOH 溶液D、浓硝酸 CD5、将两份铝粉分别与稀盐酸和烧碱溶液反应,若在相同状况下生成的氢气的体积相等,则两份铝的质量比为 。 6、有等质量的铝粉和镁粉,将镁粉和足量稀盐酸反应,铝粉和足量烧碱溶液反应,若在相同状况下生成的氢气的体积相等,则铝粉和镁粉的质量比为 。 1:13:4铁和铁的化合物铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体碱 性 氧 化 物都能与酸反应。如铁的氧化物FeOFe2O3Fe3O4铁的氢氧化物化学式色 态溶解性碱性热稳定性与酸的作用
Fe(OH)2白色固体难溶于水Fe(OH)3红褐色固体难溶于水弱碱 弱碱 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 0加热分解加热分解与O2的作用4Fe(OH)2+O2+2H2O=4Fe(OH)3 不反应名 称氢氧化亚铁氢氧化铁Fe3+、Cu2+、Ag+、H+、I2、S锌、CO、Al
Cl2、Br2、浓H2SO4、浓HNO3锌、CO、H2、AlCl2、Br2、O2、HNO3、KMnO4、K2Cr2O7、H2O2铁、锌、Cu、I-、S2-、SO32-、HS-、Sn2+注意:方程式的书写。?铁及其化合物的相互转化 — 铁三角铁Fe3+Fe2+HClO2、H2OH2SO4NaOHH2SO4H2SO4Cl2FeCl2HClNaOHSCN-O2O2O2H2SO4HCl? Fe2+ 与 Fe3+ 的检验方法。
⑴ 观察溶液的颜色。
⑵ 加碱溶液。
⑶ 加 SCN- 溶液。
⑷ 加苯酚、H2S、Na2CO3 溶液等立即产生红褐
色沉淀 直 接 观 色与KSCN与苯 酚显色反应
利 用 的氧化性
利 用与 铜 片与淀粉KI
试纸鉴 别方 法 浅 绿 色 棕 黄 色血 红 色不显红色不显紫色 显 紫 色无明显现象 Cu被腐蚀
溶液变绿色试纸不变蓝 试纸变蓝色利用沉淀反应
与OH-作用白色沉淀迅速变灰
绿色最后呈红褐色Fe2+Fe3+方法一:用不含 Fe3+ 的 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入?
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色氢氧化亚铁沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的理由是?
铁粉和少量H2SO4加热煮沸避免带入空气而使Fe(OH)2氧化,从而导致看不到白色沉淀。例. 用下面两种方法可以制得白色的Fe(OH)2沉淀。方法二:在如图装置中,用 NaOH溶液、铁屑、稀 H2SO4 等试剂制备。
(1)在试管Ⅰ里加入的试剂是:
(2)在试管Ⅱ里加入的试剂是 :
(3)为了制得白色的氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是 ? (1) 稀H2SO4和Fe(2) NaOH溶液(3) 打开止水夹,使Ⅰ管开始反应一段时间后再夹紧止水夹(4) 容器内只有H2而无空气, Fe(OH)2不易被氧化◆ 迷惑点
1、铁元素有可变价。这也是过渡元素的特点,铁的价态与氧化剂的强弱有关,遇强氧化剂,如Cl2,表现 +3 价,遇弱氧化剂,表现 +2 价。2、Fe(OH)2 制备实验中的问题:配制溶液用的蒸馏水必须煮沸,目的只除去其中的氧。使用长滴管,插入到盛有 FeSO4 溶液的试管底部.这是在滴管使用中唯一的一次例外,允许伸到试管内,其他场合应在管口上方自然垂直。
? 离子共存问题:
⑴Fe2+:在酸性条件下不能与氧化性离子大量共存,如硝酸根、高锰酸根、次氯酸根等。也不能与发生复分解反应的离子大量共存。⑵ Fe3+:不能与还原性离子大量共存。如:I-、S2- 等。也不能与发生复分解反应和双水解反应。的离子大量共存。? 盐溶液的配制和保存:
⑴Fe2+盐:晶体密闭保存。配制溶液时应加铁粉和少量酸。 ⑵ Fe3+盐:FeCl3易潮解,需密闭保存。配制溶液时应将Fe3+盐溶于相应酸中,再加水稀释到所需浓度,已抑制其水解。实际使用:存在形态:单质或合金化合态(游离态)(+n)(0)还原反应?金属冶炼的实质:用还原剂把金属矿石中的金属离子还原为金属单质 Mn+ + e- = M n◆ 金属的冶炼? 金属的冶炼步骤:
一般需要三个步骤:第一步是矿石的富集,除去杂质,提高矿石中有用成分的含量;第二步是冶炼,利用氧化还原反应原理,在一定条件下,用还原剂把金属矿石中的金属离子还原成金属单质;第三步是精炼,采用一定的方法,提炼纯金属。? 金属冶炼的常见方法: ⑴热分解法:在金属活动性顺序中,位于氢后面的金属的氧化物受热就能分解,仅用热分解法就能制得这些不活泼金属。如 2HgO == 2Hg + O2 ↑ 2Ag2O == 4Ag + O2 ↑ △△⑵热还原法:对于多数金属的冶炼,常用的还原剂如焦炭、CO、氢气和活泼金属等加热还原的方法。
如MgO + C === Mg + CO↑ ⑶电解法:在金属活动性顺序中,K、Na、Ca、Al 等几种金属的还原性很强,只能用通电分解其熔融盐或氧化物的方法来冶炼
2NaCl === 2Na + Cl2 ↑ 2Al2O3=== 4Al + 3O2↑高温高温(熔融)高温(熔融)◆ 迷惑点:
利用平衡理论解释用较不活泼金属制较活泼金属(如工业上用钠从熔融的KCl中置换生产钾)例:工业上生产 Na、Ca、Mg 都用电解其熔融态的氯化物。但钾却不能用电解 KCl 熔融态的方法制得,因金属钾易溶于熔融态的 KCl 中而有危险,很难制得钾,且降低电解效率。现生产钾是用金属钠与熔化的 KCl 反应制得。有关数据如下表。⑴工业上生产金属钾主要运用上表所列哪些物理常数,简答理由。
⑵工业上制金属钾主要运用什么原理使该反应变为现实?答案:⑴应用钠和钾的沸点不同,774℃时,钾为蒸气逸出,而钠为液体,故控制温度在774℃至883℃(略低)即可。⑵应用化学平衡移动的原理。铁、铝计算题中的代换简化策略 一、依结合方式代换简化 例1、将一定量的Fe、FeO和Fe2O3的混合物投入250mol、2mol/L的HNO3溶液中,固体完全溶解后,生成1.12L(标况)NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1mol/L的NaOH溶液,要使Fe元素完全沉淀下来,所加入NaOH溶液的体积最少是
A、450ml B、500ml
C、400ml D、无法确定A例2、将镁、铝的混合物0.1mol溶于100mL、2mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液。请回答:(1)若在滴加NaOH的过程中,沉淀的质量随加入的NaOH溶液的体积变化如下图所示。当v1=160ml时,则金属粉末中 n(Mg)= mol ,v2= ml。
(2)若在滴加NaOH的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V= ml。 M0v1v2V(NaOH)0.06440400例3、有一铁的氧化物样品。用5mol/L的HCl 40 ml恰好完全溶解,所得溶液还能吸收标况下0.56L的Cl2。Fe2+全部转化为Fe3+,该氧化物可能的化学式为( ) A、Fe2O3 B、Fe3O4
C、3FeO·Fe2O3 D、Fe5O6C D二、电量守恒的代换简化 例4、Na2O2、HCl和Al2O3在水中反应,若最后溶液中只含 AlO2-、Na+、Cl-,而不含Al3+,则 Na2O2、HCl 和 Al2O3 物质的量之比为( )
A、4:6:1 B、8:6:1
C、3:3:1 D、4:6:3A例5、镁条在空气中燃烧生成MgO和Mg3N2,将燃烧产物溶于60ml浓度为2mol/L的HCl溶液中。以20ml、0.5mol/L NaOH溶液中和多余的盐酸,然后在溶液中加入过量的NaOH溶液,并加热使NH3全部蒸发,再用稀HCl吸收NH3,使此HCl增重0.17g,则Mg 条的质量是( )
A、0.6g B、1.2g C、2.4g D、3.6g B三、化合价的代换简化 例6、在v L AL2(SO4)3溶液中通入过量的NH3,使Al(OH)3沉淀过滤,灼烧、电解,然后于适量的铁红混合加热,再将加热后的产物用NaOH处理,最后可得m克固体。原溶液中SO42-的物质的量浓度为 A、3m/112v mol/L B、3m/56v mol/L
C、m/112v mol/L D、m/34v mol/LA四、等质量的代换简化 例7、向4克由Fe、Al、Ba、Si组成的合金样品中加入20克20%的盐酸,恰好完全反应。经测定知所生成的混合氯化物粉末中含氯50%,则合金中金属的质量为 A、0.9426 B、0.9526
C、0.9626 D、0.9726D
2Al+ 2NaOH+ 6H2O = 2NaAlO2+ 3H2↑+ 4H2O失2×3 e-得6×e-3、Mg(OH)2无两性,只与酸反应,不与碱反应。Al3+和AlO2-不能共存,二者相遇发生如下反应:
3AlO2- + Al3+ + 6H2O = 4Al(OH)3↓若加入碱,,平衡左移, 所以AlO2-存在于碱性环境。若加入酸,平衡右移,所以Al3+存在于酸性环境。5、给出 Al(OH)3 的量,求反应物碱的量的选择题,很可能有两个正确选项,即碱过量或不足。例:100mL 0.60mol/L AlCl3溶液与一定量 0.40mol/L NaOH溶液混合后,得到3.9g 沉淀,求 NaOH 溶液的体积。375mL 475mL1. 镁遇到下列物质不放出H2的是: ( ) ①NH4Cl溶液? ②KOH溶液? ③Na2CO3溶液 ?
④热的醇? ⑤苯? ⑥醋酸溶液? ⑦FeCl3 溶液 ⑧CuSO4 溶液 ⑨ NaH2PO4 ⑩NaHCO3 溶液 (A) ①⑥⑦⑧? (B) ③④⑤⑨⑩?
(C) ②③⑤⑩? (D) ③④⑤⑦
练 习C2、铝热反应说明了
A、铝的密度小、熔点较低
B、氧化铝具有氧化性
C、氧化铁等金属氧化物具有氧化性
D、铝具有还原性
C D3、镁粉中混进少量铝粉,将铝粉除去可选用的试剂是 ( )
4、铝粉中混进少量镁粉,将镁粉除去可选用的试剂是 ( )
A、盐酸B、CuSO4 溶液 C、NaOH 溶液D、浓硝酸 A、盐酸B、CuSO4 溶液 C、NaOH 溶液D、浓硝酸 CD5、将两份铝粉分别与稀盐酸和烧碱溶液反应,若在相同状况下生成的氢气的体积相等,则两份铝的质量比为 。 6、有等质量的铝粉和镁粉,将镁粉和足量稀盐酸反应,铝粉和足量烧碱溶液反应,若在相同状况下生成的氢气的体积相等,则铝粉和镁粉的质量比为 。 1:13:4铁和铁的化合物铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体碱 性 氧 化 物都能与酸反应。如铁的氧化物FeOFe2O3Fe3O4铁的氢氧化物化学式色 态溶解性碱性热稳定性与酸的作用
Fe(OH)2白色固体难溶于水Fe(OH)3红褐色固体难溶于水弱碱 弱碱 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O 0加热分解加热分解与O2的作用4Fe(OH)2+O2+2H2O=4Fe(OH)3 不反应名 称氢氧化亚铁氢氧化铁Fe3+、Cu2+、Ag+、H+、I2、S锌、CO、Al
Cl2、Br2、浓H2SO4、浓HNO3锌、CO、H2、AlCl2、Br2、O2、HNO3、KMnO4、K2Cr2O7、H2O2铁、锌、Cu、I-、S2-、SO32-、HS-、Sn2+注意:方程式的书写。?铁及其化合物的相互转化 — 铁三角铁Fe3+Fe2+HClO2、H2OH2SO4NaOHH2SO4H2SO4Cl2FeCl2HClNaOHSCN-O2O2O2H2SO4HCl? Fe2+ 与 Fe3+ 的检验方法。
⑴ 观察溶液的颜色。
⑵ 加碱溶液。
⑶ 加 SCN- 溶液。
⑷ 加苯酚、H2S、Na2CO3 溶液等立即产生红褐
色沉淀 直 接 观 色与KSCN与苯 酚显色反应
利 用 的氧化性
利 用与 铜 片与淀粉KI
试纸鉴 别方 法 浅 绿 色 棕 黄 色血 红 色不显红色不显紫色 显 紫 色无明显现象 Cu被腐蚀
溶液变绿色试纸不变蓝 试纸变蓝色利用沉淀反应
与OH-作用白色沉淀迅速变灰
绿色最后呈红褐色Fe2+Fe3+方法一:用不含 Fe3+ 的 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入?
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色氢氧化亚铁沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的理由是?
铁粉和少量H2SO4加热煮沸避免带入空气而使Fe(OH)2氧化,从而导致看不到白色沉淀。例. 用下面两种方法可以制得白色的Fe(OH)2沉淀。方法二:在如图装置中,用 NaOH溶液、铁屑、稀 H2SO4 等试剂制备。
(1)在试管Ⅰ里加入的试剂是:
(2)在试管Ⅱ里加入的试剂是 :
(3)为了制得白色的氢氧化亚铁沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是:
(4)这样生成的氢氧化亚铁沉淀能较长时间保持白色,其理由是 ? (1) 稀H2SO4和Fe(2) NaOH溶液(3) 打开止水夹,使Ⅰ管开始反应一段时间后再夹紧止水夹(4) 容器内只有H2而无空气, Fe(OH)2不易被氧化◆ 迷惑点
1、铁元素有可变价。这也是过渡元素的特点,铁的价态与氧化剂的强弱有关,遇强氧化剂,如Cl2,表现 +3 价,遇弱氧化剂,表现 +2 价。2、Fe(OH)2 制备实验中的问题:配制溶液用的蒸馏水必须煮沸,目的只除去其中的氧。使用长滴管,插入到盛有 FeSO4 溶液的试管底部.这是在滴管使用中唯一的一次例外,允许伸到试管内,其他场合应在管口上方自然垂直。
? 离子共存问题:
⑴Fe2+:在酸性条件下不能与氧化性离子大量共存,如硝酸根、高锰酸根、次氯酸根等。也不能与发生复分解反应的离子大量共存。⑵ Fe3+:不能与还原性离子大量共存。如:I-、S2- 等。也不能与发生复分解反应和双水解反应。的离子大量共存。? 盐溶液的配制和保存:
⑴Fe2+盐:晶体密闭保存。配制溶液时应加铁粉和少量酸。 ⑵ Fe3+盐:FeCl3易潮解,需密闭保存。配制溶液时应将Fe3+盐溶于相应酸中,再加水稀释到所需浓度,已抑制其水解。实际使用:存在形态:单质或合金化合态(游离态)(+n)(0)还原反应?金属冶炼的实质:用还原剂把金属矿石中的金属离子还原为金属单质 Mn+ + e- = M n◆ 金属的冶炼? 金属的冶炼步骤:
一般需要三个步骤:第一步是矿石的富集,除去杂质,提高矿石中有用成分的含量;第二步是冶炼,利用氧化还原反应原理,在一定条件下,用还原剂把金属矿石中的金属离子还原成金属单质;第三步是精炼,采用一定的方法,提炼纯金属。? 金属冶炼的常见方法: ⑴热分解法:在金属活动性顺序中,位于氢后面的金属的氧化物受热就能分解,仅用热分解法就能制得这些不活泼金属。如 2HgO == 2Hg + O2 ↑ 2Ag2O == 4Ag + O2 ↑ △△⑵热还原法:对于多数金属的冶炼,常用的还原剂如焦炭、CO、氢气和活泼金属等加热还原的方法。
如MgO + C === Mg + CO↑ ⑶电解法:在金属活动性顺序中,K、Na、Ca、Al 等几种金属的还原性很强,只能用通电分解其熔融盐或氧化物的方法来冶炼
2NaCl === 2Na + Cl2 ↑ 2Al2O3=== 4Al + 3O2↑高温高温(熔融)高温(熔融)◆ 迷惑点:
利用平衡理论解释用较不活泼金属制较活泼金属(如工业上用钠从熔融的KCl中置换生产钾)例:工业上生产 Na、Ca、Mg 都用电解其熔融态的氯化物。但钾却不能用电解 KCl 熔融态的方法制得,因金属钾易溶于熔融态的 KCl 中而有危险,很难制得钾,且降低电解效率。现生产钾是用金属钠与熔化的 KCl 反应制得。有关数据如下表。⑴工业上生产金属钾主要运用上表所列哪些物理常数,简答理由。
⑵工业上制金属钾主要运用什么原理使该反应变为现实?答案:⑴应用钠和钾的沸点不同,774℃时,钾为蒸气逸出,而钠为液体,故控制温度在774℃至883℃(略低)即可。⑵应用化学平衡移动的原理。铁、铝计算题中的代换简化策略 一、依结合方式代换简化 例1、将一定量的Fe、FeO和Fe2O3的混合物投入250mol、2mol/L的HNO3溶液中,固体完全溶解后,生成1.12L(标况)NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1mol/L的NaOH溶液,要使Fe元素完全沉淀下来,所加入NaOH溶液的体积最少是
A、450ml B、500ml
C、400ml D、无法确定A例2、将镁、铝的混合物0.1mol溶于100mL、2mol/L的H2SO4溶液中,然后再滴加1mol/L的NaOH溶液。请回答:(1)若在滴加NaOH的过程中,沉淀的质量随加入的NaOH溶液的体积变化如下图所示。当v1=160ml时,则金属粉末中 n(Mg)= mol ,v2= ml。
(2)若在滴加NaOH的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V= ml。 M0v1v2V(NaOH)0.06440400例3、有一铁的氧化物样品。用5mol/L的HCl 40 ml恰好完全溶解,所得溶液还能吸收标况下0.56L的Cl2。Fe2+全部转化为Fe3+,该氧化物可能的化学式为( ) A、Fe2O3 B、Fe3O4
C、3FeO·Fe2O3 D、Fe5O6C D二、电量守恒的代换简化 例4、Na2O2、HCl和Al2O3在水中反应,若最后溶液中只含 AlO2-、Na+、Cl-,而不含Al3+,则 Na2O2、HCl 和 Al2O3 物质的量之比为( )
A、4:6:1 B、8:6:1
C、3:3:1 D、4:6:3A例5、镁条在空气中燃烧生成MgO和Mg3N2,将燃烧产物溶于60ml浓度为2mol/L的HCl溶液中。以20ml、0.5mol/L NaOH溶液中和多余的盐酸,然后在溶液中加入过量的NaOH溶液,并加热使NH3全部蒸发,再用稀HCl吸收NH3,使此HCl增重0.17g,则Mg 条的质量是( )
A、0.6g B、1.2g C、2.4g D、3.6g B三、化合价的代换简化 例6、在v L AL2(SO4)3溶液中通入过量的NH3,使Al(OH)3沉淀过滤,灼烧、电解,然后于适量的铁红混合加热,再将加热后的产物用NaOH处理,最后可得m克固体。原溶液中SO42-的物质的量浓度为 A、3m/112v mol/L B、3m/56v mol/L
C、m/112v mol/L D、m/34v mol/LA四、等质量的代换简化 例7、向4克由Fe、Al、Ba、Si组成的合金样品中加入20克20%的盐酸,恰好完全反应。经测定知所生成的混合氯化物粉末中含氯50%,则合金中金属的质量为 A、0.9426 B、0.9526
C、0.9626 D、0.9726D
同课章节目录
