综合科复习-必修1第一章第一单元[下学期]
文档属性
| 名称 | 综合科复习-必修1第一章第一单元[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 17.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-01 22:20:00 | ||
图片预览





文档简介
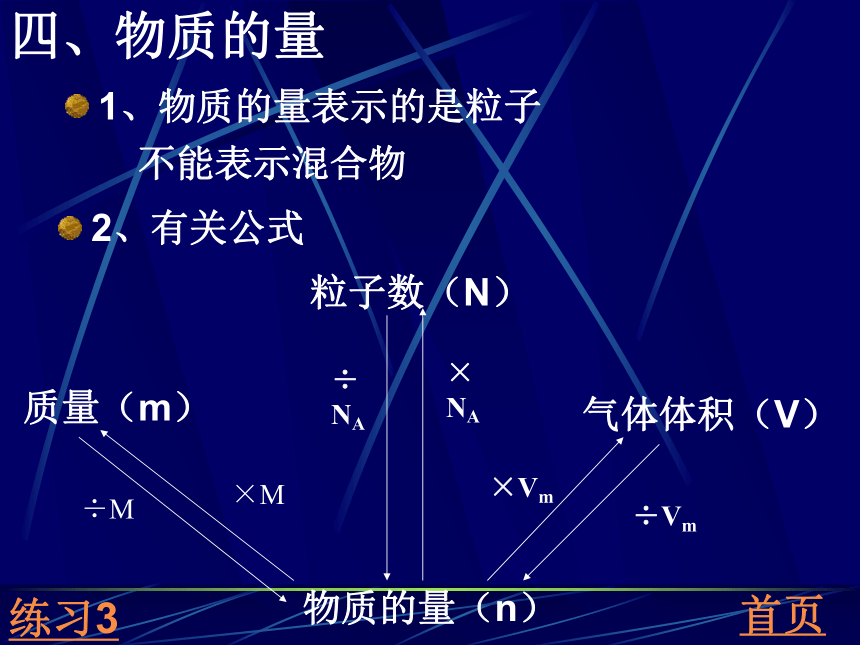
课件12张PPT。第一章复习一 实验基本操作二 混合物的分离和提纯三 常见离子的检验四 物质的量及其有关关系五 物质的量浓度溶液的配制一、基本实验操作1、溶解:烧杯、玻璃棒2、过滤——分离不溶物漏斗、玻璃棒、烧杯——一贴二低三靠3、蒸发玻璃棒、蒸发皿、烧杯析出大量的晶体时停止加热4、蒸馏——沸点不同的物质蒸馏烧瓶、酒精灯、冷凝管、温度计温度计在支管口、水从下往上(逆流)5、萃取——溶解度差别大分液漏斗、烧杯首页分液漏斗:检漏,上口倒,下口流萃取剂:不溶于水,溶质在其的溶解度大练习11、物理方法二、混合物的分离和提纯过滤、蒸馏、萃取2、化学方法(1)与杂质反应而不跟被提纯物反应(2)不能引入新杂质(3)多种杂质 要考虑除杂顺序首页(4)一般加适量除杂试剂(5)为了除尽则过量应再除去过量试剂1、SO42-三、常见离子的检验试剂:先加入盐酸,再加入氯化钡2、Cl-试剂:硝酸银+稀硝酸练习2首页现象:先没有沉淀,后有白色沉淀现象:白色沉淀3、CO32-试剂:稀盐酸,澄清石灰水现象:无色无味气体,石灰水变浑浊四、物质的量1、物质的量表示的是粒子不能表示混合物2、有关公式首页÷ NA×NA ÷M ×M ×Vm ÷Vm 练习31、n=cVV指的是溶液的体积,不能简单的用水的体积或水和溶质的体积和代替。2、配溶液:(1)固体称:m=nM=cVM(天平)(2) 溶解、冷却(3)转移、洗涤五、物质的量浓度液体量(筒):V(浓)=c(稀)V(稀)/c(浓)(4)定容(5)摇匀3、容量瓶的使用结构:温度、刻度线、规格使用前要先检漏4、托盘天平的使用5、误差的处理(1)容量瓶中有水——没有影响处理方法——重新配制(2)转移有液体溅出——偏小(3)没有冷却——一般偏大(4)定容超过了刻度线——偏小练习4练习11、下列仪器中,具有能溶解固体、配制溶液、加热较多试剂三种用途的是
A、锥形瓶 B、烧杯
C、量筒 D、试管2、下列实验操作错误的是
A、用药匙或镊子去用固体药品
B、用酒精灯外焰给物质加热
C、蒸发溶液时用玻璃棒不断搅拌
D、称量时将砝码放在左盘返回BD1、用过滤的方法可以分离的一组是
A、硝酸钾和氯化钠 B、碳酸钠和碳酸钙
C、硫酸铜和硫酸 D、蔗糖和氯化钠2、由于操作不慎在氯化钠溶液中混入了碳酸钠溶液,将其除去的操作是
A、加适量硫酸,搅拌,至不再有气泡
B、加适量盐酸,搅拌,至不再有气泡
C、加适量石灰水,过滤
D、加适量氯化钙溶液,过滤首页练习2BB1、在0.5molH2O中
A、含0.5molH B、含1个水分子
C、约含NA个O D、约含0.5NA个水分子
2、下列物质中所含分子物质的量最多的是
A、56gN2 B、1.5molO2
C、100gCl2 D、3.01*1023个硫酸分子
3、在标准状况下,体积与12gH2相同的N2的
A、质量为12克 B、物质的量为6mol
C、体积为22.4L D、物质的量为12mol首页练习3DCB练习41、下列溶液,溶质物质的量浓度为0.1mol/L的是
A、1L溶液中含4gNaOH
B、1L溶液中含0.1gNaOH
C、0.5L溶液中含0.2molH2SO4
D、1L溶液中含19.6gH2SO4
2、2gNaOH固体溶于水配成250mL溶液,取出其中50mL,该50mLNaOH溶液的浓度为
A、0.04mol/L B、 0.2mol/L
C、1mol/L D、 2mol/L AB
A、锥形瓶 B、烧杯
C、量筒 D、试管2、下列实验操作错误的是
A、用药匙或镊子去用固体药品
B、用酒精灯外焰给物质加热
C、蒸发溶液时用玻璃棒不断搅拌
D、称量时将砝码放在左盘返回BD1、用过滤的方法可以分离的一组是
A、硝酸钾和氯化钠 B、碳酸钠和碳酸钙
C、硫酸铜和硫酸 D、蔗糖和氯化钠2、由于操作不慎在氯化钠溶液中混入了碳酸钠溶液,将其除去的操作是
A、加适量硫酸,搅拌,至不再有气泡
B、加适量盐酸,搅拌,至不再有气泡
C、加适量石灰水,过滤
D、加适量氯化钙溶液,过滤首页练习2BB1、在0.5molH2O中
A、含0.5molH B、含1个水分子
C、约含NA个O D、约含0.5NA个水分子
2、下列物质中所含分子物质的量最多的是
A、56gN2 B、1.5molO2
C、100gCl2 D、3.01*1023个硫酸分子
3、在标准状况下,体积与12gH2相同的N2的
A、质量为12克 B、物质的量为6mol
C、体积为22.4L D、物质的量为12mol首页练习3DCB练习41、下列溶液,溶质物质的量浓度为0.1mol/L的是
A、1L溶液中含4gNaOH
B、1L溶液中含0.1gNaOH
C、0.5L溶液中含0.2molH2SO4
D、1L溶液中含19.6gH2SO4
2、2gNaOH固体溶于水配成250mL溶液,取出其中50mL,该50mLNaOH溶液的浓度为
A、0.04mol/L B、 0.2mol/L
C、1mol/L D、 2mol/L AB
同课章节目录
