第一章复习课[下学期]
图片预览





文档简介
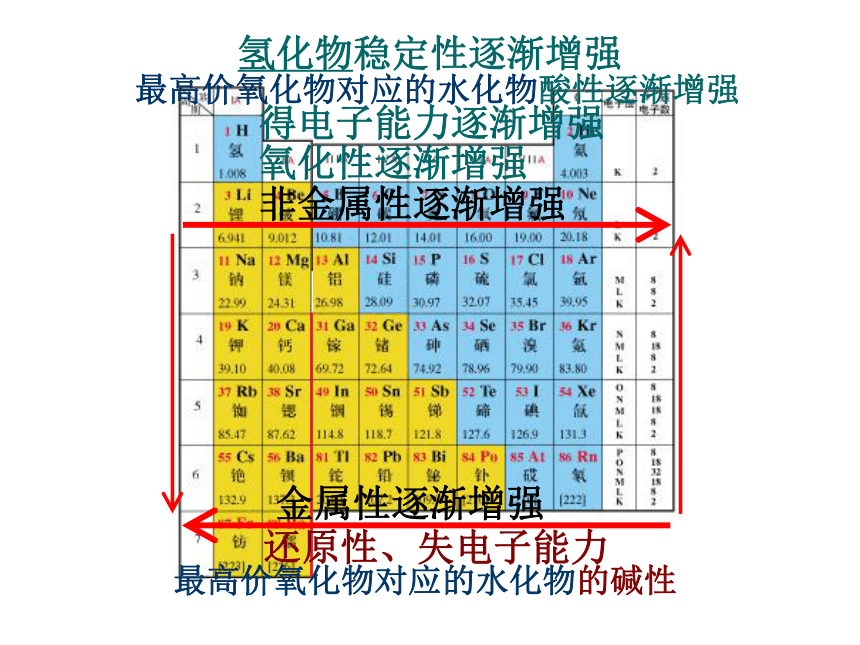
课件17张PPT。物质结构 元素周期律复习课非金属性逐渐增强氧化性逐渐增强得电子能力逐渐增强最高价氧化物对应的水化物酸性逐渐增强氢化物稳定性逐渐增强金属性逐渐增强还原性、失电子能力最高价氧化物对应的水化物的碱性习题选讲1、X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,则下列关系正确的是( )
A、a-c=m-n B、a-b=n-m
C、c-d=m+n D、b-d=n+mD2、根据中学化学所附元素周期表判断,下列叙述不正确的是( )
A、K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B、L层电子为奇数的所有元素所在的族序数与该原子的L层电子数相等
C、L层电子为偶数的所有元素所在的族序数与该原子的L层电子数相等
D、M层电子为奇数的所有元素所在的族序数与该原子的M层电子数相等C3、在第n电子层中,当它为最外层时容纳电子数最多与n-1层相同,当它作为次外层时,其电子比n-1层最多能多10个电子,则n为( )
A、L层 B、M层
C、N层 D、无法确定
4、若短周期中两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是( )
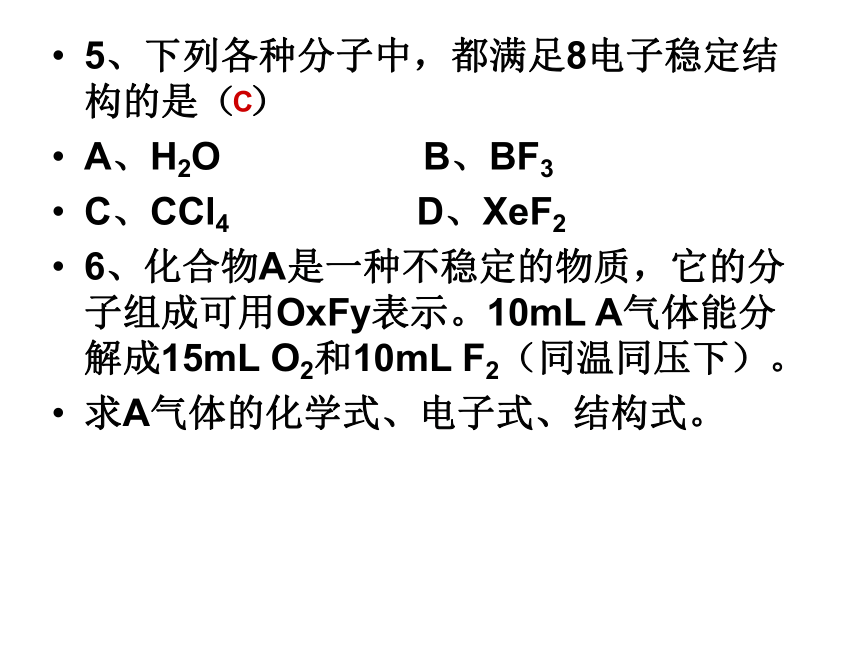
A、1 B、3 C、5 D、6BD5、下列各种分子中,都满足8电子稳定结构的是( )
A、H2O B、BF3
C、CCl4 D、XeF2
6、化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mL A气体能分解成15mL O2和10mL F2(同温同压下)。
求A气体的化学式、电子式、结构式。C7、甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A、x+2 B、x+4
C、x+8 D、x+18
8、下列叙述错误的是( )
A、原子半径:Cl>S>O
B、还原性:Na>Mg>Al
C、稳定性:HF>HCl>HBr
D、酸性:HClO4>H2SO4>H3PO4BA9、R元素气态氢化物的化学式为RH3,则R元素最高价氧化物的化学式是( )
A、R2O5 B、RO2 C、RO3 D、R2O7
10、短周期的三种元素分别为X、Y和Z,已知X元素的原子的最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L层电子总数少2。则这三种元素组成的化合物不可能是:
A、X2YZ4 B、XYZ3
C、X3YZ4 D、X4Y2Z7AA作业熟背元素周期表主族
整理第一章知识点(明天交)11、N的质量数为14,在粒子NH3T+中,
电子数:质子数:中子=?
12、同温同压下,对于等质量的H2、D2、T2三种气体,试计算:
(1)物质的量之比
(2)质子数之比
(3)中子数之比
(4)密度比同位素计算13、某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A B
C DC核外电子排布计算14、同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z
B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:X>Y>Z BD元素周期律应用15、据报道,某地一辆满载砒霜的在货车翻下山坡,滑下车道,部分砒霜落入河中。砒霜的主要成分是As2O3,剧毒,致死量为0.1g,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水,生成H3AsO3;其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水。根据以上信息判断,下列说法正确的是( )
A、As2O3是离子化合物
B、As2O3是砷酸的酸酐
C、可向该河中撒入生石灰,以消除砷对河水的污染
D、向该河中撒入氢氧化钠,以消除对河水的污染C元素周期律应用16、A、B、C三种元素为短周期元素。A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为__________。1mol B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是__________;B的最高价氧化物的对应水化物的化学式为__________。C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是__________;C与Na反应后生成物的电子式为__________,化合物中的化学键属于__________。 综合推断17、已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的元素符号:A_____、B_____、C______、D______、E______。
(2)用电子式表示离子化合物A2B的形成过程:________________。
(3)写出下列物质的电子式:
①D元素形成的单质__________;
②E与C形成的化合物__________;
③A、B、E形成的化合物__________;
④D与E形成的化合物__________。 综合推断18、A元素是IA族元素中相对原子质量最小的元素,B元素原子的最外层电子数是次外层的3倍,A、B两元素可形成两种化合物分子。
(1)用电子式表示这两种分子的形成过程。
①___________________________________;
②___________________________________。
(2)这两种分子的结构式分别为__________、__________。综合推断19、氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:(Na3N+H2O → NaOH+NH3)
(1)Na3N的电子式是__________,该化合物是由__________键形成的。
(2)Na3N与盐酸反应生成__________种盐,其化学式分别是__________。
(3)比较Na3N中两种微粒的半径:r(Na+) _____r(N3-)(填“>”、“=”、“<”=。 综合推断
A、a-c=m-n B、a-b=n-m
C、c-d=m+n D、b-d=n+mD2、根据中学化学所附元素周期表判断,下列叙述不正确的是( )
A、K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B、L层电子为奇数的所有元素所在的族序数与该原子的L层电子数相等
C、L层电子为偶数的所有元素所在的族序数与该原子的L层电子数相等
D、M层电子为奇数的所有元素所在的族序数与该原子的M层电子数相等C3、在第n电子层中,当它为最外层时容纳电子数最多与n-1层相同,当它作为次外层时,其电子比n-1层最多能多10个电子,则n为( )
A、L层 B、M层
C、N层 D、无法确定
4、若短周期中两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是( )
A、1 B、3 C、5 D、6BD5、下列各种分子中,都满足8电子稳定结构的是( )
A、H2O B、BF3
C、CCl4 D、XeF2
6、化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mL A气体能分解成15mL O2和10mL F2(同温同压下)。
求A气体的化学式、电子式、结构式。C7、甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A、x+2 B、x+4
C、x+8 D、x+18
8、下列叙述错误的是( )
A、原子半径:Cl>S>O
B、还原性:Na>Mg>Al
C、稳定性:HF>HCl>HBr
D、酸性:HClO4>H2SO4>H3PO4BA9、R元素气态氢化物的化学式为RH3,则R元素最高价氧化物的化学式是( )
A、R2O5 B、RO2 C、RO3 D、R2O7
10、短周期的三种元素分别为X、Y和Z,已知X元素的原子的最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L层电子总数少2。则这三种元素组成的化合物不可能是:
A、X2YZ4 B、XYZ3
C、X3YZ4 D、X4Y2Z7AA作业熟背元素周期表主族
整理第一章知识点(明天交)11、N的质量数为14,在粒子NH3T+中,
电子数:质子数:中子=?
12、同温同压下,对于等质量的H2、D2、T2三种气体,试计算:
(1)物质的量之比
(2)质子数之比
(3)中子数之比
(4)密度比同位素计算13、某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( )
A B
C DC核外电子排布计算14、同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
A.原子半径:X>Y>Z
B.单质的非金属性:X>Y>Z
C.气态氢化物稳定性:X<Y<Z
D.原子序数:X>Y>Z BD元素周期律应用15、据报道,某地一辆满载砒霜的在货车翻下山坡,滑下车道,部分砒霜落入河中。砒霜的主要成分是As2O3,剧毒,致死量为0.1g,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水,生成H3AsO3;其对应的盐也均有毒性,其中碱金属对应的盐溶于水,其他金属对应的盐几乎不溶于水。根据以上信息判断,下列说法正确的是( )
A、As2O3是离子化合物
B、As2O3是砷酸的酸酐
C、可向该河中撒入生石灰,以消除砷对河水的污染
D、向该河中撒入氢氧化钠,以消除对河水的污染C元素周期律应用16、A、B、C三种元素为短周期元素。A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为__________。1mol B单质能从盐酸中置换出3g氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是__________;B的最高价氧化物的对应水化物的化学式为__________。C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是__________;C与Na反应后生成物的电子式为__________,化合物中的化学键属于__________。 综合推断17、已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的元素符号:A_____、B_____、C______、D______、E______。
(2)用电子式表示离子化合物A2B的形成过程:________________。
(3)写出下列物质的电子式:
①D元素形成的单质__________;
②E与C形成的化合物__________;
③A、B、E形成的化合物__________;
④D与E形成的化合物__________。 综合推断18、A元素是IA族元素中相对原子质量最小的元素,B元素原子的最外层电子数是次外层的3倍,A、B两元素可形成两种化合物分子。
(1)用电子式表示这两种分子的形成过程。
①___________________________________;
②___________________________________。
(2)这两种分子的结构式分别为__________、__________。综合推断19、氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:(Na3N+H2O → NaOH+NH3)
(1)Na3N的电子式是__________,该化合物是由__________键形成的。
(2)Na3N与盐酸反应生成__________种盐,其化学式分别是__________。
(3)比较Na3N中两种微粒的半径:r(Na+) _____r(N3-)(填“>”、“=”、“<”=。 综合推断
同课章节目录
