化学反应焓化[上学期]
图片预览





文档简介
课件17张PPT。化学反应中的热效应化学反应
的焓变宿迁中学高二化学组一、反应热 焓变
定义:化学反应过程中所吸收或放出的热量
称为化学反应的反应热。
在恒温、恒压的条件下,化学反应过程
中所吸收或释放的热量称为反应的焓变。
符号:
单位:kJ/mol问题1:什么叫放热反应,什么叫吸热反应?举 例。
放出热量的反应称为放热反应。例如中和反
应、燃烧反应、金属与酸的反应、氧化钙与水
反应、大多化合反应等
吸收热量的反应称为吸热反应。例如碳与
H2O、CO2的反应、盐类的水解、氢氧化钡晶
体与氯化铵的反应、大多分解反应等2、下列变化中,属于吸热反应的是( )
A.氮气与氢气合成氨
B.酸碱中和
C.二氧化硫与氧气反应生成三氧化硫
D.焦炭与高温水蒸气反应
D[练习]
1、下列变化中,属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
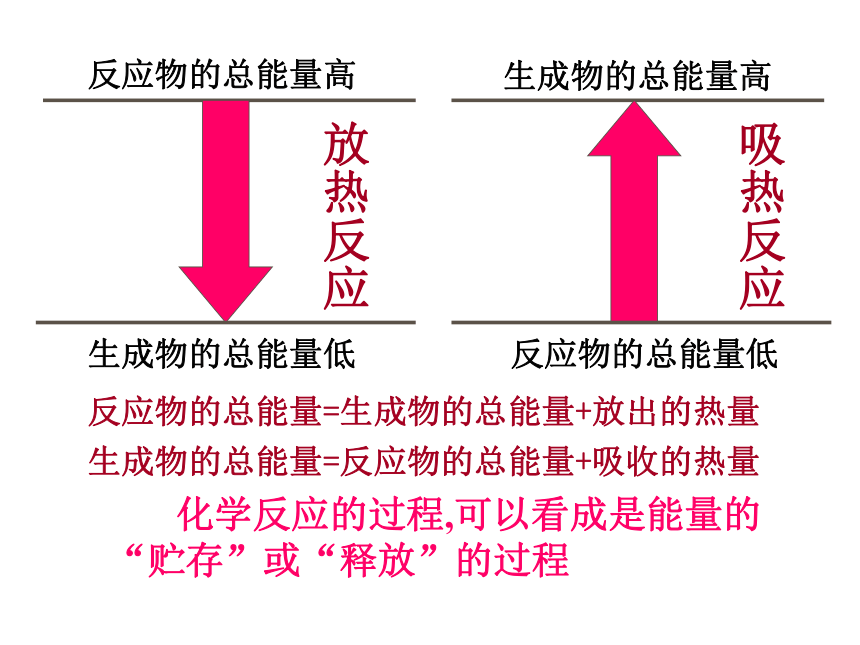
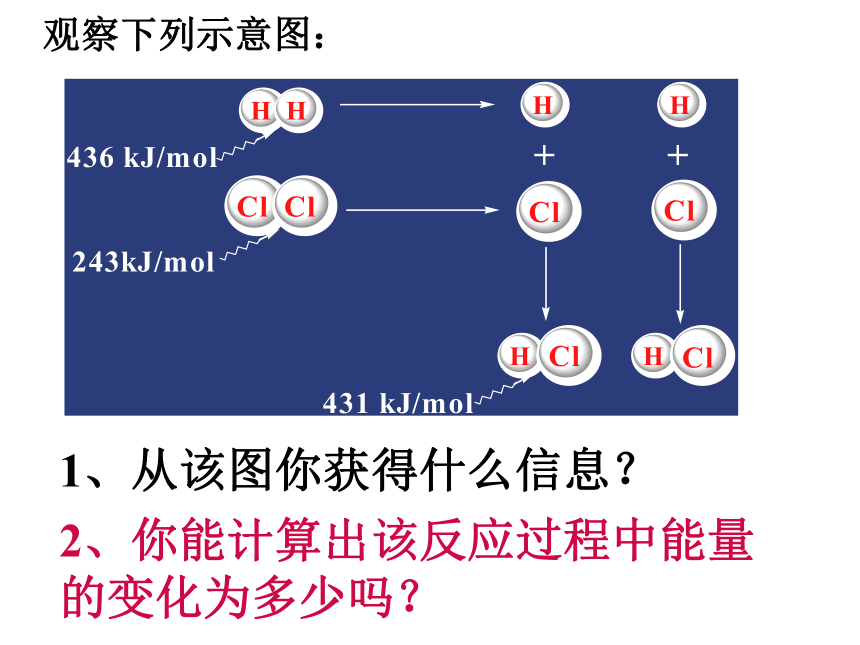
D.氯化铝的水解B问题2:反应中为什么会有能量的变化?微观:断键,成键作用;宏观:能量守恒作用反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程观察下列示意图:1、从该图你获得什么信息?2、你能计算出该反应过程中能量的变化为多少吗?反应物分子断键时吸收的能量☆从微观角度去考虑:反应物分子断键时吸收的能量放热反应<生成物分子成键时释放的能量吸热反应>生成物分子成键时释放的能量
1、化学键断裂,吸收能量;
化学键生成,放出能量 反应物总能量小于生成物总能量,吸热反应, 体系能量升高,小结:二、热化学方程式:
1、概念:能够表示反应热的化学方程式叫做热化学方程式。 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。 因为物质的聚集状态不同所含的能量也不同。 固态
液态吸热气态吸热吸热1)要注明温度和压强:2)反应物和生成物要注明聚集状态: 2、书写热化学方程式应注意以下几点 ∴H2O(l)═H2O(g);△H=+44KJ/mol 3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,因而必要时可用简单分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol 2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol4) △H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成比例3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或吸收的热量。质→量→能1、在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A. H2(g)+Cl2(g)=2HCl(g);△H=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-Q2
B. C(s)+1/2O2(g)=CO (g);△H=-Q1
C(s)+O2(g)=CO2 (g);△H=-Q2
C. 2H2(g)+O2(g)=2H2O(l);△H=-Q1
2H2(g)+O2(g)=2H2O(g);△H=-Q2
D. S(g)+O2(g)=SO2 (g);△H=-Q1
S(s)+O2(g)=SO2 (g);△H=-Q2B 练一练A2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 3、(2003·江苏)已知在25℃、101kPa下,1g
C8H18(辛烷)燃烧生成二氧化碳和液态水时放
出48.40kJ 热量。表示上述反应的热化学方程
式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B再见
的焓变宿迁中学高二化学组一、反应热 焓变
定义:化学反应过程中所吸收或放出的热量
称为化学反应的反应热。
在恒温、恒压的条件下,化学反应过程
中所吸收或释放的热量称为反应的焓变。
符号:
单位:kJ/mol问题1:什么叫放热反应,什么叫吸热反应?举 例。
放出热量的反应称为放热反应。例如中和反
应、燃烧反应、金属与酸的反应、氧化钙与水
反应、大多化合反应等
吸收热量的反应称为吸热反应。例如碳与
H2O、CO2的反应、盐类的水解、氢氧化钡晶
体与氯化铵的反应、大多分解反应等2、下列变化中,属于吸热反应的是( )
A.氮气与氢气合成氨
B.酸碱中和
C.二氧化硫与氧气反应生成三氧化硫
D.焦炭与高温水蒸气反应
D[练习]
1、下列变化中,属于放热反应的是( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B问题2:反应中为什么会有能量的变化?微观:断键,成键作用;宏观:能量守恒作用反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程观察下列示意图:1、从该图你获得什么信息?2、你能计算出该反应过程中能量的变化为多少吗?反应物分子断键时吸收的能量☆从微观角度去考虑:反应物分子断键时吸收的能量放热反应<生成物分子成键时释放的能量吸热反应>生成物分子成键时释放的能量
1、化学键断裂,吸收能量;
化学键生成,放出能量 反应物总能量小于生成物总能量,吸热反应, 体系能量升高,小结:二、热化学方程式:
1、概念:能够表示反应热的化学方程式叫做热化学方程式。 反应放出或吸收的热量的多少与外界的温度和压强有关,需要注明,不注明的指101kPa和25℃时的数据。 因为物质的聚集状态不同所含的能量也不同。 固态
液态吸热气态吸热吸热1)要注明温度和压强:2)反应物和生成物要注明聚集状态: 2、书写热化学方程式应注意以下几点 ∴H2O(l)═H2O(g);△H=+44KJ/mol 3)热化学方程式中各物质前的化学计量数表示物质的量不表示分子数,因而必要时可用简单分数。一般出现分数时是以某一反应物或生成物为“1mol”时其它物质才出现的。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol 2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol4) △H的表示:
热化学方程式中的△H的“+”与“-”一定要注明, “+”代表吸热, “-”代表放热
无论热化学方程式中化学计量数为多少,△H的单位总是KJ/mol,但△H的数值与反应式中的系数成比例3、热化学方程式表示的意义 1)表示什么物质参加反应,结果生成什么物质2)反应物和生成物之间的质量比、物质的量比3)反应物完全变成生成物后所放出或吸收的热量。质→量→能1、在同温同压下,下列各组热化学方程式中Q2>Q1的是( )
A. H2(g)+Cl2(g)=2HCl(g);△H=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-Q2
B. C(s)+1/2O2(g)=CO (g);△H=-Q1
C(s)+O2(g)=CO2 (g);△H=-Q2
C. 2H2(g)+O2(g)=2H2O(l);△H=-Q1
2H2(g)+O2(g)=2H2O(g);△H=-Q2
D. S(g)+O2(g)=SO2 (g);△H=-Q1
S(s)+O2(g)=SO2 (g);△H=-Q2B 练一练A2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 3、(2003·江苏)已知在25℃、101kPa下,1g
C8H18(辛烷)燃烧生成二氧化碳和液态水时放
出48.40kJ 热量。表示上述反应的热化学方程
式正确的是 ( )
A、C8H18(l)+25/2O2(g)=8CO2(g) +9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2 (g) +9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g) + 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2 (g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B再见
