专题二的复习教案[上学期]
图片预览
文档简介
HYPERLINK "http:///" 版权所有——化学教育网
教案
专题二复习
教学重难点:典型题的解题与知识网络的构建
主要教法: 讲授法、引导归纳
教具及现代化教育技术设计:PPT文档
:
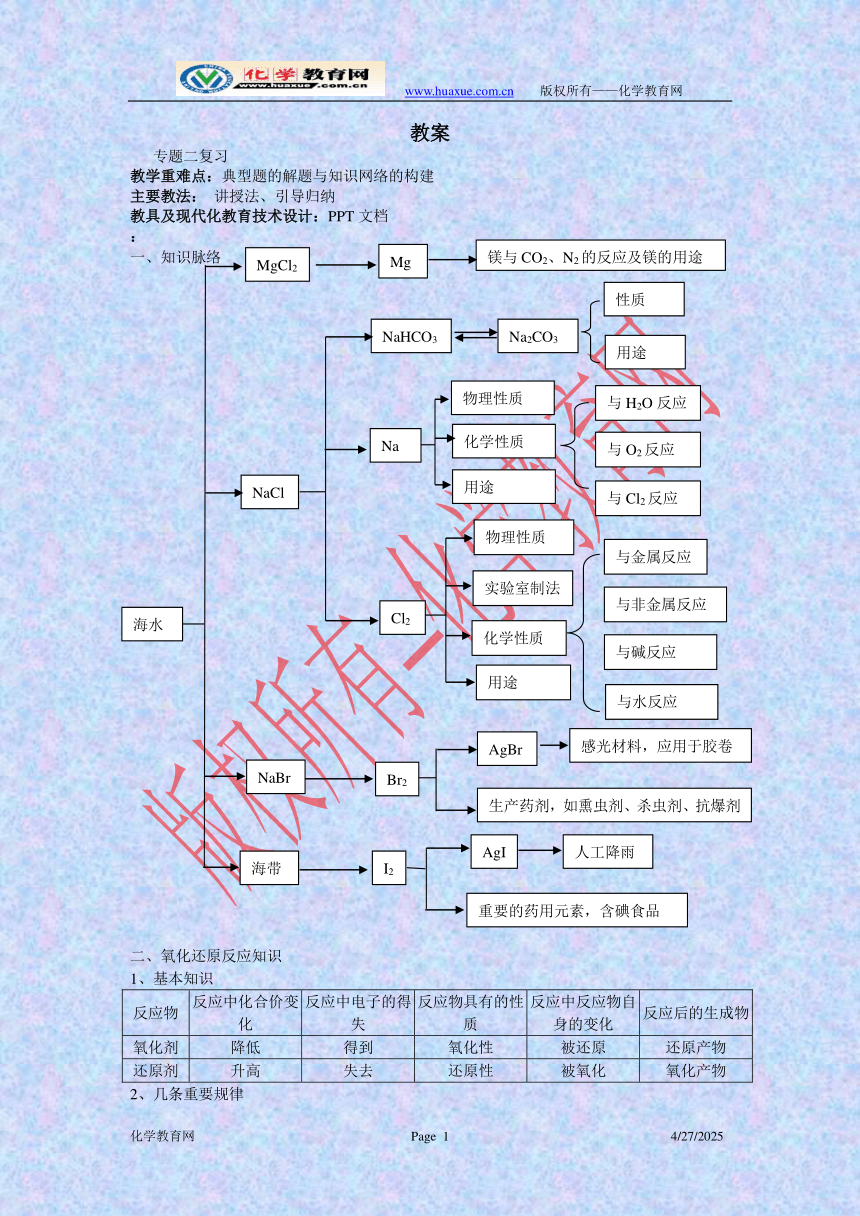
一、知识脉络
二、氧化还原反应知识
1、基本知识
反应物 反应中化合价变化 反应中电子的得失 反应物具有的性质 反应中反应物自身的变化 反应后的生成物
氧化剂 降低 得到 氧化性 被还原 还原产物
还原剂 升高 失去 还原性 被氧化 氧化产物
2、几条重要规律
⑴电子得失守恒规律:氧化剂得电子的总数目=还原剂失电子的总数目
⑵以强制弱规律:对于自发的氧化还原反应(除高温、电解条件外),总是强氧化性物和强还原性物质反应生成弱氧化性物质和弱还原性物质
⑶价态归中规律:同种元素不同价态原子间发生氧化还原反应,总是从高价态与低价态反应后生成中间价态的物质。元素的化合价变化趋势不能交叉。
⑷先强后弱规律:同一氧化剂(或是还原剂)与不同还原剂(或氧化剂)反应,当还原剂(或氧化剂)的浓度差别不大时,总是先与还原性(或氧化性)强的反应,然后再与弱的反应。
三、离子反应
1、电解质与非电解质、强电解质与弱电解质
⑴电解质:在熔融状态下或水溶液中能导电的化合物。如:酸、碱、盐
⑵非电解质:在熔融状态下和水溶液中都不能导电的化合物。如:乙醇、蔗糖、CO2、NH3
⑶强电解质:在水溶液中全部电离,电离过程不可逆;电解质在溶液中只以离子形式存在,不以分子形式存在。如:强酸、强碱和大部分盐
⑷弱电解质:在水溶液中只是部分电离,电离过程可逆;电解质在溶液里既以离子形式存在,又以分子形式存在。如:弱酸(HF、HClO、H2S、H2SO3、CH3COOH、H2CO3)
弱碱:一水合氨和难溶碱等。
2、离子反应:在反应中有离子参加或是有离子生成的反应。
离子反应有下列几类:①生成难溶物质。如生成:BaSO4、AgCl、CaCO3等
②生成难电离物质。如生成 :CH3COOH、H2O、NH3·H2O、HClO
③生成挥发性物质。如生成:CO2、SO2、H2S等
④发生氧化还原反应。如:2Fe3++Cu=2Fe2++Cu2+
3、离子方程式的书写——离子方程式不仅可以表示某一个反应,还可以表示某一类反应。
步骤:①写——写出反应的化学方程式
②拆——把可溶性的强电解质以离子形式表示,其余的保留其化学式
③删——将不参加反应的离子从方程式中删去
④查——检查是否符合客观事实、是否符合质量守恒和电荷守恒
说明:微溶物的处理:在生成物中保留其化学式;在反应物中如果是澄清溶液则拆成离子的形式,如果是浊液则保留其化学式。
4、离子共存问题——能够发生反应的离子在同一个溶液中不能大量共存。
⑴在溶液中某些离子间能互相反应生成难溶性物质时,这些离子就不能大量共存。如SO42-与Ba2+、Pb2+、Ag+;OH—与Cu2+、Fe3+、Mg2+、Al3+、Zn2+;Ag+与Cl—、Br—、I—、CO32-、SO32-、S2-;Mg2+、Ca2+、Ba2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等,不能大量共存
⑵离子间能结合成难电离物质时,则这些离子不能大量共存。如:H+与OH—、ClO—、CH3COO-、HPO42-、H2PO4—;OH—与HCO3—、HS—、HSO3-、HPO42-、H2PO4—、H+;Fe3+与SCN—不能大量共存。
⑶离子间能结合生成挥发性物质时,则这些离子不能大量共存。如:H+与CO32-、SO32-、HCO3-、HSO3—、S2-、HS—;OH—与NH4+等不能大量共存。
⑷离子间能发生氧化还原反应时,则这些离子也不能大量共存。一般说来具有氧化性的离子(
MnO4-、ClO—、Fe3+、NO3—/H+)与具有还原性的离子(S2-、I—、SO32-、Fe2+、)不能大量共存。
⑸注意外加条件。“无色溶液中”应排除Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色);“强酸性(PH=1)溶液中”应考虑到溶液中有大量的H+;“因氧化还原反应而不能共存”是指不能共存的原因是由于发生了氧化还原反应,如MnO4-与I—不能共存是由于两者能发生氧化还原反应;而H+与OH—不能共存的原因是由于两者发生了复分解反应。
四、经典例题
1、下列说法正确的是( A )
A、元素化合价发生变化的反应是氧化还原反应 B、还原剂是一种能得到电子的物质
C、氧化剂在同一反应中既可以是反应物又可以是生成物
D、有单质参加或有单质生成的化学反应一定是氧化还原反应
2、(NH4)2PtCl6晶体受热完全分解,放出氮气和氯化氢气体,同时生成金属铂和氯化铵。在这个反应中,若放出的N2是xmol则还原出的Pt是( D )
A.x/2 mol B.2x mol C.2x/3 mol D.3x/2 mol
3、在pH=1的无色透明溶液中,不能大量共存的离子组是:AC
A.Al3+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、S2-、Cl- D.Zn2+、Na+、NO3-、SO42-
4、室温下,将下列物质各5g分别投入100g水里,充分搅拌后,所得溶液中溶质的质量分数最小的是 ( A )
A.CaO B.Na2O C.Na D.NaOH
5、某温度下,将氯气通入氢氧化钠溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO—与ClO3—的物质的量之比为1∶3,则氯气与氢氧钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( D )
A.21∶5 B.11∶3 C.3∶1 D.4∶1
6、向KI溶液中加入AgNO3溶液,直到刚好完全反应为止,所得溶液的质量恰好等于原碘化钾溶液的质量,则AgNO3溶液的质量百分比浓度是( B )
A.27.7% B.72.3% C.70.6% D.29.4%
海带
I2
人工降雨
AgI
重要的药用元素,含碘食品
NaBr
Br2
AgBr
生产药剂,如熏虫剂、杀虫剂、抗爆剂
感光材料,应用于胶卷
与金属反应
与非金属反应
与碱反应
与水反应
实验室制法
Cl2
物理性质
用途
化学性质
物理性质
Na
化学性质
用途
与O2反应
与H2O反应
与Cl2反应
NaHCO3
Na2CO3
性质
用途
NaCl
MgCl2
镁与CO2、N2的反应及镁的用途
Mg
海水
化学教育网 Page 1 06-9-15
教案
专题二复习
教学重难点:典型题的解题与知识网络的构建
主要教法: 讲授法、引导归纳
教具及现代化教育技术设计:PPT文档
:
一、知识脉络
二、氧化还原反应知识
1、基本知识
反应物 反应中化合价变化 反应中电子的得失 反应物具有的性质 反应中反应物自身的变化 反应后的生成物
氧化剂 降低 得到 氧化性 被还原 还原产物
还原剂 升高 失去 还原性 被氧化 氧化产物
2、几条重要规律
⑴电子得失守恒规律:氧化剂得电子的总数目=还原剂失电子的总数目
⑵以强制弱规律:对于自发的氧化还原反应(除高温、电解条件外),总是强氧化性物和强还原性物质反应生成弱氧化性物质和弱还原性物质
⑶价态归中规律:同种元素不同价态原子间发生氧化还原反应,总是从高价态与低价态反应后生成中间价态的物质。元素的化合价变化趋势不能交叉。
⑷先强后弱规律:同一氧化剂(或是还原剂)与不同还原剂(或氧化剂)反应,当还原剂(或氧化剂)的浓度差别不大时,总是先与还原性(或氧化性)强的反应,然后再与弱的反应。
三、离子反应
1、电解质与非电解质、强电解质与弱电解质
⑴电解质:在熔融状态下或水溶液中能导电的化合物。如:酸、碱、盐
⑵非电解质:在熔融状态下和水溶液中都不能导电的化合物。如:乙醇、蔗糖、CO2、NH3
⑶强电解质:在水溶液中全部电离,电离过程不可逆;电解质在溶液中只以离子形式存在,不以分子形式存在。如:强酸、强碱和大部分盐
⑷弱电解质:在水溶液中只是部分电离,电离过程可逆;电解质在溶液里既以离子形式存在,又以分子形式存在。如:弱酸(HF、HClO、H2S、H2SO3、CH3COOH、H2CO3)
弱碱:一水合氨和难溶碱等。
2、离子反应:在反应中有离子参加或是有离子生成的反应。
离子反应有下列几类:①生成难溶物质。如生成:BaSO4、AgCl、CaCO3等
②生成难电离物质。如生成 :CH3COOH、H2O、NH3·H2O、HClO
③生成挥发性物质。如生成:CO2、SO2、H2S等
④发生氧化还原反应。如:2Fe3++Cu=2Fe2++Cu2+
3、离子方程式的书写——离子方程式不仅可以表示某一个反应,还可以表示某一类反应。
步骤:①写——写出反应的化学方程式
②拆——把可溶性的强电解质以离子形式表示,其余的保留其化学式
③删——将不参加反应的离子从方程式中删去
④查——检查是否符合客观事实、是否符合质量守恒和电荷守恒
说明:微溶物的处理:在生成物中保留其化学式;在反应物中如果是澄清溶液则拆成离子的形式,如果是浊液则保留其化学式。
4、离子共存问题——能够发生反应的离子在同一个溶液中不能大量共存。
⑴在溶液中某些离子间能互相反应生成难溶性物质时,这些离子就不能大量共存。如SO42-与Ba2+、Pb2+、Ag+;OH—与Cu2+、Fe3+、Mg2+、Al3+、Zn2+;Ag+与Cl—、Br—、I—、CO32-、SO32-、S2-;Mg2+、Ca2+、Ba2+与CO32-、SO32-、PO43-;S2-与Cu2+、Pb2+等,不能大量共存
⑵离子间能结合成难电离物质时,则这些离子不能大量共存。如:H+与OH—、ClO—、CH3COO-、HPO42-、H2PO4—;OH—与HCO3—、HS—、HSO3-、HPO42-、H2PO4—、H+;Fe3+与SCN—不能大量共存。
⑶离子间能结合生成挥发性物质时,则这些离子不能大量共存。如:H+与CO32-、SO32-、HCO3-、HSO3—、S2-、HS—;OH—与NH4+等不能大量共存。
⑷离子间能发生氧化还原反应时,则这些离子也不能大量共存。一般说来具有氧化性的离子(
MnO4-、ClO—、Fe3+、NO3—/H+)与具有还原性的离子(S2-、I—、SO32-、Fe2+、)不能大量共存。
⑸注意外加条件。“无色溶液中”应排除Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-(紫色);“强酸性(PH=1)溶液中”应考虑到溶液中有大量的H+;“因氧化还原反应而不能共存”是指不能共存的原因是由于发生了氧化还原反应,如MnO4-与I—不能共存是由于两者能发生氧化还原反应;而H+与OH—不能共存的原因是由于两者发生了复分解反应。
四、经典例题
1、下列说法正确的是( A )
A、元素化合价发生变化的反应是氧化还原反应 B、还原剂是一种能得到电子的物质
C、氧化剂在同一反应中既可以是反应物又可以是生成物
D、有单质参加或有单质生成的化学反应一定是氧化还原反应
2、(NH4)2PtCl6晶体受热完全分解,放出氮气和氯化氢气体,同时生成金属铂和氯化铵。在这个反应中,若放出的N2是xmol则还原出的Pt是( D )
A.x/2 mol B.2x mol C.2x/3 mol D.3x/2 mol
3、在pH=1的无色透明溶液中,不能大量共存的离子组是:AC
A.Al3+、Ag+、NO3-、Cl- B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、S2-、Cl- D.Zn2+、Na+、NO3-、SO42-
4、室温下,将下列物质各5g分别投入100g水里,充分搅拌后,所得溶液中溶质的质量分数最小的是 ( A )
A.CaO B.Na2O C.Na D.NaOH
5、某温度下,将氯气通入氢氧化钠溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO—与ClO3—的物质的量之比为1∶3,则氯气与氢氧钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( D )
A.21∶5 B.11∶3 C.3∶1 D.4∶1
6、向KI溶液中加入AgNO3溶液,直到刚好完全反应为止,所得溶液的质量恰好等于原碘化钾溶液的质量,则AgNO3溶液的质量百分比浓度是( B )
A.27.7% B.72.3% C.70.6% D.29.4%
海带
I2
人工降雨
AgI
重要的药用元素,含碘食品
NaBr
Br2
AgBr
生产药剂,如熏虫剂、杀虫剂、抗爆剂
感光材料,应用于胶卷
与金属反应
与非金属反应
与碱反应
与水反应
实验室制法
Cl2
物理性质
用途
化学性质
物理性质
Na
化学性质
用途
与O2反应
与H2O反应
与Cl2反应
NaHCO3
Na2CO3
性质
用途
NaCl
MgCl2
镁与CO2、N2的反应及镁的用途
Mg
海水
化学教育网 Page 1 06-9-15
同课章节目录
