南昌市2005-2006学年第二学期期中考试高一化学试卷-人教版[下学期]
文档属性
| 名称 | 南昌市2005-2006学年第二学期期中考试高一化学试卷-人教版[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 35.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-28 15:55:00 | ||
图片预览


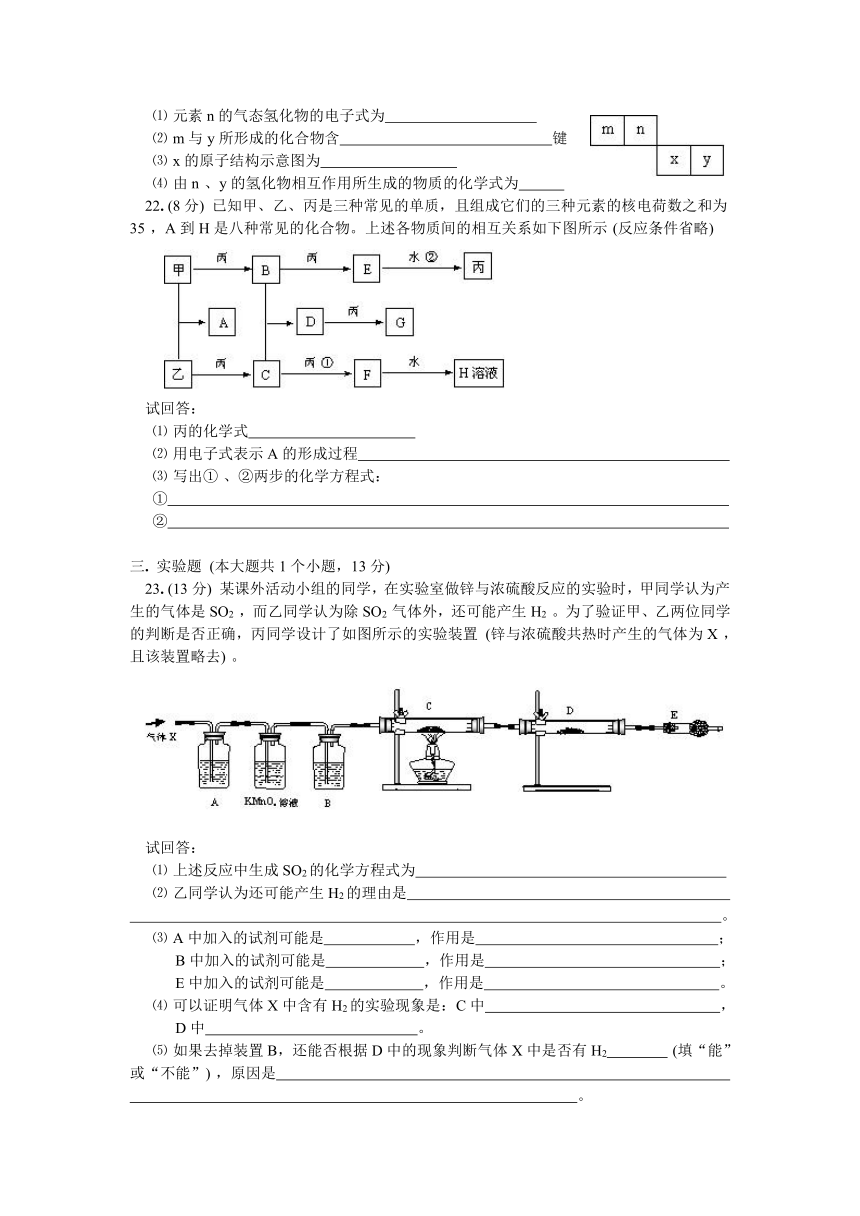
文档简介
南昌市2005—2006学年第二学期期中考试
( 重点 ) 高一化学
可能用到的相对原子质量:H 1 ;O 16 ;Al 27 ;S 32 ;K 39 ;Fe 56 ;Ba 137
一. 选择题 (每小题只有一个正确答案,每小题3分,共48分)
1. 我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃300万吨原
煤的火力发电厂产生的电能,因此,三峡工程有助于控制
① 温室效应 ② 二氧化硫的排放 ③ 白色污染 ④ 碳氢化合物的排放
A. ①② B. ①②③ C. ①②④ D. ①②③④
2. 下列各组物质中,都是共价化合物的是
A. H2S和Na2O2 B. H2O2和CaF2 C. NH3 和N2 D. HNO3和HClO3
3. 在标准状况下,下列各组物质体积相同时,分子数也相同的是
A. SO2 、SO3 B. SO2 、O2 C. SO2 、CCl4 D. SO2 、PCl5
4. 除去 SO2中的SO3 ,并得到纯净的SO2 ,最好使混合气体通过
A. 水 B. NaHSO3饱和溶液 C. NaHCO3饱和溶液 D. 98 . 3 %浓硫酸
5. 元素周期表前7周期的元素如下:
周期
1
2
3
4
5
6
7
元素数
2
8
8
18
18
32
32
分析周期表与元素数的关系,请预言第 8 周期最多可能含有的元素种数是
A. 18 B. 32 C . 50 D. 64
6. 储存浓H2SO4的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的
A. 吸水性和酸性 B. 脱水性和吸水性
C. 强氧化性和吸水性 D . 不挥发性和酸性
7. 镁、锂在元素周期表中具有特殊的“对角线”位置关系,它们的性质相似,例如,它
们的单质在过量氧气中燃烧时均只能生成正常的氧化物 …… 等。以下叙述锂的性质正确的是
A. Li2SO4难溶于水 B. Li与水剧烈反应
C. LiOH是易溶于水,受热不分解的强碱 D. Li2CO3受热分解,生成Li2O和CO2
8. 近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血
管功能具有重要作用。下列叙述正确的是
A. 硫化氢分子很稳定,受热难分解
B. 硫化氢分子中所有原子的最外层电子都达到8电子结构
C. 将硫化氢通入溴水,溴水褪色
D. 硫化氢是电解质,其电离方程式是 H2S = 2H + + S 2-
9. 下列说法正确的是
A. 难失电子的原子,得电子的能力一定强
B. 易得电子的原子,失电子的能力一定弱
C. 电子层结构相同的单核离了,阳离子半径一定比阴离子半径大
D. 任何原子的原子核都是由质子和中子构成的
10. 与10 g H216O所含中子数相等的D216O ,其质量最接近于
A. 6 . 7 g B. 8 . 9 g C. 10 . 2 g D. 12 . 4 g
11. A 、B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等
于中子数。① 若A为ⅡA族,其质量数为X ,则B的质子数为Y;② 若A为ⅣA族,其质子数为m ,则B质量数为n ,则Y和n的值是
A . ( + 18 ) 和 ( 2 m + 18 ) B . ( + 8 ) 和 ( 2 m + 18 )
C . ( + 8 ) 和 ( 2 m + 36 ) D . ( + 18 ) 和 ( 2 m + 36 )
12. X 、Y 、Z是1 ~ 18号的三种元素,它们的离子具有相同的电子层结构。若Y与Z
能形成YZ 3型离子化合物,Z的离子半径大于X离子的半径,则三种元素的原子半径由大到小的顺序是
A . X > Y > Z B . Y > X > Z C . X > Z > Y D . Z > X >Y
13. 下列叙述正确的是
A . 单质分子中一定存在着共价键
B . 气态物质中一定存在着共价键
C . 全部由非金属元素构成的化合物一定不存在离子键
D . 在共价化合物中一定含有共价键
14. 下列说法正确的是
A . X m + 与Y n- 与氖原子的电子层结构相同,原子半径前者大于后者
B . NaF和MgI 2 中阳离子与阴离子半径之比,前者小于后者
C . 168 O和178 O原子的核外电子数,前者大于后者
D . PH 3 和H 2 S的稳定性,前者大于后者
15. 某种由K 2 S和Al 2 S 3 组成的混合物中,这两种组分的物质的量之比为3∶2 ,那么
含有32 g 硫元素的该混合物的质量是
A. 35 g B. 50 g C. 60 g D. 70 g
16. 在同温同压下,24 mL H2S在30 mL O2中燃烧,相同条件下得到SO2气体的体积为
A . 24 mL B . 30 mL C . 20 mL D . 18 mL
二. 填空题 (本大题共4个小题,共15分)
17. (4分) 书写下列微粒的电子式:
⑴ CS2 ; ⑵ HClO ;
⑶ Na2O2 ; ⑷ Ca (OH)2 。
18. (6分) 某溶液中含有SO42- 、CO32- 、OH - 三种阴离子,如果只取一次溶液,分别
将这三种离子检验出来,那么应:
⑴ 先检验 ,加入 试剂(或溶液)
⑵ 再检验 ,加入 试剂(或溶液)
⑶ 最后检验 ,加入 试剂 (或溶液)
19. (3分) 原子序数小于20的A、B、C、D四种元素,最高正价依次为1、4、5、7,核
电荷数按B、C、D、A顺序递增,已知B原子次外层为2个电子,C、D、A原子次外层为8个电子,则这四种元素的原子的质子数之和为 。
20. (2分) 两个硫酸分子可以脱去1分子水生成焦硫酸( H2S2O7 ) ,已知硫酸的分子中有4
个硫氧键,则焦硫酸分子中硫氧键的数目是
三. 推断题 (本大题共2个小题,共14分)
21. (6分) m 、n 、x 、y 四种主族元素在周期表里的相对位置如图所示。
已知它们的原子序数总和为46 ,则:
⑴ 元素n的气态氢化物的电子式为
⑵ m与y所形成的化合物含 键
⑶ x的原子结构示意图为
⑷ 由n 、y的氢化物相互作用所生成的物质的化学式为
22. (8分) 已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为
35 ,A到H是八种常见的化合物。上述各物质间的相互关系如下图所示 (反应条件省略)
试回答:
⑴ 丙的化学式
⑵ 用电子式表示A的形成过程
⑶ 写出① 、②两步的化学方程式:
①
②
三. 实验题 (本大题共1个小题,13分)
23. (13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产
生的气体是SO2 ,而乙同学认为除SO2 气体外,还可能产生H2 。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置 (锌与浓硫酸共热时产生的气体为X ,且该装置略去) 。
试回答:
⑴ 上述反应中生成SO2的化学方程式为
⑵ 乙同学认为还可能产生H2的理由是
。
⑶ A中加入的试剂可能是 ,作用是 ;
B中加入的试剂可能是 ,作用是 ;
E中加入的试剂可能是 ,作用是 。
⑷ 可以证明气体X中含有H2的实验现象是:C中 ,
D中 。
⑸ 如果去掉装置B,还能否根据D中的现象判断气体X中是否有H2 (填“能”
或“不能”) ,原因是
。
四. 计算题 (本大题共1个小题,10分)
24. (10分) 向氢氧化钠溶液中慢慢地通入二氧化硫气体,反应生成正盐,当继续通入过量
二氧化硫时,正盐便转化成酸式盐。
⑴ 写出上述反应的化学方程式
①
②
⑵ 标准状态下,向100 mL 2 mol/L的NaOH溶液中通入3 . 36 L二氧化硫气体,反应后
溶液中溶质的成分为 。
⑶ 试计算,在标准状态下,100 mL 2 mol/L的NaOH溶液中最多可吸收多少体积二氧
化硫气体?
南昌市2005—2006学年第二学期期中考试
( 重点 ) 高一化学参考答案和评分标准
一. 选择题 (每小题只有一个正确答案,每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
D
C
A
D
C
题号
9
10
11
12
13
14
15
16
答案
B
B
C
A
D
A
D
D
二. 填空题 (本大题共4个小题,共15分)
17. (4分) 每个答案1分,共4分
⑴ S C S ⑵ H O Cl ⑶ Na+[ O O ]2-Na+
⑷ [ H O ]-Ca2+[ O H ]-
18. (6分) 每个答案1分,共6分
⑴ OH - 、酚酞 ⑵ CO32- 、盐酸 ⑶ SO42- 、BaCl2
19. (3分)
57 3分
20. (2分)
8 2分
三. 推断题 (本大题共2个小题,共14分)
21. (6分)
⑴ H N H 2分 ; ⑵ 极性 1分 ;
⑶ 1分 ; ⑷ NH4Cl 2分
22. (8分) 每个答案2分,共8分
⑴ O2 ; ⑵ Na + S + Na Na+ [ S ]2- Na+
⑶ ① 2SO2 + O2 2SO3
② 2Na2O2 + 2H2O = 4NaOH + O2↑
三. 实验题 (本大题共1个小题,13分)
23. (13分) ⑴Zn + 2H2 SO4 (浓) ZnSO4 + SO2↑+ 2H2O 2分
⑵ 在锌与浓硫酸反应过程中,浓硫酸浓度逐渐变稀,Zn与稀硫酸反应可产生H2 1分
⑶ 品红溶液 、检验SO2 ;浓硫酸 、吸收水蒸气 ; 碱石灰 、防止空气中的水蒸气进
入D中 每个答案1分
⑷ 黑色CuO变成红色的Cu ;白色粉末变成蓝色 每个答案1分
⑸不能、因为混合气体中可能含有H2O会干扰H2的检验 (其它合理答案均可)
每个答案1分
四. 计算题 (本大题共1个小题,10分)
24. (10分)
⑴ SO2+2NaOH Na2SO3+H2O 2分
Na2SO3+SO2+H2O 2NaHSO3 2分
⑵ Na2SO3 、NaHSO3 2分
⑶ 当NaOH溶液反应吸收最多体积二氧化硫气体时,反应为
SO2 + NaOH NaHSO3
1mol 1mol
0 . 2 mol x x = 0 . 2 mol
V(SO2)=22 . 4 L/mol×0 . 2 mol = 4 . 48 L 4分
( 重点 ) 高一化学
可能用到的相对原子质量:H 1 ;O 16 ;Al 27 ;S 32 ;K 39 ;Fe 56 ;Ba 137
一. 选择题 (每小题只有一个正确答案,每小题3分,共48分)
1. 我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃300万吨原
煤的火力发电厂产生的电能,因此,三峡工程有助于控制
① 温室效应 ② 二氧化硫的排放 ③ 白色污染 ④ 碳氢化合物的排放
A. ①② B. ①②③ C. ①②④ D. ①②③④
2. 下列各组物质中,都是共价化合物的是
A. H2S和Na2O2 B. H2O2和CaF2 C. NH3 和N2 D. HNO3和HClO3
3. 在标准状况下,下列各组物质体积相同时,分子数也相同的是
A. SO2 、SO3 B. SO2 、O2 C. SO2 、CCl4 D. SO2 、PCl5
4. 除去 SO2中的SO3 ,并得到纯净的SO2 ,最好使混合气体通过
A. 水 B. NaHSO3饱和溶液 C. NaHCO3饱和溶液 D. 98 . 3 %浓硫酸
5. 元素周期表前7周期的元素如下:
周期
1
2
3
4
5
6
7
元素数
2
8
8
18
18
32
32
分析周期表与元素数的关系,请预言第 8 周期最多可能含有的元素种数是
A. 18 B. 32 C . 50 D. 64
6. 储存浓H2SO4的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的
A. 吸水性和酸性 B. 脱水性和吸水性
C. 强氧化性和吸水性 D . 不挥发性和酸性
7. 镁、锂在元素周期表中具有特殊的“对角线”位置关系,它们的性质相似,例如,它
们的单质在过量氧气中燃烧时均只能生成正常的氧化物 …… 等。以下叙述锂的性质正确的是
A. Li2SO4难溶于水 B. Li与水剧烈反应
C. LiOH是易溶于水,受热不分解的强碱 D. Li2CO3受热分解,生成Li2O和CO2
8. 近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血
管功能具有重要作用。下列叙述正确的是
A. 硫化氢分子很稳定,受热难分解
B. 硫化氢分子中所有原子的最外层电子都达到8电子结构
C. 将硫化氢通入溴水,溴水褪色
D. 硫化氢是电解质,其电离方程式是 H2S = 2H + + S 2-
9. 下列说法正确的是
A. 难失电子的原子,得电子的能力一定强
B. 易得电子的原子,失电子的能力一定弱
C. 电子层结构相同的单核离了,阳离子半径一定比阴离子半径大
D. 任何原子的原子核都是由质子和中子构成的
10. 与10 g H216O所含中子数相等的D216O ,其质量最接近于
A. 6 . 7 g B. 8 . 9 g C. 10 . 2 g D. 12 . 4 g
11. A 、B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等
于中子数。① 若A为ⅡA族,其质量数为X ,则B的质子数为Y;② 若A为ⅣA族,其质子数为m ,则B质量数为n ,则Y和n的值是
A . ( + 18 ) 和 ( 2 m + 18 ) B . ( + 8 ) 和 ( 2 m + 18 )
C . ( + 8 ) 和 ( 2 m + 36 ) D . ( + 18 ) 和 ( 2 m + 36 )
12. X 、Y 、Z是1 ~ 18号的三种元素,它们的离子具有相同的电子层结构。若Y与Z
能形成YZ 3型离子化合物,Z的离子半径大于X离子的半径,则三种元素的原子半径由大到小的顺序是
A . X > Y > Z B . Y > X > Z C . X > Z > Y D . Z > X >Y
13. 下列叙述正确的是
A . 单质分子中一定存在着共价键
B . 气态物质中一定存在着共价键
C . 全部由非金属元素构成的化合物一定不存在离子键
D . 在共价化合物中一定含有共价键
14. 下列说法正确的是
A . X m + 与Y n- 与氖原子的电子层结构相同,原子半径前者大于后者
B . NaF和MgI 2 中阳离子与阴离子半径之比,前者小于后者
C . 168 O和178 O原子的核外电子数,前者大于后者
D . PH 3 和H 2 S的稳定性,前者大于后者
15. 某种由K 2 S和Al 2 S 3 组成的混合物中,这两种组分的物质的量之比为3∶2 ,那么
含有32 g 硫元素的该混合物的质量是
A. 35 g B. 50 g C. 60 g D. 70 g
16. 在同温同压下,24 mL H2S在30 mL O2中燃烧,相同条件下得到SO2气体的体积为
A . 24 mL B . 30 mL C . 20 mL D . 18 mL
二. 填空题 (本大题共4个小题,共15分)
17. (4分) 书写下列微粒的电子式:
⑴ CS2 ; ⑵ HClO ;
⑶ Na2O2 ; ⑷ Ca (OH)2 。
18. (6分) 某溶液中含有SO42- 、CO32- 、OH - 三种阴离子,如果只取一次溶液,分别
将这三种离子检验出来,那么应:
⑴ 先检验 ,加入 试剂(或溶液)
⑵ 再检验 ,加入 试剂(或溶液)
⑶ 最后检验 ,加入 试剂 (或溶液)
19. (3分) 原子序数小于20的A、B、C、D四种元素,最高正价依次为1、4、5、7,核
电荷数按B、C、D、A顺序递增,已知B原子次外层为2个电子,C、D、A原子次外层为8个电子,则这四种元素的原子的质子数之和为 。
20. (2分) 两个硫酸分子可以脱去1分子水生成焦硫酸( H2S2O7 ) ,已知硫酸的分子中有4
个硫氧键,则焦硫酸分子中硫氧键的数目是
三. 推断题 (本大题共2个小题,共14分)
21. (6分) m 、n 、x 、y 四种主族元素在周期表里的相对位置如图所示。
已知它们的原子序数总和为46 ,则:
⑴ 元素n的气态氢化物的电子式为
⑵ m与y所形成的化合物含 键
⑶ x的原子结构示意图为
⑷ 由n 、y的氢化物相互作用所生成的物质的化学式为
22. (8分) 已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为
35 ,A到H是八种常见的化合物。上述各物质间的相互关系如下图所示 (反应条件省略)
试回答:
⑴ 丙的化学式
⑵ 用电子式表示A的形成过程
⑶ 写出① 、②两步的化学方程式:
①
②
三. 实验题 (本大题共1个小题,13分)
23. (13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产
生的气体是SO2 ,而乙同学认为除SO2 气体外,还可能产生H2 。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置 (锌与浓硫酸共热时产生的气体为X ,且该装置略去) 。
试回答:
⑴ 上述反应中生成SO2的化学方程式为
⑵ 乙同学认为还可能产生H2的理由是
。
⑶ A中加入的试剂可能是 ,作用是 ;
B中加入的试剂可能是 ,作用是 ;
E中加入的试剂可能是 ,作用是 。
⑷ 可以证明气体X中含有H2的实验现象是:C中 ,
D中 。
⑸ 如果去掉装置B,还能否根据D中的现象判断气体X中是否有H2 (填“能”
或“不能”) ,原因是
。
四. 计算题 (本大题共1个小题,10分)
24. (10分) 向氢氧化钠溶液中慢慢地通入二氧化硫气体,反应生成正盐,当继续通入过量
二氧化硫时,正盐便转化成酸式盐。
⑴ 写出上述反应的化学方程式
①
②
⑵ 标准状态下,向100 mL 2 mol/L的NaOH溶液中通入3 . 36 L二氧化硫气体,反应后
溶液中溶质的成分为 。
⑶ 试计算,在标准状态下,100 mL 2 mol/L的NaOH溶液中最多可吸收多少体积二氧
化硫气体?
南昌市2005—2006学年第二学期期中考试
( 重点 ) 高一化学参考答案和评分标准
一. 选择题 (每小题只有一个正确答案,每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
D
C
A
D
C
题号
9
10
11
12
13
14
15
16
答案
B
B
C
A
D
A
D
D
二. 填空题 (本大题共4个小题,共15分)
17. (4分) 每个答案1分,共4分
⑴ S C S ⑵ H O Cl ⑶ Na+[ O O ]2-Na+
⑷ [ H O ]-Ca2+[ O H ]-
18. (6分) 每个答案1分,共6分
⑴ OH - 、酚酞 ⑵ CO32- 、盐酸 ⑶ SO42- 、BaCl2
19. (3分)
57 3分
20. (2分)
8 2分
三. 推断题 (本大题共2个小题,共14分)
21. (6分)
⑴ H N H 2分 ; ⑵ 极性 1分 ;
⑶ 1分 ; ⑷ NH4Cl 2分
22. (8分) 每个答案2分,共8分
⑴ O2 ; ⑵ Na + S + Na Na+ [ S ]2- Na+
⑶ ① 2SO2 + O2 2SO3
② 2Na2O2 + 2H2O = 4NaOH + O2↑
三. 实验题 (本大题共1个小题,13分)
23. (13分) ⑴Zn + 2H2 SO4 (浓) ZnSO4 + SO2↑+ 2H2O 2分
⑵ 在锌与浓硫酸反应过程中,浓硫酸浓度逐渐变稀,Zn与稀硫酸反应可产生H2 1分
⑶ 品红溶液 、检验SO2 ;浓硫酸 、吸收水蒸气 ; 碱石灰 、防止空气中的水蒸气进
入D中 每个答案1分
⑷ 黑色CuO变成红色的Cu ;白色粉末变成蓝色 每个答案1分
⑸不能、因为混合气体中可能含有H2O会干扰H2的检验 (其它合理答案均可)
每个答案1分
四. 计算题 (本大题共1个小题,10分)
24. (10分)
⑴ SO2+2NaOH Na2SO3+H2O 2分
Na2SO3+SO2+H2O 2NaHSO3 2分
⑵ Na2SO3 、NaHSO3 2分
⑶ 当NaOH溶液反应吸收最多体积二氧化硫气体时,反应为
SO2 + NaOH NaHSO3
1mol 1mol
0 . 2 mol x x = 0 . 2 mol
V(SO2)=22 . 4 L/mol×0 . 2 mol = 4 . 48 L 4分
同课章节目录
