2005~2006学年度上学期甘谷一中高一化学期末试卷-人教版[上学期]
文档属性
| 名称 | 2005~2006学年度上学期甘谷一中高一化学期末试卷-人教版[上学期] |  | |
| 格式 | zip | ||
| 文件大小 | 236.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-28 15:00:00 | ||
图片预览

文档简介
2005~2006学年度上学期
甘谷一中高一化学期末试卷
本试卷分第Ⅰ卷共60分,第Ⅱ卷共60分,满分120分,考试时间120分钟。
第Ⅰ卷 选择题
可能用到的相对原子质量:
H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 A1-27 S—32 C1-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137 Br-80
一、选择题(每小题只有一个正确答案,每小题3分,共60分。)
1.近年来,北京大部分公共汽车采用天然气作为汽车的燃料,其主要目的是( )。
A、防止石油短缺 B、降低成本
C、减少对大气的污染 D、加大发动机的动力
2.既是化合反应,又是氧化还原反应的是( )。
生石灰加水 ②SO2氧化成SO3 ③CO燃烧
④炽热的碳和水蒸气反应 ⑤钠和氯气反应
A.①②③ B.③④⑤ C.②③⑤ D.①④⑤
3.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI I2+2KCl ②2FeCl3+2HI I2+2FeCl2+2HCl
③2FeCl2+Cl2 2FeCl3 ④I2+SO2+2H2O 2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
4.某无色透明呈强碱性溶液中能大量共存的离子组是( )。
A.Na+ Cu2+ NO Cl— B.K+ NO Na+ Cl—
C.K+ CO NO Ca2+ D.K+ NO SO Mg2+
5.质量相同的两种气体A,B,在相同状况下,A的体积大于B,则( )。
A.A的密度比B大 B.A的分子数比B少
C.A的物质的量比B多 D.A的相对分子质量比B大
6.下列说法正确的是( )。
A.相同体积的氢气和氦气所含质子数相同
B.9克Al转变成Al3+时,失电子的数目为NA
C.11.2LHCl气体其物质的量为0.5mol
D.22.4L的某气体,在0℃时其物质的量为1mol
7.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,下列对砹及其化合物的叙述中,不正确的是( )。
A.At-的还原性强于Br-的还原性 B.NaAt属于离子化合物
C.At在常温下为白色固体 D.At不溶于水,易溶于CCl4
8.下列反应可用离子方程式:H++OH—=H2O表示的是( )。
A.硝酸与氨水 B.盐酸与氢氧化钠溶液
C.硫酸与氢氧化钡 D.硫酸与氢氧化钙
9.下列物质能使紫色石蕊试液由紫变红又褪色的是( )。
①Cl2 ②盐酸 ③氯水 ④盐酸酸化的漂白粉溶液 ⑤木炭
A.①②③ B.①③④ C.②③④ D.①③④⑤
10.下列反应的离子方程式正确的是( )。
A.氨气通入醋酸溶液 CH3COOH+NH3=CH3COONH4
B.澄清的石灰水与盐酸反应:H++OH—=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸钠与盐酸等物质的量反应:CO+2H+=H2O+CO2↑
11.在含有KBr、KI和K2CO3的混合溶液中,通入足量的Cl2,然后蒸干溶液,再灼烧固体,最后剩余的物质为( )。
A、KCl B、KCl和KClO
C、KBr和KCl D、KCl、KClO、K2CO3和I2
12.用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是( )。
A.在烧杯中溶解时,有少量液体溅出
B.样品中含有少量Na2O杂质
C.容量瓶使用前未干燥
D.定容时仰视容量瓶刻度线
13、如右图,A处通入Cl2,关闭B阀时, C处的红布条看
不到明显现象;当打开B阀后,C处的红布条逐渐褪色。
则D瓶中装的是
A、浓H2SO4 B、HCl溶液
C、 H2O D、饱和NaCl溶液
14.在一定体积的容器内,加入1.5mol氙气和7.5mol氟气,于400℃和2633kPa压强下,加热数小时,然后迅速冷至25℃,容器内除得一种晶体外,还余4.5mol氟气,则所得无色晶体产物中氙与氟的原子个数比为( )。
A.1:2 B.1:3 C.1:4 D.1:6
15.将100mL 0.6mol/L的盐酸和等体积0.4mol/L的Ba(OH)2溶液混合后,所得混合液的体积为二者之和,则混合液中OH-离子物质的量浓度是( )。
A.0.4mol/L B.0.2mol/L C.0.1mol/L D.0.05mol/L
16、下列反应发生时,会产生棕黄色烟的是 ( )
A.铜在氯气中燃烧 B.金属钠在氯气中燃烧
C.氢气在氯气中燃烧 D.钠在氧气中燃烧
17.配制1mol/L NaCl溶液250mL,在下列仪器中要用到的是( )
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯
⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑦ B.②③④⑤
C.①③⑤⑥⑨ D.②③⑤⑥⑧⑨
18、为防止溴挥发,实验室常在盛溴的试剂瓶中加入的试剂是 ( )
A.水 B.酒精 C. CCl4 D.碘化钾溶液
19.将KCl和KBr的混合物13.4g溶于水配成500mL溶液,通入过量的氯气,充分反应后将溶液蒸干得到11.175g固体,则原混合物溶液中K+、Cl-、Br-的物质的量浓度之比为( )。
A.3:2:1 B.1:2:3 C.1:3:2 D.2:3:1
20、24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2Cr2O7 溶液完全反应,则元素Cr 在被还原的产物中的化合价是
A、+6 B、+3 C、+2 D、0
第Ⅱ卷 非选择题
二、填空题(本题包括三个小题,共18分。)
21.(6分)卤族元素包括 ,它们原子的最外电子层有 个电子。卤素跟金属反应时容易__ ____电子,因此都具有较强的(填“氧化”或“还原”)_ _性。卤族元素随核电荷数的增加,活动性逐渐__ _ ,在卤化氢中,最稳定的是_ ___。
22.(6分)与16g氧气所含有分子数相同的氨气(NH3)是 g,与16g
氧气所含原子总数相同的氨气是 g;在相同条件下,在5.6g氮气中应
添加 g氨气所组成的混合气体与16g氧气所占的体积相等。
23.(6分)用同浓度的AgNO3溶液分别与同浓度等体积的NaCl、MgCl2、AlCl3溶液反应时,所用AgNO3溶液的体积比为 。如用同浓度等体积的AgNO3溶液分别与等浓度的NaCl、MgCl2、AlCl3溶液反应时,所用三种溶液的体积比为 。
三、推断题
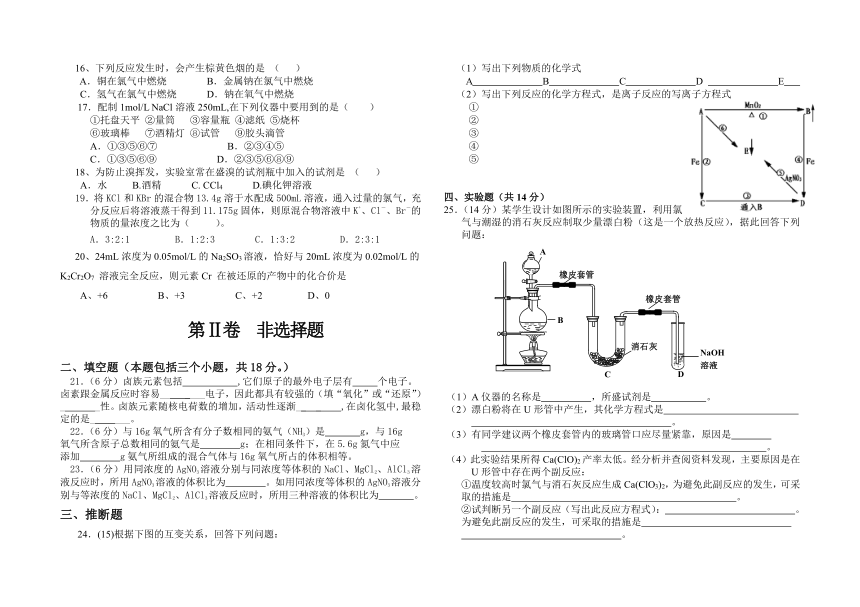
24.(15)根据下图的互变关系,回答下列问题:
(1)写出下列物质的化学式
A B C D E
(2)写出下列反应的化学方程式,是离子反应的写离子方程式
①
②
③
④
⑤
四、实验题(共14分)
25.(14分)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是 ,所盛试剂是 。
(2)漂白粉将在U形管中产生,其化学方程式是
。
(3)有同学建议两个橡皮套管内的玻璃管口应尽量紧靠,原因是
。
(4)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(写出此反应方程式): 。
为避免此副反应的发生,可采取的措施是
。
五、计算题(共13分)
26.(5分)市售浓硫酸中的物质的量浓度为,的质量分数为98%。计算该浓硫酸的密度。
27.(8分)把和的混合物29.6g加热到质量不再变化时,得残留固体26.5g。求原混合物中与的物质的量之比。
甘谷一中高一化学期末试题
参考答案
第Ⅰ卷 选择题
一、选择题(共60分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C C C B C B C B B B A B A C C
题号 16 17 18 19 20
答案 A C A A B
第Ⅱ卷 非选择题
二、填空题(本题包括三个小题,共17分。)
21.(7分)_氟、氯、溴、碘、砹__, __7___。__得_, __氧化_,
_减弱_,_HF___。(第一空2分,其余每空1分)
22.(6分) 8.5 , 4.25 ; 5.1 。(每空2分)
23.(6分) 1:2:3 ; 6:3:2 。(每空3分)
三、24.(15分)(1)HCl Cl2 FeCl2 FeCl3 AgCl
(2)①MnO2+4H++Cl-=Mn2++Cl2↑+H2O
②Fe+2H+Fe2++H2↑ ③2Fe2++Cl22Fe3++2Cl-
④2Fe+3Cl22FeCl3 ⑤Ag++Cl-AgCl↓
四、实验题(共14分)
25.(每空2分,共14分。)
(1)分液漏斗, 浓盐酸 。
(2)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(3)Cl2 可腐蚀橡胶管,可能造成Cl2的外漏而发生事故 。
(4)① 将U形管置于冷水浴中 。
②Ca(OH)2+2HCl===CaCl2+2H2O。
在B和C之间连接一个饱和食盐水的洗气瓶。
五、计算题(共13分)
26.(5分)
解:
答:该浓硫酸的密度为。
27.(8分)
解:
混合物中与的物质的量之比为
答:混合物中与的物质的量之比为。
消石灰
A
橡皮套管
橡皮套管
D
C
NaOH
溶液
B
甘谷一中高一化学期末试卷
本试卷分第Ⅰ卷共60分,第Ⅱ卷共60分,满分120分,考试时间120分钟。
第Ⅰ卷 选择题
可能用到的相对原子质量:
H-1 He-4 C-12 N-14 O-16 Na-23 Mg-24 A1-27 S—32 C1-35.5 K-39 Ca-40 Fe-56 Cu-64 Zn-65 Ag-108 Ba-137 Br-80
一、选择题(每小题只有一个正确答案,每小题3分,共60分。)
1.近年来,北京大部分公共汽车采用天然气作为汽车的燃料,其主要目的是( )。
A、防止石油短缺 B、降低成本
C、减少对大气的污染 D、加大发动机的动力
2.既是化合反应,又是氧化还原反应的是( )。
生石灰加水 ②SO2氧化成SO3 ③CO燃烧
④炽热的碳和水蒸气反应 ⑤钠和氯气反应
A.①②③ B.③④⑤ C.②③⑤ D.①④⑤
3.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )。
①Cl2+2KI I2+2KCl ②2FeCl3+2HI I2+2FeCl2+2HCl
③2FeCl2+Cl2 2FeCl3 ④I2+SO2+2H2O 2HI+H2SO4
A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2
4.某无色透明呈强碱性溶液中能大量共存的离子组是( )。
A.Na+ Cu2+ NO Cl— B.K+ NO Na+ Cl—
C.K+ CO NO Ca2+ D.K+ NO SO Mg2+
5.质量相同的两种气体A,B,在相同状况下,A的体积大于B,则( )。
A.A的密度比B大 B.A的分子数比B少
C.A的物质的量比B多 D.A的相对分子质量比B大
6.下列说法正确的是( )。
A.相同体积的氢气和氦气所含质子数相同
B.9克Al转变成Al3+时,失电子的数目为NA
C.11.2LHCl气体其物质的量为0.5mol
D.22.4L的某气体,在0℃时其物质的量为1mol
7.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,下列对砹及其化合物的叙述中,不正确的是( )。
A.At-的还原性强于Br-的还原性 B.NaAt属于离子化合物
C.At在常温下为白色固体 D.At不溶于水,易溶于CCl4
8.下列反应可用离子方程式:H++OH—=H2O表示的是( )。
A.硝酸与氨水 B.盐酸与氢氧化钠溶液
C.硫酸与氢氧化钡 D.硫酸与氢氧化钙
9.下列物质能使紫色石蕊试液由紫变红又褪色的是( )。
①Cl2 ②盐酸 ③氯水 ④盐酸酸化的漂白粉溶液 ⑤木炭
A.①②③ B.①③④ C.②③④ D.①③④⑤
10.下列反应的离子方程式正确的是( )。
A.氨气通入醋酸溶液 CH3COOH+NH3=CH3COONH4
B.澄清的石灰水与盐酸反应:H++OH—=H2O
C.碳酸钡加入稀硫酸:BaCO3+2H+=Ba2++H2O+CO2↑
D.碳酸钠与盐酸等物质的量反应:CO+2H+=H2O+CO2↑
11.在含有KBr、KI和K2CO3的混合溶液中,通入足量的Cl2,然后蒸干溶液,再灼烧固体,最后剩余的物质为( )。
A、KCl B、KCl和KClO
C、KBr和KCl D、KCl、KClO、K2CO3和I2
12.用固体NaOH配制一定物质的量浓度的溶液时,下列操作会导致溶液浓度偏高的是( )。
A.在烧杯中溶解时,有少量液体溅出
B.样品中含有少量Na2O杂质
C.容量瓶使用前未干燥
D.定容时仰视容量瓶刻度线
13、如右图,A处通入Cl2,关闭B阀时, C处的红布条看
不到明显现象;当打开B阀后,C处的红布条逐渐褪色。
则D瓶中装的是
A、浓H2SO4 B、HCl溶液
C、 H2O D、饱和NaCl溶液
14.在一定体积的容器内,加入1.5mol氙气和7.5mol氟气,于400℃和2633kPa压强下,加热数小时,然后迅速冷至25℃,容器内除得一种晶体外,还余4.5mol氟气,则所得无色晶体产物中氙与氟的原子个数比为( )。
A.1:2 B.1:3 C.1:4 D.1:6
15.将100mL 0.6mol/L的盐酸和等体积0.4mol/L的Ba(OH)2溶液混合后,所得混合液的体积为二者之和,则混合液中OH-离子物质的量浓度是( )。
A.0.4mol/L B.0.2mol/L C.0.1mol/L D.0.05mol/L
16、下列反应发生时,会产生棕黄色烟的是 ( )
A.铜在氯气中燃烧 B.金属钠在氯气中燃烧
C.氢气在氯气中燃烧 D.钠在氧气中燃烧
17.配制1mol/L NaCl溶液250mL,在下列仪器中要用到的是( )
①托盘天平 ②量筒 ③容量瓶 ④滤纸 ⑤烧杯
⑥玻璃棒 ⑦酒精灯 ⑧试管 ⑨胶头滴管
A.①③⑤⑥⑦ B.②③④⑤
C.①③⑤⑥⑨ D.②③⑤⑥⑧⑨
18、为防止溴挥发,实验室常在盛溴的试剂瓶中加入的试剂是 ( )
A.水 B.酒精 C. CCl4 D.碘化钾溶液
19.将KCl和KBr的混合物13.4g溶于水配成500mL溶液,通入过量的氯气,充分反应后将溶液蒸干得到11.175g固体,则原混合物溶液中K+、Cl-、Br-的物质的量浓度之比为( )。
A.3:2:1 B.1:2:3 C.1:3:2 D.2:3:1
20、24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2Cr2O7 溶液完全反应,则元素Cr 在被还原的产物中的化合价是
A、+6 B、+3 C、+2 D、0
第Ⅱ卷 非选择题
二、填空题(本题包括三个小题,共18分。)
21.(6分)卤族元素包括 ,它们原子的最外电子层有 个电子。卤素跟金属反应时容易__ ____电子,因此都具有较强的(填“氧化”或“还原”)_ _性。卤族元素随核电荷数的增加,活动性逐渐__ _ ,在卤化氢中,最稳定的是_ ___。
22.(6分)与16g氧气所含有分子数相同的氨气(NH3)是 g,与16g
氧气所含原子总数相同的氨气是 g;在相同条件下,在5.6g氮气中应
添加 g氨气所组成的混合气体与16g氧气所占的体积相等。
23.(6分)用同浓度的AgNO3溶液分别与同浓度等体积的NaCl、MgCl2、AlCl3溶液反应时,所用AgNO3溶液的体积比为 。如用同浓度等体积的AgNO3溶液分别与等浓度的NaCl、MgCl2、AlCl3溶液反应时,所用三种溶液的体积比为 。
三、推断题
24.(15)根据下图的互变关系,回答下列问题:
(1)写出下列物质的化学式
A B C D E
(2)写出下列反应的化学方程式,是离子反应的写离子方程式
①
②
③
④
⑤
四、实验题(共14分)
25.(14分)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
(1)A仪器的名称是 ,所盛试剂是 。
(2)漂白粉将在U形管中产生,其化学方程式是
。
(3)有同学建议两个橡皮套管内的玻璃管口应尽量紧靠,原因是
。
(4)此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是 。
②试判断另一个副反应(写出此反应方程式): 。
为避免此副反应的发生,可采取的措施是
。
五、计算题(共13分)
26.(5分)市售浓硫酸中的物质的量浓度为,的质量分数为98%。计算该浓硫酸的密度。
27.(8分)把和的混合物29.6g加热到质量不再变化时,得残留固体26.5g。求原混合物中与的物质的量之比。
甘谷一中高一化学期末试题
参考答案
第Ⅰ卷 选择题
一、选择题(共60分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C C C B C B C B B B A B A C C
题号 16 17 18 19 20
答案 A C A A B
第Ⅱ卷 非选择题
二、填空题(本题包括三个小题,共17分。)
21.(7分)_氟、氯、溴、碘、砹__, __7___。__得_, __氧化_,
_减弱_,_HF___。(第一空2分,其余每空1分)
22.(6分) 8.5 , 4.25 ; 5.1 。(每空2分)
23.(6分) 1:2:3 ; 6:3:2 。(每空3分)
三、24.(15分)(1)HCl Cl2 FeCl2 FeCl3 AgCl
(2)①MnO2+4H++Cl-=Mn2++Cl2↑+H2O
②Fe+2H+Fe2++H2↑ ③2Fe2++Cl22Fe3++2Cl-
④2Fe+3Cl22FeCl3 ⑤Ag++Cl-AgCl↓
四、实验题(共14分)
25.(每空2分,共14分。)
(1)分液漏斗, 浓盐酸 。
(2)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(3)Cl2 可腐蚀橡胶管,可能造成Cl2的外漏而发生事故 。
(4)① 将U形管置于冷水浴中 。
②Ca(OH)2+2HCl===CaCl2+2H2O。
在B和C之间连接一个饱和食盐水的洗气瓶。
五、计算题(共13分)
26.(5分)
解:
答:该浓硫酸的密度为。
27.(8分)
解:
混合物中与的物质的量之比为
答:混合物中与的物质的量之比为。
消石灰
A
橡皮套管
橡皮套管
D
C
NaOH
溶液
B
同课章节目录
