安徽省滁州市重点中学2005~2006学年第一学期期末联考高一化学试卷-人教版[上学期]
文档属性
| 名称 | 安徽省滁州市重点中学2005~2006学年第一学期期末联考高一化学试卷-人教版[上学期] |  | |
| 格式 | zip | ||
| 文件大小 | 287.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-28 14:57:00 | ||
图片预览


文档简介
安徽省滁州市重点中学2005~2006学年度第一学期期末联考
高一化学试题
考生注意:1。本试卷满分100分,答题时间100分钟。
2.试卷包括“试题卷”和“答题卷”两部分,请务必在“答题卷”上答题。
一、选择题:(每小题只有一个选项符合题意,每小题2分,共30分。)
1.下列物质在给定状态下能明显导电的是:
固体氯化钠 B.液态纯硫酸 C.乙醇溶液 D.液态氢氧化钾
2.下列微粒中,只有还原性的是:
A.Br- B.S C.Mg2+ D.H2O
3.与Mg2++2OH-=Mg(OH)2↓相对应的化学方程式是:
A.MgCl2+Cu(OH)2=Mg(OH)2↓+CuCl2
B.MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓
C.Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3
D.Mg(HCO3)2+2NaOH=Mg(OH)2↓+2NaHCO3
4.在下列反应中,属于离子反应,同时溶液的颜色发生变化的是:
A.BaCl2溶液与K2SO4溶液反应 B.点燃H2与Cl2的混合气体
C.NaOH溶液与CuSO4溶液反应 D.CuSO4·5H2O受热分解
5.在下列物质的水溶液中分别加入澄清石灰水后,原溶液中的阴离子和阳离子都减少的是:
A.CuSO4 B.Ba(NO3)2 C.Na2CO3 D.FeCl2
6.在0.5L溶有0.05mol/L NaCl和0.05mol/L CuCl2的溶液中,Cl-的物质的量浓度为:
A.0.05mol/L B.0.1mol/L C.0.15mol/L D.0.3mol/L
7.在某酸性无色溶液中能大量共存的离子组是:
A.Na+、Fe3+、NO3-、Cl- B.K+、Na+、Cl-、SO42-
C.K+、Cu2+、Cl-、NO3-、 D.OH-、Na+、CO32-、K+
8.欲除去小苏打溶液中少量的苏打杂质,最宜选用的物质是:
A.二氧化碳 B.盐酸 C.碳酸氢钙 D.氢氧化钙
9.将CO2通入CaCl2溶液中,未见沉淀生成,再加入下列试剂后即有白色沉淀产生的是
A.盐酸 B.硝酸钡 C.氯化钠 D.氧化钠
10.下列说法正确的是:
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.强电解质在书写离子方程式时都应写成离子形式
11.氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O=NaOH+H2↑,对这一反应的描述正确的是:
A.NaH是氧化剂 B.NaOH是氧化产物
C.NaOH是还原产物 D.氧化产物和还原产物的质量比是1︰1
12.下列关于气体摩尔体积的说法正确的是:
A.非标准状况下,1mol任何气体不可能占有22.4L体积
B.在某温度、某压强下,1mol某气体的体积为30L,则在这种条件下,该气体的摩尔体积为30L/mol
C.0.5molH2和0.5molO2组成的混合气体在标准状况下体积一定大于22.4L
D.22.4L任何气体的物质的量为1mol
13.下列有关阿伏加德罗常数(NA)的描述正确的是:
A.1mol物质均约含有6.02×1023个分子 B.NA个氢气分子就是1molH2
C.NA个氧原子的质量约为32g D.NA通常使用6.02×1023这个近似值
14.制完氧气的试管壁上沾有MnO2,欲除去最好选用:
A.NaOH溶液 B.浓盐酸 C.水 D.稀盐酸
15.下列反应中,能说明卤素的非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br(g)=2HBrO4+Cl2 ②2NaBr+Cl2=2KCl+I2
③2KI+Cl2=2KCl+I2 ④2KI+Br2=2KBr+I2
A.①②③ B.①②④ C.②③④ D.①②③④
二、选择题:(每小题只有一个选项符合题意,每小题3分,共计15分。)
16.把紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入过量Cl2时,溶液由蓝变红,最后颜色慢慢消失,发生上述现象的原因是:①Cl2本身有漂白性 ②Cl2与NaOH溶液反应 ③盐酸有酸性 ④HClO有漂白性 ⑤NaClO有漂白性
A.①②③ B.②③④ C.②③⑤ D.①②③④⑤
17.某溶液中存在有五种离子,其中各离子的物质的量之比为:
n(NO3-)︰ n(SO42-) ︰n(Fe3+) ︰ n(H+) ︰n(M)=2︰3︰1︰3︰1,则M可能为
A.Mg2+ B.CO32- C.Ba2+ D.Cl-
18.若锌与稀硝酸反应时有下列化学反应方程式:4Zn+10HNO3=aZn(NO3)2+bM+cH2O
则a,b,c,M可能是
A.4,1,5,NO B.4,2,4,N2O C.4,1,3,NH4NO3 D.4,3,5,NO
19.已知4g RO32-中核外电子数比质子数多6.02×1023个,则元素R的相对原子质量为
A.12 B.27 C.32 D.80
20.实验室也常用KClO3和浓盐酸反应制取氯气,化学方程式为
KClO3+6HCl(浓)=KCl+3Cl2+3H2O,若生成71g氯气,则被氧化的氯化氢为
A.73g B.×36.5g C.3×36.5g D.×36.5g
三、填空题:(32分)
21.(5分)卤素元素以F、Cl、Br、I的顺序,其原子半径逐渐 ,元素的氧化性逐渐 ,与氢气反应的剧烈程度逐渐 ,相同条件下,单质的密度逐渐 ,熔点逐渐 。
22.(2分)摩尔是 的单位,1mol任何粒子的粒子数叫做阿伏加德罗常数。通常使用 这个近似值。
23.(5分)在1981年才第一次制得卤族元素的第五个成员砹(At),根据卤素性质的变化规律,我们可以预料到砹有下列性质:
(1)砹在室温下的状态是固体,颜色比碘 ,夺电子能力比碘 ,
没有挥发性,并 (填“溶”或“不溶”)于四氯化碳。
(2)AgAt的颜色比AgI ,难溶于水,HAt的稳定性比HI 。
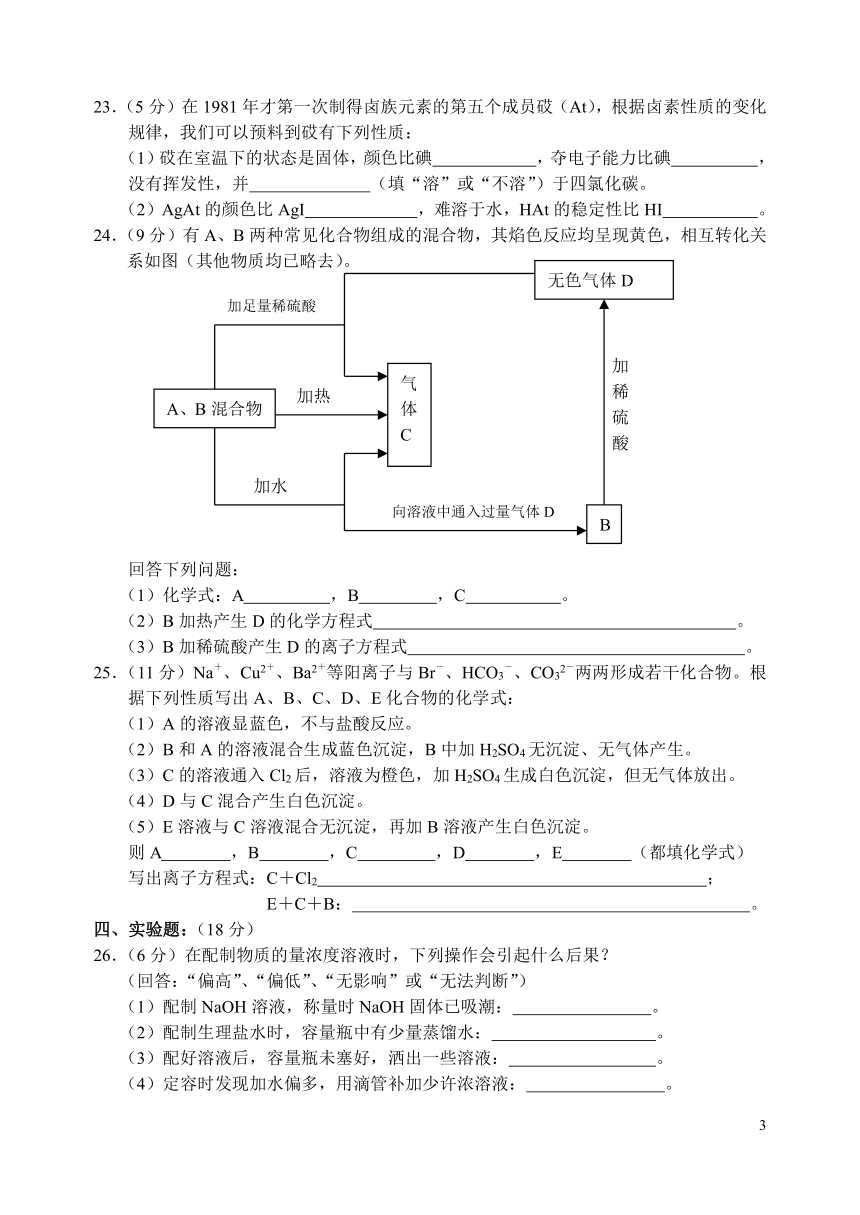
24.(9分)有A、B两种常见化合物组成的混合物,其焰色反应均呈现黄色,相互转化关系如图(其他物质均已略去)。
回答下列问题:
(1)化学式:A ,B ,C 。
(2)B加热产生D的化学方程式 。
(3)B加稀硫酸产生D的离子方程式 。
25.(11分)Na+、Cu2+、Ba2+等阳离子与Br-、HCO3-、CO32-两两形成若干化合物。根据下列性质写出A、B、C、D、E化合物的化学式:
(1)A的溶液显蓝色,不与盐酸反应。
(2)B和A的溶液混合生成蓝色沉淀,B中加H2SO4无沉淀、无气体产生。
(3)C的溶液通入Cl2后,溶液为橙色,加H2SO4生成白色沉淀,但无气体放出。
(4)D与C混合产生白色沉淀。
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀。
则A ,B ,C ,D ,E (都填化学式)
写出离子方程式:C+Cl2 ;
E+C+B: 。
四、实验题:(18分)
26.(6分)在配制物质的量浓度溶液时,下列操作会引起什么后果?
(回答:“偏高”、“偏低”、“无影响”或“无法判断”)
(1)配制NaOH溶液,称量时NaOH固体已吸潮: 。
(2)配制生理盐水时,容量瓶中有少量蒸馏水: 。
(3)配好溶液后,容量瓶未塞好,洒出一些溶液: 。
(4)定容时发现加水偏多,用滴管补加少许浓溶液: 。
(5)定容时,俯视刻度线与液面: 。
(6)将取溶质的药匙用水洗涤,洗涤液倒入容量瓶: 。
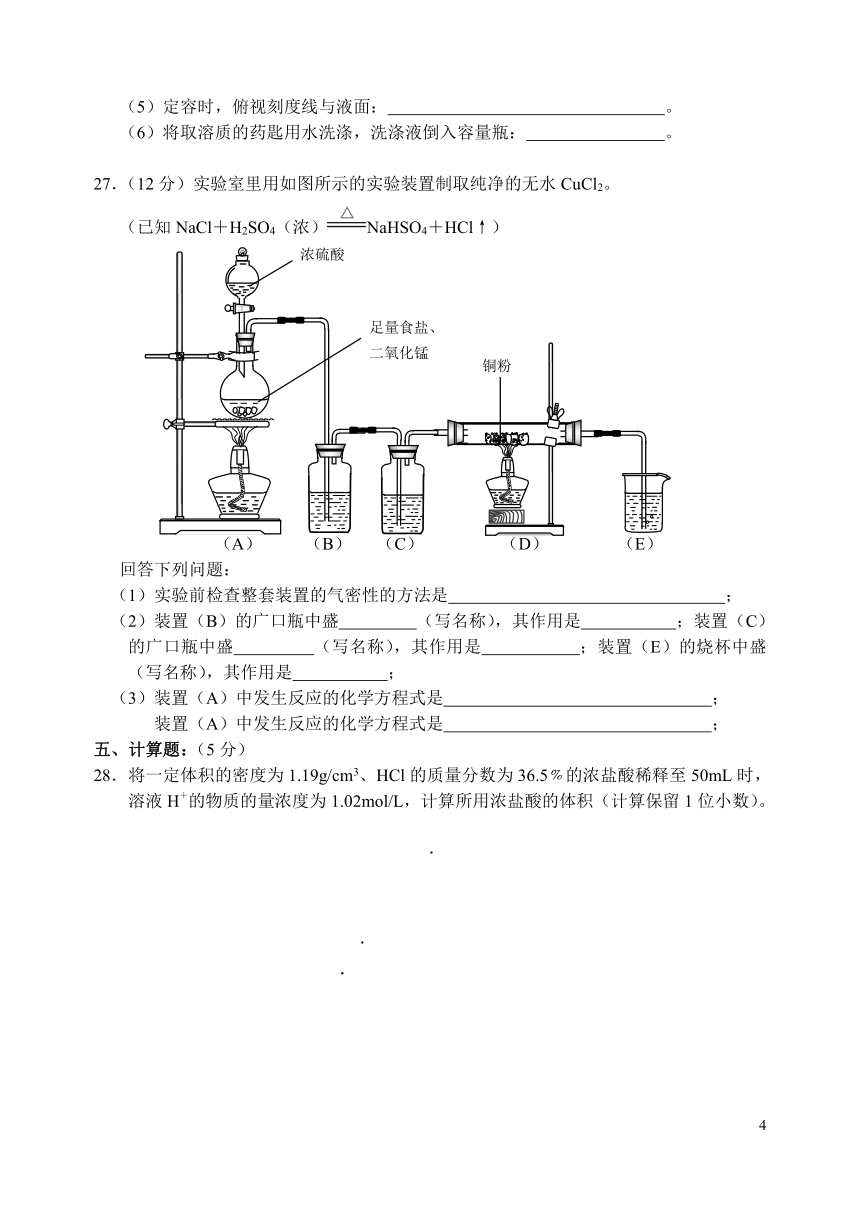
27.(12分)实验室里用如图所示的实验装置制取纯净的无水CuCl2。
(已知NaCl+H2SO4(浓)NaHSO4+HCl↑)
(A) (B) (C) (D) (E)
回答下列问题:
(1)实验前检查整套装置的气密性的方法是 ;
(2)装置(B)的广口瓶中盛 (写名称),其作用是 ;装置(C)的广口瓶中盛 (写名称),其作用是 ;装置(E)的烧杯中盛 (写名称),其作用是 ;
(3)装置(A)中发生反应的化学方程式是 ;
装置(A)中发生反应的化学方程式是 ;
五、计算题:(5分)
28.将一定体积的密度为1.19g/cm3、HCl的质量分数为36.5﹪的浓盐酸稀释至50mL时,溶液H+的物质的量浓度为1.02mol/L,计算所用浓盐酸的体积(计算保留1位小数)。
安徽省滁州市重点中学2005~2006学年度第一学期期末联考
高一化学试题答题卷
题号 一 二 三 四 五 总分
得分
原子量:H—1 Cl—35.5
得 分 评卷人
一、选择题:(每小题只有一个选项符合题意,每小题2分,共30分。)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
得 分 评卷人
二、选择题:(每小题只有一个选项符合题意,每小题3分,共计15分。)
题号 16 17 18 19 20
答案
得 分 评卷人
三、填空题:(共32分)
21.(5分)
22.(2分)
23.(5分)(1)
(2)
24.(9分)(1)A B C
(2)
25.(11分)(1)A B C D
E
C+Cl2:
E+C+B:
得 分 评卷人
四、实验题:(共18分)
26.(6分)(1) (2) (3)
(4) (5) (6)
27.(12分)(1)
(2)
(3)
得 分 评卷人
五、计算题:(5分)
28.解:
参考答案
一、选择题:(每小题2分,共30分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 D A C C A D B A D B D B B B D
二、选择题:
题号 16 17 18 19 20
答案 B A C C B
三、填空题:(共32分)
21.(5分)增大、减弱、减弱、增大、升高(各1分)
22.(2分)物质的量、6.02×1023mol-1(各1分)
23.(5分)(1)深、弱、溶 (2)深、弱 (每空1空)
24.(9分)(1)A:Na2O2 B:NaHCO3 C:O2(各1分)
(2)2NaHCO3Na2CO3+H2O+CO2↑(3分)
HCO3-+H+=H2O+CO2↑(3分)
25.(11分)A:CuBr2 B:NaOH C:BaBr2 D:Na2CO3 E:NaHCO3〔或Ba(HCO3)2〕
C+Cl2:2Br-+Cl2=Br2+2Cl-
E+C+B:HCO3-+Ba2++OH-=BaCO3↓+H2O
四、实验题:(共18分)
26.(6分) (1)偏低 (2)无影响 (3)无影响 (4)无法判断
(5)偏高 (6)偏高
27.(12分)(1)用酒精灯微热烧瓶,看E中是否有气泡产生。
(2)饱和食盐水(或水),洗去HCl气体
浓硫酸 干燥氯气 强碱溶液 吸收多余氯气,防止污染(每空1分)
(3)2NaCl+3H2SO4(浓)+MnO22NaHSO4+Cl2↑+MnSO4+H2O(3分)
(合理答案均给分)
Cl2+2NaOH=NaClO+NaCl+H2O (合理答案均给分)
五、计算题:(5分)
28.解:浓盐酸的物质的量浓度为
c(HCl)==
=11.9mol/L
则V(浓盐酸)=
=
=0.0043L
=44.3mL
答:所用浓盐酸的体积为4.3mL
加稀硫酸
向溶液中通入过量气体D
加水
加热
加足量稀硫酸
A、B混合物
气体
C
无色气体D
B
浓硫酸
足量食盐、
二氧化锰
铜粉
PAGE
1
高一化学试题
考生注意:1。本试卷满分100分,答题时间100分钟。
2.试卷包括“试题卷”和“答题卷”两部分,请务必在“答题卷”上答题。
一、选择题:(每小题只有一个选项符合题意,每小题2分,共30分。)
1.下列物质在给定状态下能明显导电的是:
固体氯化钠 B.液态纯硫酸 C.乙醇溶液 D.液态氢氧化钾
2.下列微粒中,只有还原性的是:
A.Br- B.S C.Mg2+ D.H2O
3.与Mg2++2OH-=Mg(OH)2↓相对应的化学方程式是:
A.MgCl2+Cu(OH)2=Mg(OH)2↓+CuCl2
B.MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓
C.Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3
D.Mg(HCO3)2+2NaOH=Mg(OH)2↓+2NaHCO3
4.在下列反应中,属于离子反应,同时溶液的颜色发生变化的是:
A.BaCl2溶液与K2SO4溶液反应 B.点燃H2与Cl2的混合气体
C.NaOH溶液与CuSO4溶液反应 D.CuSO4·5H2O受热分解
5.在下列物质的水溶液中分别加入澄清石灰水后,原溶液中的阴离子和阳离子都减少的是:
A.CuSO4 B.Ba(NO3)2 C.Na2CO3 D.FeCl2
6.在0.5L溶有0.05mol/L NaCl和0.05mol/L CuCl2的溶液中,Cl-的物质的量浓度为:
A.0.05mol/L B.0.1mol/L C.0.15mol/L D.0.3mol/L
7.在某酸性无色溶液中能大量共存的离子组是:
A.Na+、Fe3+、NO3-、Cl- B.K+、Na+、Cl-、SO42-
C.K+、Cu2+、Cl-、NO3-、 D.OH-、Na+、CO32-、K+
8.欲除去小苏打溶液中少量的苏打杂质,最宜选用的物质是:
A.二氧化碳 B.盐酸 C.碳酸氢钙 D.氢氧化钙
9.将CO2通入CaCl2溶液中,未见沉淀生成,再加入下列试剂后即有白色沉淀产生的是
A.盐酸 B.硝酸钡 C.氯化钠 D.氧化钠
10.下列说法正确的是:
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.强电解质在书写离子方程式时都应写成离子形式
11.氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH+H2O=NaOH+H2↑,对这一反应的描述正确的是:
A.NaH是氧化剂 B.NaOH是氧化产物
C.NaOH是还原产物 D.氧化产物和还原产物的质量比是1︰1
12.下列关于气体摩尔体积的说法正确的是:
A.非标准状况下,1mol任何气体不可能占有22.4L体积
B.在某温度、某压强下,1mol某气体的体积为30L,则在这种条件下,该气体的摩尔体积为30L/mol
C.0.5molH2和0.5molO2组成的混合气体在标准状况下体积一定大于22.4L
D.22.4L任何气体的物质的量为1mol
13.下列有关阿伏加德罗常数(NA)的描述正确的是:
A.1mol物质均约含有6.02×1023个分子 B.NA个氢气分子就是1molH2
C.NA个氧原子的质量约为32g D.NA通常使用6.02×1023这个近似值
14.制完氧气的试管壁上沾有MnO2,欲除去最好选用:
A.NaOH溶液 B.浓盐酸 C.水 D.稀盐酸
15.下列反应中,能说明卤素的非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br(g)=2HBrO4+Cl2 ②2NaBr+Cl2=2KCl+I2
③2KI+Cl2=2KCl+I2 ④2KI+Br2=2KBr+I2
A.①②③ B.①②④ C.②③④ D.①②③④
二、选择题:(每小题只有一个选项符合题意,每小题3分,共计15分。)
16.把紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入过量Cl2时,溶液由蓝变红,最后颜色慢慢消失,发生上述现象的原因是:①Cl2本身有漂白性 ②Cl2与NaOH溶液反应 ③盐酸有酸性 ④HClO有漂白性 ⑤NaClO有漂白性
A.①②③ B.②③④ C.②③⑤ D.①②③④⑤
17.某溶液中存在有五种离子,其中各离子的物质的量之比为:
n(NO3-)︰ n(SO42-) ︰n(Fe3+) ︰ n(H+) ︰n(M)=2︰3︰1︰3︰1,则M可能为
A.Mg2+ B.CO32- C.Ba2+ D.Cl-
18.若锌与稀硝酸反应时有下列化学反应方程式:4Zn+10HNO3=aZn(NO3)2+bM+cH2O
则a,b,c,M可能是
A.4,1,5,NO B.4,2,4,N2O C.4,1,3,NH4NO3 D.4,3,5,NO
19.已知4g RO32-中核外电子数比质子数多6.02×1023个,则元素R的相对原子质量为
A.12 B.27 C.32 D.80
20.实验室也常用KClO3和浓盐酸反应制取氯气,化学方程式为
KClO3+6HCl(浓)=KCl+3Cl2+3H2O,若生成71g氯气,则被氧化的氯化氢为
A.73g B.×36.5g C.3×36.5g D.×36.5g
三、填空题:(32分)
21.(5分)卤素元素以F、Cl、Br、I的顺序,其原子半径逐渐 ,元素的氧化性逐渐 ,与氢气反应的剧烈程度逐渐 ,相同条件下,单质的密度逐渐 ,熔点逐渐 。
22.(2分)摩尔是 的单位,1mol任何粒子的粒子数叫做阿伏加德罗常数。通常使用 这个近似值。
23.(5分)在1981年才第一次制得卤族元素的第五个成员砹(At),根据卤素性质的变化规律,我们可以预料到砹有下列性质:
(1)砹在室温下的状态是固体,颜色比碘 ,夺电子能力比碘 ,
没有挥发性,并 (填“溶”或“不溶”)于四氯化碳。
(2)AgAt的颜色比AgI ,难溶于水,HAt的稳定性比HI 。
24.(9分)有A、B两种常见化合物组成的混合物,其焰色反应均呈现黄色,相互转化关系如图(其他物质均已略去)。
回答下列问题:
(1)化学式:A ,B ,C 。
(2)B加热产生D的化学方程式 。
(3)B加稀硫酸产生D的离子方程式 。
25.(11分)Na+、Cu2+、Ba2+等阳离子与Br-、HCO3-、CO32-两两形成若干化合物。根据下列性质写出A、B、C、D、E化合物的化学式:
(1)A的溶液显蓝色,不与盐酸反应。
(2)B和A的溶液混合生成蓝色沉淀,B中加H2SO4无沉淀、无气体产生。
(3)C的溶液通入Cl2后,溶液为橙色,加H2SO4生成白色沉淀,但无气体放出。
(4)D与C混合产生白色沉淀。
(5)E溶液与C溶液混合无沉淀,再加B溶液产生白色沉淀。
则A ,B ,C ,D ,E (都填化学式)
写出离子方程式:C+Cl2 ;
E+C+B: 。
四、实验题:(18分)
26.(6分)在配制物质的量浓度溶液时,下列操作会引起什么后果?
(回答:“偏高”、“偏低”、“无影响”或“无法判断”)
(1)配制NaOH溶液,称量时NaOH固体已吸潮: 。
(2)配制生理盐水时,容量瓶中有少量蒸馏水: 。
(3)配好溶液后,容量瓶未塞好,洒出一些溶液: 。
(4)定容时发现加水偏多,用滴管补加少许浓溶液: 。
(5)定容时,俯视刻度线与液面: 。
(6)将取溶质的药匙用水洗涤,洗涤液倒入容量瓶: 。
27.(12分)实验室里用如图所示的实验装置制取纯净的无水CuCl2。
(已知NaCl+H2SO4(浓)NaHSO4+HCl↑)
(A) (B) (C) (D) (E)
回答下列问题:
(1)实验前检查整套装置的气密性的方法是 ;
(2)装置(B)的广口瓶中盛 (写名称),其作用是 ;装置(C)的广口瓶中盛 (写名称),其作用是 ;装置(E)的烧杯中盛 (写名称),其作用是 ;
(3)装置(A)中发生反应的化学方程式是 ;
装置(A)中发生反应的化学方程式是 ;
五、计算题:(5分)
28.将一定体积的密度为1.19g/cm3、HCl的质量分数为36.5﹪的浓盐酸稀释至50mL时,溶液H+的物质的量浓度为1.02mol/L,计算所用浓盐酸的体积(计算保留1位小数)。
安徽省滁州市重点中学2005~2006学年度第一学期期末联考
高一化学试题答题卷
题号 一 二 三 四 五 总分
得分
原子量:H—1 Cl—35.5
得 分 评卷人
一、选择题:(每小题只有一个选项符合题意,每小题2分,共30分。)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案
得 分 评卷人
二、选择题:(每小题只有一个选项符合题意,每小题3分,共计15分。)
题号 16 17 18 19 20
答案
得 分 评卷人
三、填空题:(共32分)
21.(5分)
22.(2分)
23.(5分)(1)
(2)
24.(9分)(1)A B C
(2)
25.(11分)(1)A B C D
E
C+Cl2:
E+C+B:
得 分 评卷人
四、实验题:(共18分)
26.(6分)(1) (2) (3)
(4) (5) (6)
27.(12分)(1)
(2)
(3)
得 分 评卷人
五、计算题:(5分)
28.解:
参考答案
一、选择题:(每小题2分,共30分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 D A C C A D B A D B D B B B D
二、选择题:
题号 16 17 18 19 20
答案 B A C C B
三、填空题:(共32分)
21.(5分)增大、减弱、减弱、增大、升高(各1分)
22.(2分)物质的量、6.02×1023mol-1(各1分)
23.(5分)(1)深、弱、溶 (2)深、弱 (每空1空)
24.(9分)(1)A:Na2O2 B:NaHCO3 C:O2(各1分)
(2)2NaHCO3Na2CO3+H2O+CO2↑(3分)
HCO3-+H+=H2O+CO2↑(3分)
25.(11分)A:CuBr2 B:NaOH C:BaBr2 D:Na2CO3 E:NaHCO3〔或Ba(HCO3)2〕
C+Cl2:2Br-+Cl2=Br2+2Cl-
E+C+B:HCO3-+Ba2++OH-=BaCO3↓+H2O
四、实验题:(共18分)
26.(6分) (1)偏低 (2)无影响 (3)无影响 (4)无法判断
(5)偏高 (6)偏高
27.(12分)(1)用酒精灯微热烧瓶,看E中是否有气泡产生。
(2)饱和食盐水(或水),洗去HCl气体
浓硫酸 干燥氯气 强碱溶液 吸收多余氯气,防止污染(每空1分)
(3)2NaCl+3H2SO4(浓)+MnO22NaHSO4+Cl2↑+MnSO4+H2O(3分)
(合理答案均给分)
Cl2+2NaOH=NaClO+NaCl+H2O (合理答案均给分)
五、计算题:(5分)
28.解:浓盐酸的物质的量浓度为
c(HCl)==
=11.9mol/L
则V(浓盐酸)=
=
=0.0043L
=44.3mL
答:所用浓盐酸的体积为4.3mL
加稀硫酸
向溶液中通入过量气体D
加水
加热
加足量稀硫酸
A、B混合物
气体
C
无色气体D
B
浓硫酸
足量食盐、
二氧化锰
铜粉
PAGE
1
同课章节目录
