2005年全国中考化学卷专题整理--空气[上学期]
文档属性
| 名称 | 2005年全国中考化学卷专题整理--空气[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 447.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-09-19 10:29:00 | ||
图片预览

文档简介
2005年全国中考化学卷专题整理--空气
纵观2005年全国各地中考化学卷,有关以空气为背景而编制的试题多如牛毛,一种空气成分的测定实验题就令你叹为观止!为便于老师们备课或作研究时省点时间,我将化了很大精力从近100份中考卷中好中选优整理而成的《空气》专题奉献给大家。本专题春风拂面,爽极!
一、空气的组成与测定
1.(辽宁25)生活就是一本化学教科书,只要你留心观察,用心思考,便可发现化学无处不在,探究其乐无穷。你留意过下列问题吗 请解释。
(1)空气是一种混合物,请用分子的观点解释纯净物和混合物的区别。
(2)用石灰浆粉刷墙壁,干后能形成坚硬的墙面。这是为什么
答案:(1)由分子构成的物质.纯净物由同种分子构成.混合物由不同种分子构成。(2)氢氧化钙与空气中的二氧化碳发生反应.生成坚硬的碳酸钙。Ca(OH)2+CO2 ==CaCO3 ↓+H2O (不写方程式不扣分)
2.(上海35)以拉瓦锡为代表的早期科学家对空气研究后确认,空气中约有1/5的气体比较活泼,能与某些金属发生反应,这种气体可能是( )。
A、氮气 B、氧气 C、水蒸气 D、稀有气体
3.(泉州5)做空气中氧气含量测定的实验装置如右图。下列有关说法正确的是
A.选用红磷是因为反应可以耗尽O2,生成固态的P2O5
B.燃烧匙中的红磷可以换成硫或木炭
C.燃烧匙中的红磷越多,水位上升越高
D.本实验可以证明空气含有N2、O2、CO2和稀有气体
4.(湖北荆州18)为粗略测量空气中O2与N2的体积比,某学生设计了如右图所示的实验装置进行实验。实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞。由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟。试回答以下问题:
(1)试配平下列化学方程式:
P + O2 —— P2O5
(2)待试管冷却后打开弹簧夹,此时可观察到的现象为 ,据此可证实空气中O2与N2的体积比大约为 。
(3)如果装置气密性不好,则测出的O2与N2的体积比将 (填“偏大”、“偏小”、或“不变”)。
答案:(1)4P+5O2===2P2O5(“-”未改成“=”酌情扣分)。(2)烧杯中的水通过导管进入大试管中,约占试管容积的1/5(其它合理答案参照给分 1:4。(3)偏小。
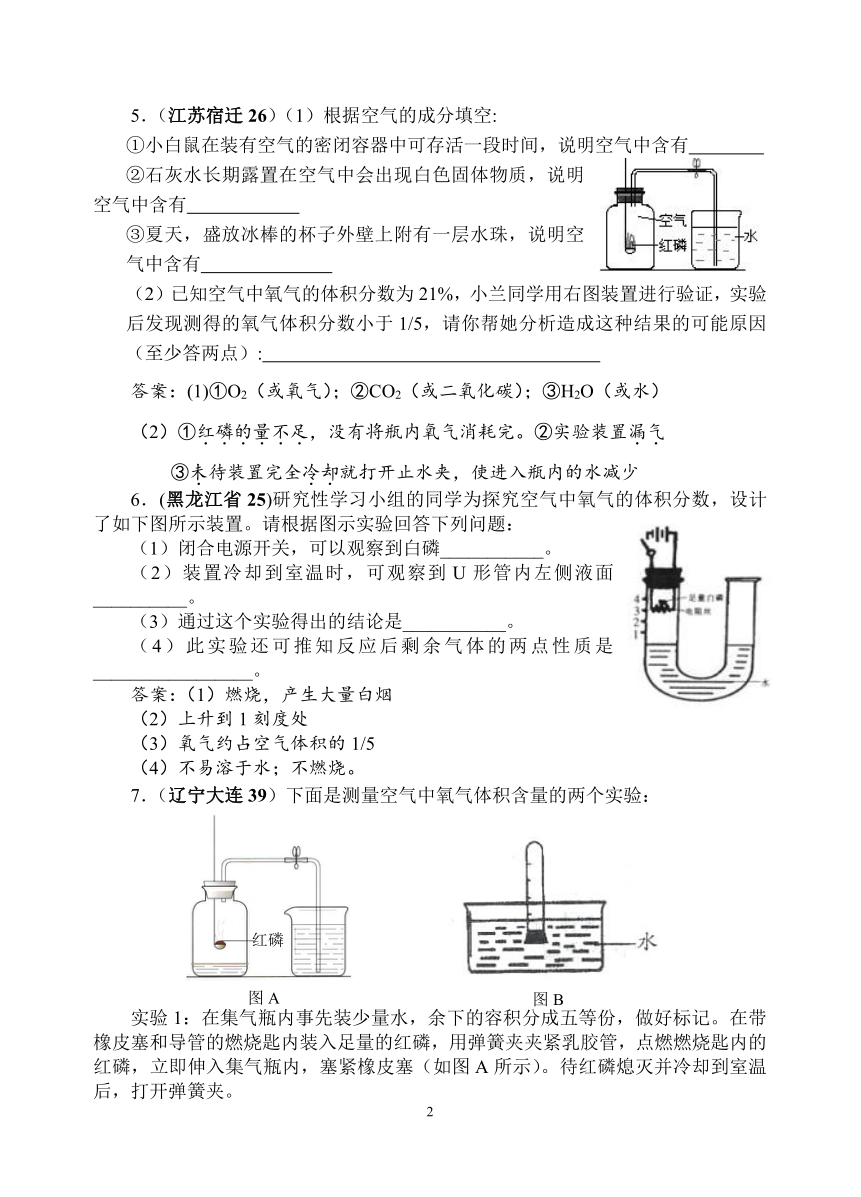
5.(江苏宿迁26)(1)根据空气的成分填空:
①小白鼠在装有空气的密闭容器中可存活一段时间,说明空气中含有
②石灰水长期露置在空气中会出现白色固体物质,说明空气中含有
③夏天,盛放冰棒的杯子外壁上附有一层水珠,说明空气中含有
(2)已知空气中氧气的体积分数为21%,小兰同学用右图装置进行验证,实验后发现测得的氧气体积分数小于1/5,请你帮她分析造成这种结果的可能原因(至少答两点):
答案:(1)①O2(或氧气);②CO2(或二氧化碳);③H2O(或水)
(2)①红磷的量不足,没有将瓶内氧气消耗完。②实验装置漏气
③未待装置完全冷却就打开止水夹,使进入瓶内的水减少
6.(黑龙江省25)研究性学习小组的同学为探究空气中氧气的体积分数,设计了如下图所示装置。请根据图示实验回答下列问题:
(1)闭合电源开关,可以观察到白磷___________。
(2)装置冷却到室温时,可观察到U形管内左侧液面__________。
(3)通过这个实验得出的结论是___________。
(4)此实验还可推知反应后剩余气体的两点性质是_________________。
答案:(1)燃烧,产生大量白烟
(2)上升到1刻度处
(3)氧气约占空气体积的1/5
(4)不易溶于水;不燃烧。
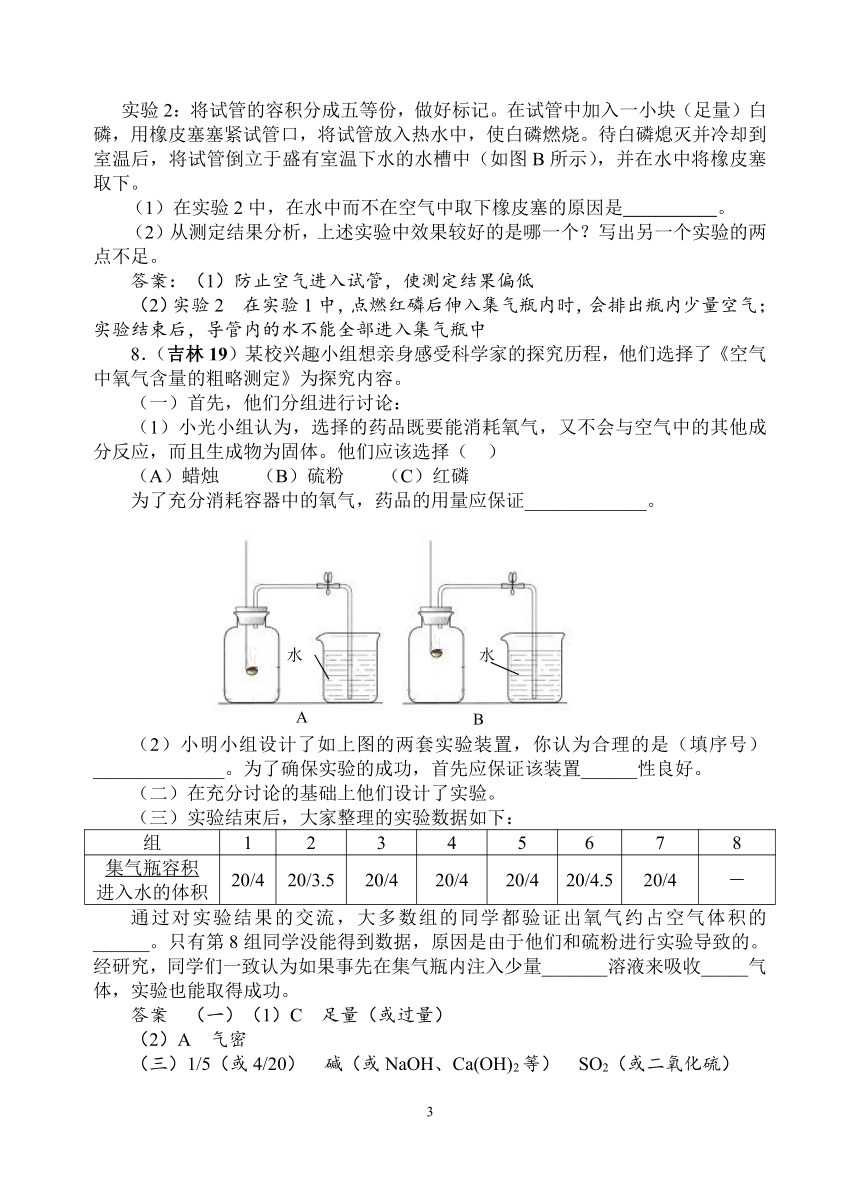
7.(辽宁大连39)下面是测量空气中氧气体积含量的两个实验:
实验1:在集气瓶内事先装少量水,余下的容积分成五等份,做好标记。在带橡皮塞和导管的燃烧匙内装入足量的红磷,用弹簧夹夹紧乳胶管,点燃燃烧匙内的红磷,立即伸入集气瓶内,塞紧橡皮塞(如图A所示)。待红磷熄灭并冷却到室温后,打开弹簧夹。
实验2:将试管的容积分成五等份,做好标记。在试管中加入一小块(足量)白磷,用橡皮塞塞紧试管口,将试管放入热水中,使白磷燃烧。待白磷熄灭并冷却到室温后,将试管倒立于盛有室温下水的水槽中(如图B所示),并在水中将橡皮塞取下。
(1)在实验2中,在水中而不在空气中取下橡皮塞的原因是 。
(2)从测定结果分析,上述实验中效果较好的是哪一个?写出另一个实验的两点不足。
答案:(1)防止空气进入试管,使测定结果偏低
(2)实验2 在实验1中,点燃红磷后伸入集气瓶内时,会排出瓶内少量空气;实验结束后,导管内的水不能全部进入集气瓶中
8.(吉林19)某校兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容。
(一)首先,他们分组进行讨论:
(1)小光小组认为,选择的药品既要能消耗氧气,又不会与空气中的其他成分反应,而且生成物为固体。他们应该选择( )
(A)蜡烛 (B)硫粉 (C)红磷
为了充分消耗容器中的氧气,药品的用量应保证_____________。
(2)小明小组设计了如上图的两套实验装置,你认为合理的是(填序号)______________。为了确保实验的成功,首先应保证该装置______性良好。
(二)在充分讨论的基础上他们设计了实验。
(三)实验结束后,大家整理的实验数据如下:
组 1 2 3 4 5 6 7 8
集气瓶容积进入水的体积 20/4 20/3.5 20/4 20/4 20/4 20/4.5 20/4 -
通过对实验结果的交流,大多数组的同学都验证出氧气约占空气体积的______。只有第8组同学没能得到数据,原因是由于他们和硫粉进行实验导致的。经研究,同学们一致认为如果事先在集气瓶内注入少量_______溶液来吸收_____气体,实验也能取得成功。
答案 (一)(1)C 足量(或过量)
(2)A 气密
(三)1/5(或4/20) 碱(或NaOH、Ca(OH)2等) SO2(或二氧化硫)
二、大气的形成与污染
9.(山东威海10)人类为探索物质的组成、性质和变化,经历了漫长的历程。请阅读下列信息:
信息1:数十亿年来,地球上的物质不断地变化。大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
空气的成分 N2、O2、CO2、水蒸气及惰性气体等
原始大气的主要成分 CH4 、NH3 、CO 、CO2等
根据上面提供的信息,运用你学过的有关知识回答下列问题:
(3)原始大气是指绿色植物出现以前的大气。假设把现代的人或其他的动植物放在原始大气中,你认为他们能否生存下去? 。原因是 。
(4)绿色植物出现以后,原始大气中的CO2逐渐减少。同时O2逐渐增加,原因 。
(5)随着原始大气中O2缓慢地增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成现代大气。原始大气中NH3可转化为现代大气中的 。试写出氧气分别与CO、CH4反应的化学方程式。
; 。
答案 (3)不能 在原始大气中没有氧气,反而有有毒的CO、NH3等物质
(4)绿色植物光合作用时,吸收CO2,放出O2
(5)N2 H2O 2CO+O2 2CO2 CH4+ O2 CO2+2H2O
10.(安徽课改12)人类发明并使用氟里昂(主要用作致冷剂)若干年后,科学家发现氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)请写出臭氧的化学式_______;
(2)上述反应属于化合反应的是(填序号)__________;
(3)经过上述①②③的反应过程后,反应物氯原子的个数是否发生变化?______(答:是或否)。
(4)诺贝尔奖金获得者莫里纳博士指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据循环示意图论证他的观点。_____________________________。
(5)在科学家的建议下,许多国家签署了停止使用和消费氟里昂的协议,使得大气中氟里昂的含量得到了控制。请你根据本题提供的信息就怎样有效保护我们的环境谈一点建议或认识:_______________________________________________。
答案 (1)O3
(2) ②
(3)否
(4)反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响
(5)本题是开放性试题,考查的是学生环境保护、合理使用化学物质和主动参与社会决策的意识。答案是丰富多彩的,只要合理均给分。以下答案供参考:治理污染要从禁止污染源开始;人类要有地球村观点,治理污染要全球共同行动;合理使用化学物质;不使用含氟里昂的致冷设备。科学在防治污染中起决定性的作用;污染治理的时间较长,代价较大;化学是一面双刃剑,既能造福人类,又能给人类带来灾难
11.(山东安丘32)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:
浓度限值(mg/m3)
一级标准 二级标准 三级标准
0.15 0.50 0.70
为测定某地空气中二氧化硫的含量,某中学环保小组按下图所示的实验装置进行如下实验:向试管中加入一定量的含碘(I2)1.27mg的碘溶液,再加入2—3滴淀粉溶液(淀粉遇I2变蓝色),通过抽气装置抽气,使空气由导气管进入试管与碘溶液充分接触,当溶液由蓝色变为无色时,恰好完全反应.反应的化学方程式是:SO2+I2+2H2O=H2SO4+2HI。实验过程中进入试管内的空气的总体积为1000L。请通过计算判断出此空气中二氧化硫的浓度级别.
答案 解:设参加反应的二氧化硫的质量为x
SO2+I2+2H2O=H2SO4+2HI
64 254
x 1.27mg
64∶254=x∶1.27mg
x==0.32mg
空气中二氧化硫的浓度为
由于
所以空气中二氧化硫的浓度级别是二级
点燃
水
水
B
A
图B
图A
红磷
PAGE
1
纵观2005年全国各地中考化学卷,有关以空气为背景而编制的试题多如牛毛,一种空气成分的测定实验题就令你叹为观止!为便于老师们备课或作研究时省点时间,我将化了很大精力从近100份中考卷中好中选优整理而成的《空气》专题奉献给大家。本专题春风拂面,爽极!
一、空气的组成与测定
1.(辽宁25)生活就是一本化学教科书,只要你留心观察,用心思考,便可发现化学无处不在,探究其乐无穷。你留意过下列问题吗 请解释。
(1)空气是一种混合物,请用分子的观点解释纯净物和混合物的区别。
(2)用石灰浆粉刷墙壁,干后能形成坚硬的墙面。这是为什么
答案:(1)由分子构成的物质.纯净物由同种分子构成.混合物由不同种分子构成。(2)氢氧化钙与空气中的二氧化碳发生反应.生成坚硬的碳酸钙。Ca(OH)2+CO2 ==CaCO3 ↓+H2O (不写方程式不扣分)
2.(上海35)以拉瓦锡为代表的早期科学家对空气研究后确认,空气中约有1/5的气体比较活泼,能与某些金属发生反应,这种气体可能是( )。
A、氮气 B、氧气 C、水蒸气 D、稀有气体
3.(泉州5)做空气中氧气含量测定的实验装置如右图。下列有关说法正确的是
A.选用红磷是因为反应可以耗尽O2,生成固态的P2O5
B.燃烧匙中的红磷可以换成硫或木炭
C.燃烧匙中的红磷越多,水位上升越高
D.本实验可以证明空气含有N2、O2、CO2和稀有气体
4.(湖北荆州18)为粗略测量空气中O2与N2的体积比,某学生设计了如右图所示的实验装置进行实验。实验时,先关闭弹簧夹a,将螺旋状的铜丝在酒精灯的灼烧后迅速插入大试管,接触试管底部的过量的白磷,然后立即塞紧橡皮塞。由于白磷的着火点比红磷低得多,因此反应很容易发生,可观察到大试管中产生大量的白烟。试回答以下问题:
(1)试配平下列化学方程式:
P + O2 —— P2O5
(2)待试管冷却后打开弹簧夹,此时可观察到的现象为 ,据此可证实空气中O2与N2的体积比大约为 。
(3)如果装置气密性不好,则测出的O2与N2的体积比将 (填“偏大”、“偏小”、或“不变”)。
答案:(1)4P+5O2===2P2O5(“-”未改成“=”酌情扣分)。(2)烧杯中的水通过导管进入大试管中,约占试管容积的1/5(其它合理答案参照给分 1:4。(3)偏小。
5.(江苏宿迁26)(1)根据空气的成分填空:
①小白鼠在装有空气的密闭容器中可存活一段时间,说明空气中含有
②石灰水长期露置在空气中会出现白色固体物质,说明空气中含有
③夏天,盛放冰棒的杯子外壁上附有一层水珠,说明空气中含有
(2)已知空气中氧气的体积分数为21%,小兰同学用右图装置进行验证,实验后发现测得的氧气体积分数小于1/5,请你帮她分析造成这种结果的可能原因(至少答两点):
答案:(1)①O2(或氧气);②CO2(或二氧化碳);③H2O(或水)
(2)①红磷的量不足,没有将瓶内氧气消耗完。②实验装置漏气
③未待装置完全冷却就打开止水夹,使进入瓶内的水减少
6.(黑龙江省25)研究性学习小组的同学为探究空气中氧气的体积分数,设计了如下图所示装置。请根据图示实验回答下列问题:
(1)闭合电源开关,可以观察到白磷___________。
(2)装置冷却到室温时,可观察到U形管内左侧液面__________。
(3)通过这个实验得出的结论是___________。
(4)此实验还可推知反应后剩余气体的两点性质是_________________。
答案:(1)燃烧,产生大量白烟
(2)上升到1刻度处
(3)氧气约占空气体积的1/5
(4)不易溶于水;不燃烧。
7.(辽宁大连39)下面是测量空气中氧气体积含量的两个实验:
实验1:在集气瓶内事先装少量水,余下的容积分成五等份,做好标记。在带橡皮塞和导管的燃烧匙内装入足量的红磷,用弹簧夹夹紧乳胶管,点燃燃烧匙内的红磷,立即伸入集气瓶内,塞紧橡皮塞(如图A所示)。待红磷熄灭并冷却到室温后,打开弹簧夹。
实验2:将试管的容积分成五等份,做好标记。在试管中加入一小块(足量)白磷,用橡皮塞塞紧试管口,将试管放入热水中,使白磷燃烧。待白磷熄灭并冷却到室温后,将试管倒立于盛有室温下水的水槽中(如图B所示),并在水中将橡皮塞取下。
(1)在实验2中,在水中而不在空气中取下橡皮塞的原因是 。
(2)从测定结果分析,上述实验中效果较好的是哪一个?写出另一个实验的两点不足。
答案:(1)防止空气进入试管,使测定结果偏低
(2)实验2 在实验1中,点燃红磷后伸入集气瓶内时,会排出瓶内少量空气;实验结束后,导管内的水不能全部进入集气瓶中
8.(吉林19)某校兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容。
(一)首先,他们分组进行讨论:
(1)小光小组认为,选择的药品既要能消耗氧气,又不会与空气中的其他成分反应,而且生成物为固体。他们应该选择( )
(A)蜡烛 (B)硫粉 (C)红磷
为了充分消耗容器中的氧气,药品的用量应保证_____________。
(2)小明小组设计了如上图的两套实验装置,你认为合理的是(填序号)______________。为了确保实验的成功,首先应保证该装置______性良好。
(二)在充分讨论的基础上他们设计了实验。
(三)实验结束后,大家整理的实验数据如下:
组 1 2 3 4 5 6 7 8
集气瓶容积进入水的体积 20/4 20/3.5 20/4 20/4 20/4 20/4.5 20/4 -
通过对实验结果的交流,大多数组的同学都验证出氧气约占空气体积的______。只有第8组同学没能得到数据,原因是由于他们和硫粉进行实验导致的。经研究,同学们一致认为如果事先在集气瓶内注入少量_______溶液来吸收_____气体,实验也能取得成功。
答案 (一)(1)C 足量(或过量)
(2)A 气密
(三)1/5(或4/20) 碱(或NaOH、Ca(OH)2等) SO2(或二氧化硫)
二、大气的形成与污染
9.(山东威海10)人类为探索物质的组成、性质和变化,经历了漫长的历程。请阅读下列信息:
信息1:数十亿年来,地球上的物质不断地变化。大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
空气的成分 N2、O2、CO2、水蒸气及惰性气体等
原始大气的主要成分 CH4 、NH3 、CO 、CO2等
根据上面提供的信息,运用你学过的有关知识回答下列问题:
(3)原始大气是指绿色植物出现以前的大气。假设把现代的人或其他的动植物放在原始大气中,你认为他们能否生存下去? 。原因是 。
(4)绿色植物出现以后,原始大气中的CO2逐渐减少。同时O2逐渐增加,原因 。
(5)随着原始大气中O2缓慢地增加,CH4、NH3、CO等气体逐渐被氧气氧化而缓慢地减少,使大气的成分逐渐演化成现代大气。原始大气中NH3可转化为现代大气中的 。试写出氧气分别与CO、CH4反应的化学方程式。
; 。
答案 (3)不能 在原始大气中没有氧气,反而有有毒的CO、NH3等物质
(4)绿色植物光合作用时,吸收CO2,放出O2
(5)N2 H2O 2CO+O2 2CO2 CH4+ O2 CO2+2H2O
10.(安徽课改12)人类发明并使用氟里昂(主要用作致冷剂)若干年后,科学家发现氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)请写出臭氧的化学式_______;
(2)上述反应属于化合反应的是(填序号)__________;
(3)经过上述①②③的反应过程后,反应物氯原子的个数是否发生变化?______(答:是或否)。
(4)诺贝尔奖金获得者莫里纳博士指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据循环示意图论证他的观点。_____________________________。
(5)在科学家的建议下,许多国家签署了停止使用和消费氟里昂的协议,使得大气中氟里昂的含量得到了控制。请你根据本题提供的信息就怎样有效保护我们的环境谈一点建议或认识:_______________________________________________。
答案 (1)O3
(2) ②
(3)否
(4)反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响
(5)本题是开放性试题,考查的是学生环境保护、合理使用化学物质和主动参与社会决策的意识。答案是丰富多彩的,只要合理均给分。以下答案供参考:治理污染要从禁止污染源开始;人类要有地球村观点,治理污染要全球共同行动;合理使用化学物质;不使用含氟里昂的致冷设备。科学在防治污染中起决定性的作用;污染治理的时间较长,代价较大;化学是一面双刃剑,既能造福人类,又能给人类带来灾难
11.(山东安丘32)二氧化硫是大气污染物之一.我国的环境空气质量标准中对空气中二氧化硫的最高浓度(单位体积的空气中所含二氧化硫的质量)限值如下表所示:
浓度限值(mg/m3)
一级标准 二级标准 三级标准
0.15 0.50 0.70
为测定某地空气中二氧化硫的含量,某中学环保小组按下图所示的实验装置进行如下实验:向试管中加入一定量的含碘(I2)1.27mg的碘溶液,再加入2—3滴淀粉溶液(淀粉遇I2变蓝色),通过抽气装置抽气,使空气由导气管进入试管与碘溶液充分接触,当溶液由蓝色变为无色时,恰好完全反应.反应的化学方程式是:SO2+I2+2H2O=H2SO4+2HI。实验过程中进入试管内的空气的总体积为1000L。请通过计算判断出此空气中二氧化硫的浓度级别.
答案 解:设参加反应的二氧化硫的质量为x
SO2+I2+2H2O=H2SO4+2HI
64 254
x 1.27mg
64∶254=x∶1.27mg
x==0.32mg
空气中二氧化硫的浓度为
由于
所以空气中二氧化硫的浓度级别是二级
点燃
水
水
B
A
图B
图A
红磷
PAGE
1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
