第二章《分子和原子》检测试卷[上学期]
文档属性
| 名称 | 第二章《分子和原子》检测试卷[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 176.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-01-13 10:15:00 | ||
图片预览


文档简介
第二章《分子和原子》检测试卷
一、选择题(每小题只有1个选项符合题意,每小题1分,共10分)
1、右图实验中,可以观察到的现象是 ( )
A.没有变化
B.上层盐水,下层红墨水
C.盐水和红墨水完全混合
D.上、下层盐水,中间红墨水
2、下列关于分子和原子的说法中,不正确的是 ( )
A.分子、原子都在不停地运动 B.分子、原子都是构成物质的微粒
C.原子是不能再分的最小微粒 D.分子是保持物质化学性质的最小微粒
3、1991年,我国化学家张青莲与另一位科学家合作,测定了(In)元素的相对原子质量新值。元素的核电荷数为49,相对原子质量为115。原子的核外电子数为( )
A.115 B.49 C.66 D.164
4、若用“ ”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的粒子可表示为 ( )
A. B. C. D.
5、下列关于空气的说法中正确的是 ( )
A.空气是单质 B.空气是混合物 C.氧气是中含量最多的气体 D.空气是一种化合物
6、下列家庭常用的调味品中,可视为纯净物的是 ( )
A.食盐 B.食醋 C.白酒 D.白糖
7、新华社5月23日报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标后,我国又将启动一项涉及千家万户营养健康问题的“补铁工程”。卫生部已批准以酱油为食物载体,逐步开展补铁工程。这里的碘、铁指的是()
A.分子 B.原子 C.元素 D.单质
8、意大利科学家最近合成一种新型的氧分子,其化学式为O4。说法正确的是( )
A.一个O4分子由2个O2分子构成 B. O4是一种单质
C.O4是由O2组成的混合物 D.O4是一种化合物
9、下列说法中,正确的是 ( )
A.原子可以构成分子,也可以直接构成物质
B.有同种元素组成的物质称为纯净物
C.含有氧元素的化合物称为氧化物
D.原子和分子在化学反应里都能生成新的原子和分子
10、元素在自然界中分布并不均匀,如非洲多金矿,澳大利亚多铁矿,中国富钨矿等,从整个地壳中元素含量的多少分析,最多的是 ( )
A.铝 B.硅 C.氧 D.铁
11、下图是表示气体分子的示意图,图中“ ”和“ ”分别表示两种不同质子数的原子,其中表示化合物的是 ( )
A. B. C. D.
12、2001年11月,美军向躲藏在山洞的恐怖分子使用了一种名为BLU-82的燃料炸弹,这种炸弹爆炸时能耗尽山洞中的氧气,使洞中的生物窒息死亡。该炸弹的主装药之一是环氧乙烷(化学式为C2H4O)。关于环氧乙烷的下列说法正确的是 ( )
A.它是化合物 B.它是含有3种元素的混合物
C.它的相对分子质量为44 D.它在空气中充分燃烧只生成CO2
13、自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式。火炬的可燃物是丁烷(化学式为C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见。下列关于丁烷的叙述不正确的是 ( )
A.丁烷由碳、氢两种元素组成 B.丁烷分子由碳原子和氢原子构成
C.丁烷中碳、氢元素的质量比是4:10 D。丁烷由4个碳原子和10氢原子构成
14、正电子、负电子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反,科学家设想在宇宙中可能产生存在完全由反粒子构成的物质——反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观,请你推测,反氢原子的结构可能是 ( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个带正电荷的质子与一个带正电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
15、某学生用高锰酸钾制取氧气,收集到他所需要的氧气后停止加热,高锰酸钾未完全分解。剩余的固体混合物中锰元素与氧元素的质量比不可能( )
A.55:54 B.55:58 C.55:62 D.55:64
二、填空题(共50分)
16、(14分)(1)下列粒子中带正电荷的是 。
①电子 ②质子 ③中子 ④原子核 ⑤原子 ⑥分子
(2)空气、食盐、白酒是三种不同的物质,但它们同属于 这一类物质,从宏观角度说明的理由是 。
(3)下列每组物质之间存在某种联系,请你认真分析,寻找规律,并再举出相似的一个例子。
A.氮气、硫磺、水银、 。 B.氧化镁、水、二氧化碳、 。
C.氧气、氯酸钾、四氧化三铁、 。
17、(6分)20世纪科学技术的发展,为人们提供了可以观察和操纵单个原子和分子的可能性,从而实现了直接用原子制造分子,葡萄糖是人体需要的重要的营养物质之一,其化学式为C6H12O6,若采用上述方法制造葡萄糖,请你指出所需的原子名称: 。
18、(2分)1993年中美两国科学家共同合成了世界上最大的碳分子,这种分子由1134个碳原子和1146个氢原子构成。请写出此种物质的化学式 。
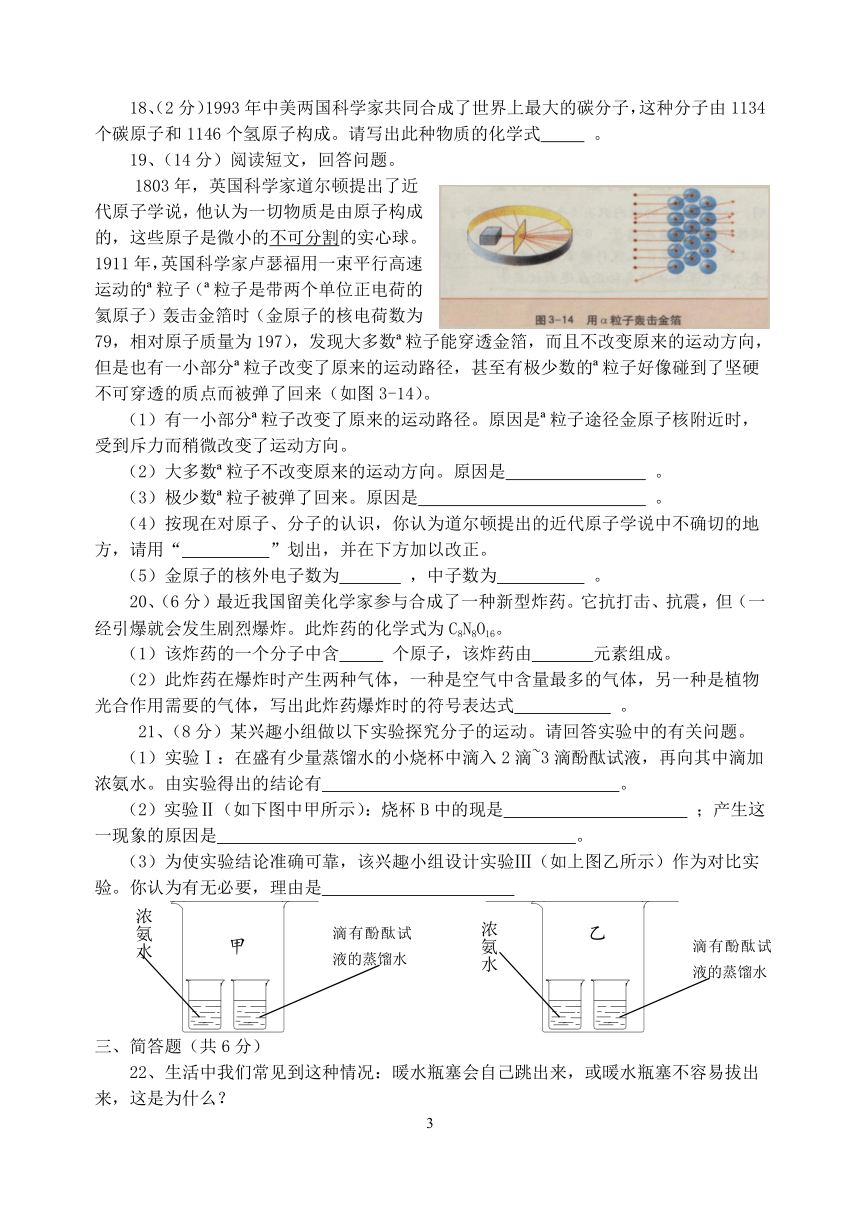
19、(14分)阅读短文,回答问题。
1803年,英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的 粒子( 粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数 粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分 粒子改变了原来的运动路径,甚至有极少数的 粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图3-14)。
(1)有一小部分 粒子改变了原来的运动路径。原因是 粒子途径金原子核附近时,受到斥力而稍微改变了运动方向。
(2)大多数 粒子不改变原来的运动方向。原因是 。
(3)极少数 粒子被弹了回来。原因是 。
(4)按现在对原子、分子的认识,你认为道尔顿提出的近代原子学说中不确切的地方,请用“ ”划出,并在下方加以改正。
(5)金原子的核外电子数为 ,中子数为 。
20、(6分)最近我国留美化学家参与合成了一种新型炸药。它抗打击、抗震,但(一经引爆就会发生剧烈爆炸。此炸药的化学式为C8N8O16。
(1)该炸药的一个分子中含 个原子,该炸药由 元素组成。
(2)此炸药在爆炸时产生两种气体,一种是空气中含量最多的气体,另一种是植物光合作用需要的气体,写出此炸药爆炸时的符号表达式 。
21、(8分)某兴趣小组做以下实验探究分子的运动。请回答实验中的有关问题。
(1)实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入2滴~3滴酚酞试液,再向其中滴加浓氨水。由实验得出的结论有 。
(2)实验Ⅱ(如下图中甲所示):烧杯B中的现是 ;产生这一现象的原因是 。
(3)为使实验结论准确可靠,该兴趣小组设计实验Ⅲ(如上图乙所示)作为对比实验。你认为有无必要,理由是
三、简答题(共6分)
22、生活中我们常见到这种情况:暖水瓶塞会自己跳出来,或暖水瓶塞不容易拔出来,这是为什么?
23、研究发现,苍蝇体内能产生抗细菌感染的过氧化氢(H2O2)。试比较过氧化氢与水的元素组成和分子构成,并说明它们化学性质不同的原因。
四、计算题(共24分)
24、(6分)下表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明。请根据此表,结合初中学过的化学知识,回答下列问题:
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40mg/Kg
储藏方法 密封避光、防潮
食用方法 烹调时待食品熟后加入碘盐
(1)碘酸钾属于哪类物质? (填:“纯净物”、“混合物”、“单质”、“氧化物”)。
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时 。
(3)我国规定,食盐含碘量为每千克食盐含碘0.035克,相当于每千克食盐含碘酸钾 克。
25、(4分)“9.11事件”发生不久,在美国又出现了炭疽热病,此病是一种由炭疽热杆菌引起的急性传染病,致死率高达25%至60%。治疗炭疽热病的常用抗生素为环丙沙星,其化学式为C17H18FN3O3,它的相对分子质量是 ,其中氧元素的质量分数是 %(保留一位小数)
26、(6分)淀粉等食用糖类在人体中能转化为葡萄糖(C6H12O6)而被吸收,正常人的血液里约含0.1%的葡萄糖。
(1)葡萄糖的相对分子质量为 。
(2)若用Cn(H2O)m的形式来表示葡萄糖,则n= , m= 。
27、(4分)2001年诺贝尔化学奖授予美国化学家诺尔斯博士与日本化学家野依良治教授和美国化学家沙普利斯教授,以表彰他们催化不对称合成的重大成就。环氧化(R)——丙稀醇(化学式为:C3H6O2)是沙普利斯应用不对称合成技术合成的一种重要物质。该物质用于生产一种治疗心脏病的药物。计算(计算结果保留一位小数):
(1)C3H6O2中碳、氢、氧三种元素的质量比。
(2)该物质中氧元素的质量分数。
28、(4分)某化肥厂生产一批尿素产品,经测定,其含氮元素的质量分数为42%(杂质不含氮)。按规定,产品中含尿素[CO(NH2)2]的质量分数在95%以上为一级品,试根据计算判断该厂所生产的产品是否属于一级品?
第二章《分子和原子》检测试卷参考答案
一、 选择题(1~10小题,每小题1分;11~15小题,每小题2分,共20分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C C B D B D C B A A A AC CD B D
二、填充题(共50分)
16、(1) ②、④ (2)混合物 由两种或两种以上的物质组成 (3)红磷、氢气、水银等; 二氧化硫、四氧化三铁等; 高锰酸钾、二氧化锰等
17、碳原子、氧原子、氢原子 18、C1134H1146 19、(2) 粒子通过原子内、原子间空隙 (3) 粒子撞击了金原子核而弹回(或 粒子撞击了带正电核、质量大、体积很小的金原子核而被弹回
(4)一切 不可分割 实心球 (5)79、 118
一些 可分割为 电子在原子核外的空间内做高速运动
20、(1)32 3 (2)C8N8O16→N2+CO2
21、(1)酚酞试液遇蒸馏水不变色;酚酞试液遇浓氨水变红色 (2)酚酞试液变红 氨分子从烧杯A运动到烧杯B中,溶于水使酚酞试液变红 (3)实验Ⅰ、实验Ⅱ已做过对比实验,故没有必要再做实验Ⅲ[评分提示](3)主要考查对于对比实验的理解及实验设计能力。只要表述正确、清楚,即可给分。
三、简答题(共6分)
22、这两种现象都发生在暖水瓶没有灌满水的情况下。当你打开暖水瓶时,就会有冷空气进入暖水瓶,冷空气被暖水瓶中的热水加热,气体分子间的距离增大,暖水瓶内压力增大,当压力足够大时,就会把瓶塞冲掉。若暖水瓶放置较长时间以后,暖水瓶中水温下降,其中的热空气也跟着冷却,气体分子间的距离缩小,暖水瓶内压力下降,低于外界大气压,于是外界的大气压就把瓶塞紧紧地压住,很难拔出。
23、过氧化氢与水都含有氢元素和氧元素,但由于每个过氧化氢分子是由两个氢原子和两个氧原子构成的,而每个水分子是两个氢原子和一个氧原子构成的,分子结构不同,所以它们的化学性质不同。
四、计算题(共24分)
24、(1)纯净物 (2)易分解 (3)0。06 25、331 14。5% 26、180
6 6 27、(1)C:H:O=18:3:16 (2)43。2%
28、解:设此化肥厂生产的化肥中含尿素为。
依题意列式:
CO(NH2)2 ~2N/CO(NH2)2
100% 100%
42%
100%: =100%: 42%
=90%
因90%<95%,所以该厂生产化肥不属于一级品。
答:(略)。
初中化学 第二章《分子 原子》检测命题双向细目表
(孙宁军)
内 容 考 试 要 求 题 号 题 型 分 值 联系实际
常 识 了 解 理 解 掌 握
一、化学基本概念和原理
元素、元素符号 √
单质和化合物 √
混合物和纯净物 √
分子、原子 √
化学式 √
相对原子质量和相对分子质量 √
原子的结构——原子核(质子、中子)和核外电子 √
二、化学计算——有关化学式的计算
1、计算物质的相对分子质量 √
2、计算化合物中各元素的质量比
3、计算化合物中各元素的质量分数
考查目标:
1、 知道分子、原子都是构成物质的微粒,原子是由原子核和核外电子构成;
2、 能通过某些物质的组成和构成的分析,正确理解分子、原子、元素等概念的区别
和联系;
3、 能用分子、原子的观点解释物质的变化和某些常见的现象;
4、 能从组成上识别氧化物,区分混合物和纯净物、单质和化合物;具有对物质进行简
单分类的能力
5、 记住常见元素符号的写法、意义;会书写和读出一些简单化学式,以及其正误的判
断;并能正确描述物质的组成和构成;
6、 能根据化学式计算物质的相对分子质量和化合物中各元素的质量比以及元素的质量
分数。
一昼夜
净置
红墨水
盐水
?
乙
甲
滴有酚酞试液的蒸馏水
滴有酚酞试液的蒸馏水
浓氨水
浓氨水
1
1
一、选择题(每小题只有1个选项符合题意,每小题1分,共10分)
1、右图实验中,可以观察到的现象是 ( )
A.没有变化
B.上层盐水,下层红墨水
C.盐水和红墨水完全混合
D.上、下层盐水,中间红墨水
2、下列关于分子和原子的说法中,不正确的是 ( )
A.分子、原子都在不停地运动 B.分子、原子都是构成物质的微粒
C.原子是不能再分的最小微粒 D.分子是保持物质化学性质的最小微粒
3、1991年,我国化学家张青莲与另一位科学家合作,测定了(In)元素的相对原子质量新值。元素的核电荷数为49,相对原子质量为115。原子的核外电子数为( )
A.115 B.49 C.66 D.164
4、若用“ ”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的粒子可表示为 ( )
A. B. C. D.
5、下列关于空气的说法中正确的是 ( )
A.空气是单质 B.空气是混合物 C.氧气是中含量最多的气体 D.空气是一种化合物
6、下列家庭常用的调味品中,可视为纯净物的是 ( )
A.食盐 B.食醋 C.白酒 D.白糖
7、新华社5月23日报道,继通过食盐补碘在全国范围内基本实现消除碘缺乏病目标后,我国又将启动一项涉及千家万户营养健康问题的“补铁工程”。卫生部已批准以酱油为食物载体,逐步开展补铁工程。这里的碘、铁指的是()
A.分子 B.原子 C.元素 D.单质
8、意大利科学家最近合成一种新型的氧分子,其化学式为O4。说法正确的是( )
A.一个O4分子由2个O2分子构成 B. O4是一种单质
C.O4是由O2组成的混合物 D.O4是一种化合物
9、下列说法中,正确的是 ( )
A.原子可以构成分子,也可以直接构成物质
B.有同种元素组成的物质称为纯净物
C.含有氧元素的化合物称为氧化物
D.原子和分子在化学反应里都能生成新的原子和分子
10、元素在自然界中分布并不均匀,如非洲多金矿,澳大利亚多铁矿,中国富钨矿等,从整个地壳中元素含量的多少分析,最多的是 ( )
A.铝 B.硅 C.氧 D.铁
11、下图是表示气体分子的示意图,图中“ ”和“ ”分别表示两种不同质子数的原子,其中表示化合物的是 ( )
A. B. C. D.
12、2001年11月,美军向躲藏在山洞的恐怖分子使用了一种名为BLU-82的燃料炸弹,这种炸弹爆炸时能耗尽山洞中的氧气,使洞中的生物窒息死亡。该炸弹的主装药之一是环氧乙烷(化学式为C2H4O)。关于环氧乙烷的下列说法正确的是 ( )
A.它是化合物 B.它是含有3种元素的混合物
C.它的相对分子质量为44 D.它在空气中充分燃烧只生成CO2
13、自第十一届奥运会以来,开幕式都要举行隆重的火炬接力仪式。火炬的可燃物是丁烷(化学式为C4H10),它燃烧时,火苗高且亮,即使在白天,二百米以外也能清晰可见。下列关于丁烷的叙述不正确的是 ( )
A.丁烷由碳、氢两种元素组成 B.丁烷分子由碳原子和氢原子构成
C.丁烷中碳、氢元素的质量比是4:10 D。丁烷由4个碳原子和10氢原子构成
14、正电子、负电子等都是反粒子。它们跟通常所说的电子、质子相比较,质量相等但电性相反,科学家设想在宇宙中可能产生存在完全由反粒子构成的物质——反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观,请你推测,反氢原子的结构可能是 ( )
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个带正电荷的质子与一个带正电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
15、某学生用高锰酸钾制取氧气,收集到他所需要的氧气后停止加热,高锰酸钾未完全分解。剩余的固体混合物中锰元素与氧元素的质量比不可能( )
A.55:54 B.55:58 C.55:62 D.55:64
二、填空题(共50分)
16、(14分)(1)下列粒子中带正电荷的是 。
①电子 ②质子 ③中子 ④原子核 ⑤原子 ⑥分子
(2)空气、食盐、白酒是三种不同的物质,但它们同属于 这一类物质,从宏观角度说明的理由是 。
(3)下列每组物质之间存在某种联系,请你认真分析,寻找规律,并再举出相似的一个例子。
A.氮气、硫磺、水银、 。 B.氧化镁、水、二氧化碳、 。
C.氧气、氯酸钾、四氧化三铁、 。
17、(6分)20世纪科学技术的发展,为人们提供了可以观察和操纵单个原子和分子的可能性,从而实现了直接用原子制造分子,葡萄糖是人体需要的重要的营养物质之一,其化学式为C6H12O6,若采用上述方法制造葡萄糖,请你指出所需的原子名称: 。
18、(2分)1993年中美两国科学家共同合成了世界上最大的碳分子,这种分子由1134个碳原子和1146个氢原子构成。请写出此种物质的化学式 。
19、(14分)阅读短文,回答问题。
1803年,英国科学家道尔顿提出了近代原子学说,他认为一切物质是由原子构成的,这些原子是微小的不可分割的实心球。1911年,英国科学家卢瑟福用一束平行高速运动的 粒子( 粒子是带两个单位正电荷的氦原子)轰击金箔时(金原子的核电荷数为79,相对原子质量为197),发现大多数 粒子能穿透金箔,而且不改变原来的运动方向,但是也有一小部分 粒子改变了原来的运动路径,甚至有极少数的 粒子好像碰到了坚硬不可穿透的质点而被弹了回来(如图3-14)。
(1)有一小部分 粒子改变了原来的运动路径。原因是 粒子途径金原子核附近时,受到斥力而稍微改变了运动方向。
(2)大多数 粒子不改变原来的运动方向。原因是 。
(3)极少数 粒子被弹了回来。原因是 。
(4)按现在对原子、分子的认识,你认为道尔顿提出的近代原子学说中不确切的地方,请用“ ”划出,并在下方加以改正。
(5)金原子的核外电子数为 ,中子数为 。
20、(6分)最近我国留美化学家参与合成了一种新型炸药。它抗打击、抗震,但(一经引爆就会发生剧烈爆炸。此炸药的化学式为C8N8O16。
(1)该炸药的一个分子中含 个原子,该炸药由 元素组成。
(2)此炸药在爆炸时产生两种气体,一种是空气中含量最多的气体,另一种是植物光合作用需要的气体,写出此炸药爆炸时的符号表达式 。
21、(8分)某兴趣小组做以下实验探究分子的运动。请回答实验中的有关问题。
(1)实验Ⅰ:在盛有少量蒸馏水的小烧杯中滴入2滴~3滴酚酞试液,再向其中滴加浓氨水。由实验得出的结论有 。
(2)实验Ⅱ(如下图中甲所示):烧杯B中的现是 ;产生这一现象的原因是 。
(3)为使实验结论准确可靠,该兴趣小组设计实验Ⅲ(如上图乙所示)作为对比实验。你认为有无必要,理由是
三、简答题(共6分)
22、生活中我们常见到这种情况:暖水瓶塞会自己跳出来,或暖水瓶塞不容易拔出来,这是为什么?
23、研究发现,苍蝇体内能产生抗细菌感染的过氧化氢(H2O2)。试比较过氧化氢与水的元素组成和分子构成,并说明它们化学性质不同的原因。
四、计算题(共24分)
24、(6分)下表是某地市场上销售的一种“加碘盐”包装袋上的部分文字说明。请根据此表,结合初中学过的化学知识,回答下列问题:
配料表 精制海盐、碘酸钾(KIO3)
含碘量 20~40mg/Kg
储藏方法 密封避光、防潮
食用方法 烹调时待食品熟后加入碘盐
(1)碘酸钾属于哪类物质? (填:“纯净物”、“混合物”、“单质”、“氧化物”)。
(2)根据含碘盐的食用方法,可推测碘酸钾的化学性质:碘酸钾在受热时 。
(3)我国规定,食盐含碘量为每千克食盐含碘0.035克,相当于每千克食盐含碘酸钾 克。
25、(4分)“9.11事件”发生不久,在美国又出现了炭疽热病,此病是一种由炭疽热杆菌引起的急性传染病,致死率高达25%至60%。治疗炭疽热病的常用抗生素为环丙沙星,其化学式为C17H18FN3O3,它的相对分子质量是 ,其中氧元素的质量分数是 %(保留一位小数)
26、(6分)淀粉等食用糖类在人体中能转化为葡萄糖(C6H12O6)而被吸收,正常人的血液里约含0.1%的葡萄糖。
(1)葡萄糖的相对分子质量为 。
(2)若用Cn(H2O)m的形式来表示葡萄糖,则n= , m= 。
27、(4分)2001年诺贝尔化学奖授予美国化学家诺尔斯博士与日本化学家野依良治教授和美国化学家沙普利斯教授,以表彰他们催化不对称合成的重大成就。环氧化(R)——丙稀醇(化学式为:C3H6O2)是沙普利斯应用不对称合成技术合成的一种重要物质。该物质用于生产一种治疗心脏病的药物。计算(计算结果保留一位小数):
(1)C3H6O2中碳、氢、氧三种元素的质量比。
(2)该物质中氧元素的质量分数。
28、(4分)某化肥厂生产一批尿素产品,经测定,其含氮元素的质量分数为42%(杂质不含氮)。按规定,产品中含尿素[CO(NH2)2]的质量分数在95%以上为一级品,试根据计算判断该厂所生产的产品是否属于一级品?
第二章《分子和原子》检测试卷参考答案
一、 选择题(1~10小题,每小题1分;11~15小题,每小题2分,共20分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 C C B D B D C B A A A AC CD B D
二、填充题(共50分)
16、(1) ②、④ (2)混合物 由两种或两种以上的物质组成 (3)红磷、氢气、水银等; 二氧化硫、四氧化三铁等; 高锰酸钾、二氧化锰等
17、碳原子、氧原子、氢原子 18、C1134H1146 19、(2) 粒子通过原子内、原子间空隙 (3) 粒子撞击了金原子核而弹回(或 粒子撞击了带正电核、质量大、体积很小的金原子核而被弹回
(4)一切 不可分割 实心球 (5)79、 118
一些 可分割为 电子在原子核外的空间内做高速运动
20、(1)32 3 (2)C8N8O16→N2+CO2
21、(1)酚酞试液遇蒸馏水不变色;酚酞试液遇浓氨水变红色 (2)酚酞试液变红 氨分子从烧杯A运动到烧杯B中,溶于水使酚酞试液变红 (3)实验Ⅰ、实验Ⅱ已做过对比实验,故没有必要再做实验Ⅲ[评分提示](3)主要考查对于对比实验的理解及实验设计能力。只要表述正确、清楚,即可给分。
三、简答题(共6分)
22、这两种现象都发生在暖水瓶没有灌满水的情况下。当你打开暖水瓶时,就会有冷空气进入暖水瓶,冷空气被暖水瓶中的热水加热,气体分子间的距离增大,暖水瓶内压力增大,当压力足够大时,就会把瓶塞冲掉。若暖水瓶放置较长时间以后,暖水瓶中水温下降,其中的热空气也跟着冷却,气体分子间的距离缩小,暖水瓶内压力下降,低于外界大气压,于是外界的大气压就把瓶塞紧紧地压住,很难拔出。
23、过氧化氢与水都含有氢元素和氧元素,但由于每个过氧化氢分子是由两个氢原子和两个氧原子构成的,而每个水分子是两个氢原子和一个氧原子构成的,分子结构不同,所以它们的化学性质不同。
四、计算题(共24分)
24、(1)纯净物 (2)易分解 (3)0。06 25、331 14。5% 26、180
6 6 27、(1)C:H:O=18:3:16 (2)43。2%
28、解:设此化肥厂生产的化肥中含尿素为。
依题意列式:
CO(NH2)2 ~2N/CO(NH2)2
100% 100%
42%
100%: =100%: 42%
=90%
因90%<95%,所以该厂生产化肥不属于一级品。
答:(略)。
初中化学 第二章《分子 原子》检测命题双向细目表
(孙宁军)
内 容 考 试 要 求 题 号 题 型 分 值 联系实际
常 识 了 解 理 解 掌 握
一、化学基本概念和原理
元素、元素符号 √
单质和化合物 √
混合物和纯净物 √
分子、原子 √
化学式 √
相对原子质量和相对分子质量 √
原子的结构——原子核(质子、中子)和核外电子 √
二、化学计算——有关化学式的计算
1、计算物质的相对分子质量 √
2、计算化合物中各元素的质量比
3、计算化合物中各元素的质量分数
考查目标:
1、 知道分子、原子都是构成物质的微粒,原子是由原子核和核外电子构成;
2、 能通过某些物质的组成和构成的分析,正确理解分子、原子、元素等概念的区别
和联系;
3、 能用分子、原子的观点解释物质的变化和某些常见的现象;
4、 能从组成上识别氧化物,区分混合物和纯净物、单质和化合物;具有对物质进行简
单分类的能力
5、 记住常见元素符号的写法、意义;会书写和读出一些简单化学式,以及其正误的判
断;并能正确描述物质的组成和构成;
6、 能根据化学式计算物质的相对分子质量和化合物中各元素的质量比以及元素的质量
分数。
一昼夜
净置
红墨水
盐水
?
乙
甲
滴有酚酞试液的蒸馏水
滴有酚酞试液的蒸馏水
浓氨水
浓氨水
1
1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
