初中化学复习----基本概念和基本理论[下学期]
文档属性
| 名称 | 初中化学复习----基本概念和基本理论[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 30.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-02-09 00:00:00 | ||
图片预览




文档简介
初中化学复习
基本概念和基本理论
化学是一门研究物质的组成、结构、性质以及变化规律的基础自然科学。
化学用语
溶液 物质变化 物质组成、结构、分类
物质的性质
重点:
1.正确区分物理变化及化学变化,抓住实质:
物质分子没有发生变化→物理变化
物质分子发生了变化→化学变化
<思考> 属于物理变化的是( ) 属于化学变化的是( )
(1)爆炸 (2)同素异形体之间的转化
(3)石碱风化 (3)烧碱潮解
2.置换反应:一种单质和一种化合物反应生成另一种新的单质和另一种新的化合物的反应。
<思考> 属于置换反应的是( )
(1)Cl2+2KI→2KCl+I2
(2)CO+CuO→Cu+CO2
3.复分解反应:(1)一般指酸、碱、盐之间的反应;
(2)酸+碱的反应也称为中和反应,属于复分解反应。
<思考> 属于复分解反应的是( )
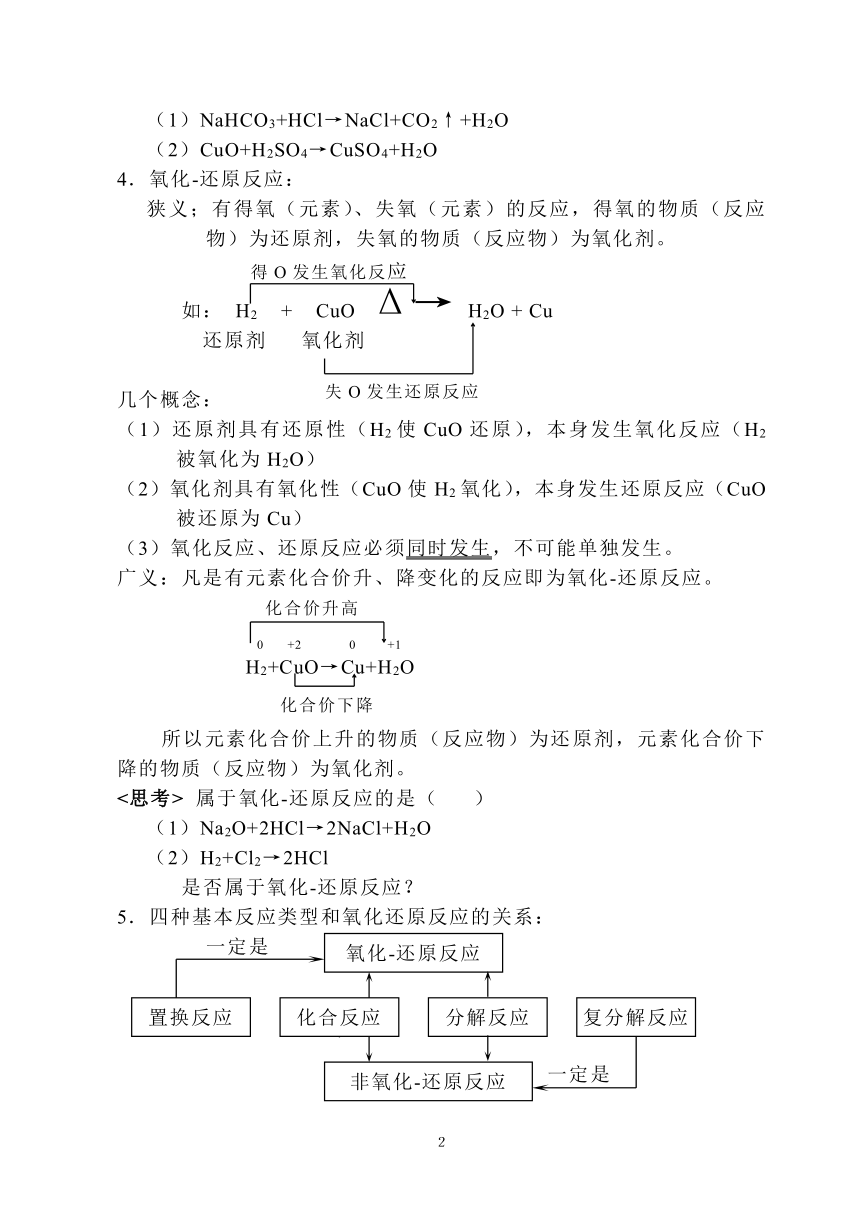
(1)NaHCO3+HCl→NaCl+CO2↑+H2O
(2)CuO+H2SO4→CuSO4+H2O
4.氧化-还原反应:
狭义;有得氧(元素)、失氧(元素)的反应,得氧的物质(反应物)为还原剂,失氧的物质(反应物)为氧化剂。
如: H2 + CuO Δ→ H2O + Cu
还原剂 氧化剂
几个概念:
(1)还原剂具有还原性(H2使CuO还原),本身发生氧化反应(H2被氧化为H2O)
(2)氧化剂具有氧化性(CuO使H2氧化),本身发生还原反应(CuO被还原为Cu)
(3)氧化反应、还原反应必须同时发生,不可能单独发生。
广义:凡是有元素化合价升、降变化的反应即为氧化-还原反应。
化合价升高
0 +2 0 +1
H2+CuO→Cu+H2O
化合价下降
所以元素化合价上升的物质(反应物)为还原剂,元素化合价下降的物质(反应物)为氧化剂。
<思考> 属于氧化-还原反应的是( )
(1)Na2O+2HCl→2NaCl+H2O
(2)H2+Cl2→2HCl
是否属于氧化-还原反应?
5.四种基本反应类型和氧化还原反应的关系:
有单质参加的化合反应一定是氧化-还原反应
如:2Cu + O2 Δ→ 2CuO ( √ )
CO2 + H2O → H2CO3 ( × )
有单质生成的分解反应一定是氧化-还原反应
如:2KClO3 → 2KCl + 3O2↑ ( √ )
Cu(OH)2 Δ→ CuO + H2O ( × )
<思考> 下列变化中,需加入还原剂的是 。
① C → CO2 ② CaO → Ca(OH)2
③ WO3 → W ④ CaCO3 → CaO
6.为了改变化学反应速度,常使用催化剂。
催化剂:特点:(1)改变化学反应速度,而本身的质量和化学性质在反应前、后都没有变化的物质。
(2)只能改变化学反应速度,不能增加产物的“量”,如245克KClO3,不论是否使用催化剂只能得到96克O2。
物理性质:物质不需要通过化学变化就能表现出
二、物质的性质 的性质。
化学性质:物质通过化学反应时表现出的性质。
重点:不要混淆“化学变化”和“化学性质”二个概念
例:“氢气在燃烧”与“氢气具有可燃性”这两句话的含义不同,前者指化学变化,说明氢气正在发生化学变化,而后者是指氢气的化学性质,它有“燃烧”这种化学变化的可能性,但并不说明这种变化有无发生,所以这两个概念既有区别又有联系,即物质的性质决定物质的变化,而物质的变化又反映了物质的性质。
<思考>
1.酒精是一种无色透明的有特别气味的液体,在实验室常用酒精灯作加热用,使用时酒精先气化,然后燃烧生成二氧化碳和水,根据上述情况回答:
(1)物理变化 (2)化学变化 (3)物理性质 (4)化学性质
2. 下列物质的性质属于化学性质的是( )
(1)活性炭吸附有色素 (2)浓硫酸具有酸性
(3)浓盐酸具有挥发性 (4)氨水具有刺激性气味
三、物质的组成、结构和分类
(一)物质的组成
(宏观) (微观)
元素 物质
组成 构成
由分子构成的物质:酸:H2SO4、HCO3等
非金属氧化物:CO2、SO2等
非金属氢化物:HCl、H2S
非金属单质:O2、N2、I2、Br2等等
由原子构成的物质:金属单质:Cu、Fe、Mg等等
某些非金属单质:C、S、Si等等
稀有气体:He、Ne、Ar等等
由离子构成的物质:活泼金属氧化物:N2O、K2O等等
碱:NaOH、KOH、Ba(OH)2等等
大多数盐:NaCl、NH4NO3等等
重点:1. 分子与原子的区别、联系:
区别:分子是保持物质化学性质的一种微粒。
(不是唯一微粒,为什么?)
原子是化学变化中最小微粒。
(注意限制条件:化学变化中)
联系:(1)
(2)它们都是微观的概念,既可讲种类,也可讲个数。
2. 元素和原子的区别、联系:
区别:元素是宏观概念,只讲“种类”不讲“个数”
原子是微观概念,既讲“种类”又讲“个数”
联系:元素是具有相同质子数的同一类原子的总称。
3. 元素的状态 :游离态:元素以单质形态存在。
如:O2中氧元素的状态
化合态:元素以化合物形态存在。
如:H2O2中氧元素的状态
由于元素状态不同,所以H2O2中没有O2。
4、同素异形体:一种元素可以形成几种不同的单质,这些单质叫这种元素的同素异形体。同素异形体在性质上有很大差异。
<思考>:下列说法是否正确:
(1)二氧化碳是由1个碳原子、2个氧原子构成的。
(2)二氧化碳是由1个碳元素和2个氧元素组成的。
(3)二氧化碳是由碳和氧气两种单质组成的。
(4)二氧化碳是由碳元素和氧元素组成的。
(5)二氧化碳是由二氧化碳分子构成的。
(6)分子是保持原物质化学性质的唯一微粒。
(7)干冰和冰是同素异形体。
(8)氧气和臭氧是同素异形体。
(二)原子结构
1.原子的构成
重要关系式:(1)质子数决定元素种类:质子数相同的一类原子即为同种元素。
(2)核电荷数=质子数
(3)对原子而言,质子数=核外电子数。
如:11Na:核电荷数+11,质子数11只,核外电子11只。
(4)原子质量集中在原子核上。
K L M
2.原子结构示意图:11Na 2)8)1)
重点掌握:Na、Mg、O、Cl、He、Ne原子核外电子排布。
3.原子结构与元素性质的关系
(1)最外层电子数决定元素的化学性质
金属元素1—3(H除外) 非金属元素4—7
稀有气体8(Ne为2)
(2)最外层电子数决定元素的化合价,所以也称价电子。
最外层电子数 = 最高正价
Al 2)8)3) +3价 Cl 2)8)7) 最高+7价
O 2)6) 和 F 2)7) 无正价除外
注意:稀有气体最外层稳定结构化合价为0。
非金属元素的│负价│=8—最外层电子数
O 2)6) 负价 = —(8—6)= —2
F 2)7) 负价 = —(8—7)= —1
思考:A元素最外层有3只电子,B元素最外层有6只电子,它们形成的化合物化学式?
(三)物质的分类
<思考>:1. 同种元素组成的物质一定是纯净物?
2.盐类一定含有金属元素
3.金属氧化物一定是碱性氧化物?
4.非金属氧化物一定是酸性氧化物?
5.Na2CO3·10H2O是混合物?
6.盐酸是化合物?
四、化学用语
(一)元素符号:
1.元素符号意义:
(1)表示一种元素
(2)表示该元素的一个原子
(3)可查出该元素的相对原子质量
2.元素符号周边数字的意义:
X
Z—表示质子数或核电荷数 A—原子的质量数(原子数+中子数)
m—元素的化合价 n—该离子所带电荷数(正或负)
b—该单质分子中所含原子个数
3.元素符号前面的系数只表示几个原子,不表示元素。如:2Na
(二)化合价
1.是元素的一种性质,表现在它与其它元素化合时有确定的原子个数之比。
HCl H2O NH3
2.牢记常见元素的化合价:
K、Na、H、Ag +1价
Ca、Mg、Zn、Ba +2价
Cu +1、+2价 Al +3价
Fe 有+2和+3价
F、Cl、Br、I —1价
通常O为 —2价
C有+2和+4价
S —2、+4、+6价
3.牢记常见原子团化合价:
+1 — — —2 —2 —2 —3
NH4 OH NO3 SO4 CO3 SO3 PO4
4.在单质中元素的化合价为零。
(三)分子式:
1.写法 金属:Cu、Fe、Zn
气体:O2、N2、Cl2
非金属: 固体:C、S、P、(I2)
液体:Br2
稀有气体:He、Ne、Ar
化合物:书写规则:化合物中各元素化合价的代数和等于0。
<思考> ① 某金属R的氧化物化学式为RmOn,写出R的氯化物化学式。
② 寻找规律,填写X的化学式 。
NH3 N2 X NO N2O3 NO2
③ 下列各组物质中,所含原子团不相同的一组是 。
① Na2CO3 CaCO3 ② FeSO4 Fe2(SO4) 3
③ KMnO4 K2MnO4 ④ (NH4)2S NH4Cl
2.分子式意义(H2O):(1)表示一种物质;
(2)该物质的一个分子;
(3)表示可计算出分子的相对质量
3.分子式前系数意义:只表示该物质的几个分子,不表示该物质。如:3H2O
(四)原子量和分子量:
1. 原子量(相对原子质量)≠原子的真正质量
分子量≠分子的真正质量
2.正确计算分子量:CuSO4·5H2O
分子量=64+32+16×4+5×(1×2+16)=250
(五)化学方程式
1.定义:用分子式表示化学反应的式子。
2.原则:(1)不可随意臆造:
个性:物质自己独有的化学性质
CO + CuO Δ→ Cu + CO2 ( Fe+ CuO → Cu+ FeO × )
共性:单质、氧化物、酸、碱、盐之间的关系
(2)必须配平:因为化学方程式遵循质量守恒定律。
(3)必须注明反应条件:“点燃”、“加热”、“使用催化剂”、“通电”等等。
(4)对于产物是气体、沉淀要用“↑”、“↓”表示
3.质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
<思考>(1)有a、b、c三种化合物各5克,混合后加热,生成4克新物质,a有剩余,b增加4克,c没有剩余,则a剩余多少克?(2克)
(2)在X+Y=Z+W中,10克X和8克Y反应生成4克Z物质,如要生成7克W物质,则需X物质多少克?(5克)
(3)在A+2B → C+2D中,反应前加入A和B混合物共24克,A完全反应,B剩余4克,生成D9克,求C与D的式量之比。(22:9)
五、溶液
1.溶液的特征:透明(不是无色),均一,稳定(久置不分层)的混合物。
2.溶液的组成:溶质、溶剂。
3.溶质:
(1)指已经溶解了的物质(气体、固体、液体),所以未溶解的物质不是溶质。
(2)正确判断溶质三种情况:
a.与水不反应的物质,溶解的即为溶质(NaCl)
b.与水会反应的物质,溶质指溶解了的反应产物。
Na2O + H2O → 2NaOH
c.结晶水合物:溶质指无结晶水的部分。
如:CuSO4·5H2O → CuSO4 + 5H2O
溶质
4.溶液质量计算:
(1)溶质质量(已溶解的物质)+ 溶剂质量
(2)化学反应后,溶液质量=反应物总质量—气体质量(反应后产物)—沉淀质量(反应后产物+及过量的反应物固体+反应物中不反应不溶解的固体杂质)
5.饱和溶液和不饱和溶液相互转化:
①增加溶剂②改变温度(大多是升温,Ca(OH) 2溶液降温)
饱和溶液 不饱和溶液
①减少溶剂②增加溶质③改变温度(大多是降温,Ca(OH)2溶液升温)
6.衡量物质溶解能力大小的标志——溶解度
(1)定义:在一定温度下,某物质在100克溶剂里最多溶解的克数。(四大要素缺一不可)
<思考>(1)20℃时,A物质在10克水中最多溶解4克,B物质在15克水中最多溶解5克,所以B物质比A物质溶解能力大?
(2)A物质在10克水中最多溶解4克,B物质在10克水中最多溶解5克,所以B物质比A物质溶解能力大?
(2)影响溶解度的因素:
主要因素:① 溶质的本身结构和物理性质
② 溶剂的种类
外因:A. 固体溶质:大多数物质温度升高,溶解度增大。
(KNO3、NH4Cl…)
少数物质,溶解度受温度变化影响很小。(NaCl)
极少数物质,溶解度随温度升高而减少。(Ca(OH)2)
B. 气体溶质:① 温度不变,压强增大,气体溶解度增大;
② 压强不变,温度升高,气体溶解度减小。
7.溶液浓度
(1)质量百分比浓度
数学表达式:
① 饱和溶液中溶解度与质量百分比浓度换算:
② 搞清 a. 饱和溶液不一定是浓溶液
b. 不饱和溶液不一定是稀溶液
<思考> NaCl、Na2O、CuSO4·5H2O各6.2克放入93.8克水,浓度是否都是6.2%?
(2)体积比浓度:二种液体的体积比。
配制1:5的盐酸指1体积浓盐酸和5体积水混合配制而成。
8.有关概念
(1)结晶水合物:
① 不是所有的物质从饱和溶液中析出时都含有结晶水,都是结晶水合物。
常见:CuSO4·5H2O(胆矾) FeSO4·7H2O(绿矾)
Na2CO4·10H2O(石碱) CaCO4·2H2O(石膏)
KAl(SO4)2·12H2O(明矾)
② 水晶化合物是纯净物。
(2)风化:
① 结晶水合物在室温和干燥空气里失去结晶水的过程。
② 风化是化学变化:Na2CO3·10H2O → Na 2CO3 +10H2O
(3)潮解:
① 晶体吸收空气中的水蒸气,在晶体表面形成溶液的现象。
(CaCl2、NaOH固体)
② 潮解是物理变化。
③ 能潮解的物质可作气体干燥剂。
(4)结晶:
① 溶质从溶液里析出形成晶体的过程。
② 结晶二种方法:
a. 恒温蒸发溶剂:适用于溶解度受温度变化影响不大的固体溶质从溶液中析出。(NaCl)
b. 冷却热饱和溶液,适用于溶解度受温度变化的影响很大的固体溶质从溶液中。(NH4NO3)
<思考>
上图为A、B、C三种物质的溶解度曲线表
(1)t1℃时,A、B、C溶解度由小到大顺序为 。
(2)t2℃时质量相同的A、B、C饱和溶液冷却到t1℃析出晶体最多的是 ,
没有晶体析出的是 。
(3)要使A从饱和溶液中结晶出来最好采用 方法。
9.PH值:
要点:(1)表示溶液酸、碱性。
酸性越强(即H+浓度越大),PH值越小;
碱性越强(即OH—浓度越大),PH值越大;
中性PH值为7。
(2)PH值范围
0 7 14
(3)碱性或酸性溶液中加水稀释,PH无限接近于7,但≠7
(4)酸性溶液≠酸溶液;碱性溶液≠碱溶液
<思考题>
1.由碳和氧两种元素组成的气体,碳与氧两种元素的质量比为3:7,则该气体的组成属于 ( )
A.单质 B. 纯净物 C. 混合物 D. 无法确定
2.在化学反应前后,肯定没有变化的是 ( )
① 质子数 ② 原子数 ③ 分子数
④ 物质种类 ⑤ 物质总质量 ⑥ 元素种类
A.①②③⑤ B. ①⑤⑥ C. ②③④ D. ①②⑤⑥
3.根据已配平的化学方程式: Cu + 4HNO3 → Cu(NO3)2 + 2R + 2H2O
推断R的化学式是 ( )
A.NO B. N2O C. NO2 D. N2
4.已知碘元素有—1、+1、+3、+5、+7等多种化合价,碘酸碘是由带正电荷的碘离子和碘酸根离子(IO—3)构成。你认为它的化学式可能是下列中: ( )
A.I2O5 B. I2O7 C. I4O5 D. I4O9
5.欲完成下列转化,需要加入氧化剂的是: ( )
A.Fe2O3 → Fe B. H2 → H2O
C.H2CO3 → CO2 D. HCl → AgCl
6.下列各种物质中,氧元素存在着形态既有游离态又有化合态的是:
( )
A.液态氧 B. 双氧水(H2O2) C. 氯酸钾 D. 空气
7.打开一瓶气水饮料,下列说法有错误的是 ( )
A.溶解度减小 B. 溶液的质量百分比浓度减小
C.溶液质量减小 D. 饱和溶液变为不饱和溶液
8.将m克氯化钠放入n克水中搅拌,所得溶液质量
(填>=、>、=<、=)(m+n)克。
9.用PH试纸测定某碱溶液的PH值,某同学先把PH试纸放在蒸馏水中湿润,然后向试纸上滴待测液,则测得的PH值
(填偏大、偏小、不变)。
10.如图,弹簧秤下挂一重物(不与溶液反应),
若将60℃时饱和的硝酸钾溶液降温至5℃,
弹簧秤的示数将
(填变大、变小或不变),原因是 。
一定是
氧化-还原反应
按反应形式分
(四种基本类型)
分解反应 A→B+C+…
化合反应 A+B+…→C
置换反应 A+BC→B+AC
复分解反应AD+CD→AD+BC
按反应实质分
化合反应
氧化-还原反应
非氧化-还原反应
分解反应
复分解反应
非氧化-还原反应
置换反应
一定是
MnO2
分 子
原 子
离 子
质子:每1个质子带1个单位正电荷
中子:不带电
每一个电子带1个单位负电荷
原子核
eq \o\ac(○,+)
核外电子:
eq \o\ac(○,—)
+11
+13
+17
+8
+9
+8
+9
+3 -2
(A2B3)
不
一
定
有
一
定
有
化学变化
物理变化
一、物质的变化
×100%
S
100+S
=C%
×100%
百分比浓度C%=
溶质质量
溶液质量
单质
Z
b
A
n
m
酸性 中性 碱性
线索:
C
B
A
NaOH 俗称:烧碱、苛性钠
Ca(OH)2 俗称:熟石灰
NaCl 俗称:食盐
CuSO4·5H2O 俗称:胆矾
——纯净物
石灰石(大理石)其主要成分是CaCO3
生石灰 其主要成分是CaO
赤铁矿 其主要成分是Fe2O3
——混合物
仅是物质的俗称:
是主要成分的:
关于物质的俗称判断混合物,纯净物的根据。
盐
正盐
(NaCl、CaCO3、CuSO4)
酸性盐
(NaHSO4 NaHCO3)
碱式盐
(Cu2(OH)2CO3)
碱
可溶性碱
(NaOH、KOH、Ba(OH)2)等等
微溶性碱
(Ca(OH)2)
不溶性碱
(Cu(OH)2、Fe(OH)3…)
无机物
酸
无氧酸
(HCl、H2S…)
含氧酸
(H2SO4、HNO3…)
化合物
氧化物
纯净物
按组成
元素是否相同
酸性氧化物
(CO2、SO2…)
碱性氧化物
(Na2O、BaO…)
两性氧化物
(Al2O3、ZnO)
不成盐氧化物
(CO、NO)
物质
按分子
是否相同
有机物 含碳的化合物
(除去CO、CO2、H2CO3、碳酸盐)
混合物
单质
金属
非金属
稀有气体
温度(℃)
t3 t1 t2
化学反应中进行结合成
化学反应中发生分裂成
得O发生氧化反应
失O发生还原反应
原子
分子
特例:
PAGE
4
基本概念和基本理论
化学是一门研究物质的组成、结构、性质以及变化规律的基础自然科学。
化学用语
溶液 物质变化 物质组成、结构、分类
物质的性质
重点:
1.正确区分物理变化及化学变化,抓住实质:
物质分子没有发生变化→物理变化
物质分子发生了变化→化学变化
<思考> 属于物理变化的是( ) 属于化学变化的是( )
(1)爆炸 (2)同素异形体之间的转化
(3)石碱风化 (3)烧碱潮解
2.置换反应:一种单质和一种化合物反应生成另一种新的单质和另一种新的化合物的反应。
<思考> 属于置换反应的是( )
(1)Cl2+2KI→2KCl+I2
(2)CO+CuO→Cu+CO2
3.复分解反应:(1)一般指酸、碱、盐之间的反应;
(2)酸+碱的反应也称为中和反应,属于复分解反应。
<思考> 属于复分解反应的是( )
(1)NaHCO3+HCl→NaCl+CO2↑+H2O
(2)CuO+H2SO4→CuSO4+H2O
4.氧化-还原反应:
狭义;有得氧(元素)、失氧(元素)的反应,得氧的物质(反应物)为还原剂,失氧的物质(反应物)为氧化剂。
如: H2 + CuO Δ→ H2O + Cu
还原剂 氧化剂
几个概念:
(1)还原剂具有还原性(H2使CuO还原),本身发生氧化反应(H2被氧化为H2O)
(2)氧化剂具有氧化性(CuO使H2氧化),本身发生还原反应(CuO被还原为Cu)
(3)氧化反应、还原反应必须同时发生,不可能单独发生。
广义:凡是有元素化合价升、降变化的反应即为氧化-还原反应。
化合价升高
0 +2 0 +1
H2+CuO→Cu+H2O
化合价下降
所以元素化合价上升的物质(反应物)为还原剂,元素化合价下降的物质(反应物)为氧化剂。
<思考> 属于氧化-还原反应的是( )
(1)Na2O+2HCl→2NaCl+H2O
(2)H2+Cl2→2HCl
是否属于氧化-还原反应?
5.四种基本反应类型和氧化还原反应的关系:
有单质参加的化合反应一定是氧化-还原反应
如:2Cu + O2 Δ→ 2CuO ( √ )
CO2 + H2O → H2CO3 ( × )
有单质生成的分解反应一定是氧化-还原反应
如:2KClO3 → 2KCl + 3O2↑ ( √ )
Cu(OH)2 Δ→ CuO + H2O ( × )
<思考> 下列变化中,需加入还原剂的是 。
① C → CO2 ② CaO → Ca(OH)2
③ WO3 → W ④ CaCO3 → CaO
6.为了改变化学反应速度,常使用催化剂。
催化剂:特点:(1)改变化学反应速度,而本身的质量和化学性质在反应前、后都没有变化的物质。
(2)只能改变化学反应速度,不能增加产物的“量”,如245克KClO3,不论是否使用催化剂只能得到96克O2。
物理性质:物质不需要通过化学变化就能表现出
二、物质的性质 的性质。
化学性质:物质通过化学反应时表现出的性质。
重点:不要混淆“化学变化”和“化学性质”二个概念
例:“氢气在燃烧”与“氢气具有可燃性”这两句话的含义不同,前者指化学变化,说明氢气正在发生化学变化,而后者是指氢气的化学性质,它有“燃烧”这种化学变化的可能性,但并不说明这种变化有无发生,所以这两个概念既有区别又有联系,即物质的性质决定物质的变化,而物质的变化又反映了物质的性质。
<思考>
1.酒精是一种无色透明的有特别气味的液体,在实验室常用酒精灯作加热用,使用时酒精先气化,然后燃烧生成二氧化碳和水,根据上述情况回答:
(1)物理变化 (2)化学变化 (3)物理性质 (4)化学性质
2. 下列物质的性质属于化学性质的是( )
(1)活性炭吸附有色素 (2)浓硫酸具有酸性
(3)浓盐酸具有挥发性 (4)氨水具有刺激性气味
三、物质的组成、结构和分类
(一)物质的组成
(宏观) (微观)
元素 物质
组成 构成
由分子构成的物质:酸:H2SO4、HCO3等
非金属氧化物:CO2、SO2等
非金属氢化物:HCl、H2S
非金属单质:O2、N2、I2、Br2等等
由原子构成的物质:金属单质:Cu、Fe、Mg等等
某些非金属单质:C、S、Si等等
稀有气体:He、Ne、Ar等等
由离子构成的物质:活泼金属氧化物:N2O、K2O等等
碱:NaOH、KOH、Ba(OH)2等等
大多数盐:NaCl、NH4NO3等等
重点:1. 分子与原子的区别、联系:
区别:分子是保持物质化学性质的一种微粒。
(不是唯一微粒,为什么?)
原子是化学变化中最小微粒。
(注意限制条件:化学变化中)
联系:(1)
(2)它们都是微观的概念,既可讲种类,也可讲个数。
2. 元素和原子的区别、联系:
区别:元素是宏观概念,只讲“种类”不讲“个数”
原子是微观概念,既讲“种类”又讲“个数”
联系:元素是具有相同质子数的同一类原子的总称。
3. 元素的状态 :游离态:元素以单质形态存在。
如:O2中氧元素的状态
化合态:元素以化合物形态存在。
如:H2O2中氧元素的状态
由于元素状态不同,所以H2O2中没有O2。
4、同素异形体:一种元素可以形成几种不同的单质,这些单质叫这种元素的同素异形体。同素异形体在性质上有很大差异。
<思考>:下列说法是否正确:
(1)二氧化碳是由1个碳原子、2个氧原子构成的。
(2)二氧化碳是由1个碳元素和2个氧元素组成的。
(3)二氧化碳是由碳和氧气两种单质组成的。
(4)二氧化碳是由碳元素和氧元素组成的。
(5)二氧化碳是由二氧化碳分子构成的。
(6)分子是保持原物质化学性质的唯一微粒。
(7)干冰和冰是同素异形体。
(8)氧气和臭氧是同素异形体。
(二)原子结构
1.原子的构成
重要关系式:(1)质子数决定元素种类:质子数相同的一类原子即为同种元素。
(2)核电荷数=质子数
(3)对原子而言,质子数=核外电子数。
如:11Na:核电荷数+11,质子数11只,核外电子11只。
(4)原子质量集中在原子核上。
K L M
2.原子结构示意图:11Na 2)8)1)
重点掌握:Na、Mg、O、Cl、He、Ne原子核外电子排布。
3.原子结构与元素性质的关系
(1)最外层电子数决定元素的化学性质
金属元素1—3(H除外) 非金属元素4—7
稀有气体8(Ne为2)
(2)最外层电子数决定元素的化合价,所以也称价电子。
最外层电子数 = 最高正价
Al 2)8)3) +3价 Cl 2)8)7) 最高+7价
O 2)6) 和 F 2)7) 无正价除外
注意:稀有气体最外层稳定结构化合价为0。
非金属元素的│负价│=8—最外层电子数
O 2)6) 负价 = —(8—6)= —2
F 2)7) 负价 = —(8—7)= —1
思考:A元素最外层有3只电子,B元素最外层有6只电子,它们形成的化合物化学式?
(三)物质的分类
<思考>:1. 同种元素组成的物质一定是纯净物?
2.盐类一定含有金属元素
3.金属氧化物一定是碱性氧化物?
4.非金属氧化物一定是酸性氧化物?
5.Na2CO3·10H2O是混合物?
6.盐酸是化合物?
四、化学用语
(一)元素符号:
1.元素符号意义:
(1)表示一种元素
(2)表示该元素的一个原子
(3)可查出该元素的相对原子质量
2.元素符号周边数字的意义:
X
Z—表示质子数或核电荷数 A—原子的质量数(原子数+中子数)
m—元素的化合价 n—该离子所带电荷数(正或负)
b—该单质分子中所含原子个数
3.元素符号前面的系数只表示几个原子,不表示元素。如:2Na
(二)化合价
1.是元素的一种性质,表现在它与其它元素化合时有确定的原子个数之比。
HCl H2O NH3
2.牢记常见元素的化合价:
K、Na、H、Ag +1价
Ca、Mg、Zn、Ba +2价
Cu +1、+2价 Al +3价
Fe 有+2和+3价
F、Cl、Br、I —1价
通常O为 —2价
C有+2和+4价
S —2、+4、+6价
3.牢记常见原子团化合价:
+1 — — —2 —2 —2 —3
NH4 OH NO3 SO4 CO3 SO3 PO4
4.在单质中元素的化合价为零。
(三)分子式:
1.写法 金属:Cu、Fe、Zn
气体:O2、N2、Cl2
非金属: 固体:C、S、P、(I2)
液体:Br2
稀有气体:He、Ne、Ar
化合物:书写规则:化合物中各元素化合价的代数和等于0。
<思考> ① 某金属R的氧化物化学式为RmOn,写出R的氯化物化学式。
② 寻找规律,填写X的化学式 。
NH3 N2 X NO N2O3 NO2
③ 下列各组物质中,所含原子团不相同的一组是 。
① Na2CO3 CaCO3 ② FeSO4 Fe2(SO4) 3
③ KMnO4 K2MnO4 ④ (NH4)2S NH4Cl
2.分子式意义(H2O):(1)表示一种物质;
(2)该物质的一个分子;
(3)表示可计算出分子的相对质量
3.分子式前系数意义:只表示该物质的几个分子,不表示该物质。如:3H2O
(四)原子量和分子量:
1. 原子量(相对原子质量)≠原子的真正质量
分子量≠分子的真正质量
2.正确计算分子量:CuSO4·5H2O
分子量=64+32+16×4+5×(1×2+16)=250
(五)化学方程式
1.定义:用分子式表示化学反应的式子。
2.原则:(1)不可随意臆造:
个性:物质自己独有的化学性质
CO + CuO Δ→ Cu + CO2 ( Fe+ CuO → Cu+ FeO × )
共性:单质、氧化物、酸、碱、盐之间的关系
(2)必须配平:因为化学方程式遵循质量守恒定律。
(3)必须注明反应条件:“点燃”、“加热”、“使用催化剂”、“通电”等等。
(4)对于产物是气体、沉淀要用“↑”、“↓”表示
3.质量守恒定律:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
<思考>(1)有a、b、c三种化合物各5克,混合后加热,生成4克新物质,a有剩余,b增加4克,c没有剩余,则a剩余多少克?(2克)
(2)在X+Y=Z+W中,10克X和8克Y反应生成4克Z物质,如要生成7克W物质,则需X物质多少克?(5克)
(3)在A+2B → C+2D中,反应前加入A和B混合物共24克,A完全反应,B剩余4克,生成D9克,求C与D的式量之比。(22:9)
五、溶液
1.溶液的特征:透明(不是无色),均一,稳定(久置不分层)的混合物。
2.溶液的组成:溶质、溶剂。
3.溶质:
(1)指已经溶解了的物质(气体、固体、液体),所以未溶解的物质不是溶质。
(2)正确判断溶质三种情况:
a.与水不反应的物质,溶解的即为溶质(NaCl)
b.与水会反应的物质,溶质指溶解了的反应产物。
Na2O + H2O → 2NaOH
c.结晶水合物:溶质指无结晶水的部分。
如:CuSO4·5H2O → CuSO4 + 5H2O
溶质
4.溶液质量计算:
(1)溶质质量(已溶解的物质)+ 溶剂质量
(2)化学反应后,溶液质量=反应物总质量—气体质量(反应后产物)—沉淀质量(反应后产物+及过量的反应物固体+反应物中不反应不溶解的固体杂质)
5.饱和溶液和不饱和溶液相互转化:
①增加溶剂②改变温度(大多是升温,Ca(OH) 2溶液降温)
饱和溶液 不饱和溶液
①减少溶剂②增加溶质③改变温度(大多是降温,Ca(OH)2溶液升温)
6.衡量物质溶解能力大小的标志——溶解度
(1)定义:在一定温度下,某物质在100克溶剂里最多溶解的克数。(四大要素缺一不可)
<思考>(1)20℃时,A物质在10克水中最多溶解4克,B物质在15克水中最多溶解5克,所以B物质比A物质溶解能力大?
(2)A物质在10克水中最多溶解4克,B物质在10克水中最多溶解5克,所以B物质比A物质溶解能力大?
(2)影响溶解度的因素:
主要因素:① 溶质的本身结构和物理性质
② 溶剂的种类
外因:A. 固体溶质:大多数物质温度升高,溶解度增大。
(KNO3、NH4Cl…)
少数物质,溶解度受温度变化影响很小。(NaCl)
极少数物质,溶解度随温度升高而减少。(Ca(OH)2)
B. 气体溶质:① 温度不变,压强增大,气体溶解度增大;
② 压强不变,温度升高,气体溶解度减小。
7.溶液浓度
(1)质量百分比浓度
数学表达式:
① 饱和溶液中溶解度与质量百分比浓度换算:
② 搞清 a. 饱和溶液不一定是浓溶液
b. 不饱和溶液不一定是稀溶液
<思考> NaCl、Na2O、CuSO4·5H2O各6.2克放入93.8克水,浓度是否都是6.2%?
(2)体积比浓度:二种液体的体积比。
配制1:5的盐酸指1体积浓盐酸和5体积水混合配制而成。
8.有关概念
(1)结晶水合物:
① 不是所有的物质从饱和溶液中析出时都含有结晶水,都是结晶水合物。
常见:CuSO4·5H2O(胆矾) FeSO4·7H2O(绿矾)
Na2CO4·10H2O(石碱) CaCO4·2H2O(石膏)
KAl(SO4)2·12H2O(明矾)
② 水晶化合物是纯净物。
(2)风化:
① 结晶水合物在室温和干燥空气里失去结晶水的过程。
② 风化是化学变化:Na2CO3·10H2O → Na 2CO3 +10H2O
(3)潮解:
① 晶体吸收空气中的水蒸气,在晶体表面形成溶液的现象。
(CaCl2、NaOH固体)
② 潮解是物理变化。
③ 能潮解的物质可作气体干燥剂。
(4)结晶:
① 溶质从溶液里析出形成晶体的过程。
② 结晶二种方法:
a. 恒温蒸发溶剂:适用于溶解度受温度变化影响不大的固体溶质从溶液中析出。(NaCl)
b. 冷却热饱和溶液,适用于溶解度受温度变化的影响很大的固体溶质从溶液中。(NH4NO3)
<思考>
上图为A、B、C三种物质的溶解度曲线表
(1)t1℃时,A、B、C溶解度由小到大顺序为 。
(2)t2℃时质量相同的A、B、C饱和溶液冷却到t1℃析出晶体最多的是 ,
没有晶体析出的是 。
(3)要使A从饱和溶液中结晶出来最好采用 方法。
9.PH值:
要点:(1)表示溶液酸、碱性。
酸性越强(即H+浓度越大),PH值越小;
碱性越强(即OH—浓度越大),PH值越大;
中性PH值为7。
(2)PH值范围
0 7 14
(3)碱性或酸性溶液中加水稀释,PH无限接近于7,但≠7
(4)酸性溶液≠酸溶液;碱性溶液≠碱溶液
<思考题>
1.由碳和氧两种元素组成的气体,碳与氧两种元素的质量比为3:7,则该气体的组成属于 ( )
A.单质 B. 纯净物 C. 混合物 D. 无法确定
2.在化学反应前后,肯定没有变化的是 ( )
① 质子数 ② 原子数 ③ 分子数
④ 物质种类 ⑤ 物质总质量 ⑥ 元素种类
A.①②③⑤ B. ①⑤⑥ C. ②③④ D. ①②⑤⑥
3.根据已配平的化学方程式: Cu + 4HNO3 → Cu(NO3)2 + 2R + 2H2O
推断R的化学式是 ( )
A.NO B. N2O C. NO2 D. N2
4.已知碘元素有—1、+1、+3、+5、+7等多种化合价,碘酸碘是由带正电荷的碘离子和碘酸根离子(IO—3)构成。你认为它的化学式可能是下列中: ( )
A.I2O5 B. I2O7 C. I4O5 D. I4O9
5.欲完成下列转化,需要加入氧化剂的是: ( )
A.Fe2O3 → Fe B. H2 → H2O
C.H2CO3 → CO2 D. HCl → AgCl
6.下列各种物质中,氧元素存在着形态既有游离态又有化合态的是:
( )
A.液态氧 B. 双氧水(H2O2) C. 氯酸钾 D. 空气
7.打开一瓶气水饮料,下列说法有错误的是 ( )
A.溶解度减小 B. 溶液的质量百分比浓度减小
C.溶液质量减小 D. 饱和溶液变为不饱和溶液
8.将m克氯化钠放入n克水中搅拌,所得溶液质量
(填>=、>、=<、=)(m+n)克。
9.用PH试纸测定某碱溶液的PH值,某同学先把PH试纸放在蒸馏水中湿润,然后向试纸上滴待测液,则测得的PH值
(填偏大、偏小、不变)。
10.如图,弹簧秤下挂一重物(不与溶液反应),
若将60℃时饱和的硝酸钾溶液降温至5℃,
弹簧秤的示数将
(填变大、变小或不变),原因是 。
一定是
氧化-还原反应
按反应形式分
(四种基本类型)
分解反应 A→B+C+…
化合反应 A+B+…→C
置换反应 A+BC→B+AC
复分解反应AD+CD→AD+BC
按反应实质分
化合反应
氧化-还原反应
非氧化-还原反应
分解反应
复分解反应
非氧化-还原反应
置换反应
一定是
MnO2
分 子
原 子
离 子
质子:每1个质子带1个单位正电荷
中子:不带电
每一个电子带1个单位负电荷
原子核
eq \o\ac(○,+)
核外电子:
eq \o\ac(○,—)
+11
+13
+17
+8
+9
+8
+9
+3 -2
(A2B3)
不
一
定
有
一
定
有
化学变化
物理变化
一、物质的变化
×100%
S
100+S
=C%
×100%
百分比浓度C%=
溶质质量
溶液质量
单质
Z
b
A
n
m
酸性 中性 碱性
线索:
C
B
A
NaOH 俗称:烧碱、苛性钠
Ca(OH)2 俗称:熟石灰
NaCl 俗称:食盐
CuSO4·5H2O 俗称:胆矾
——纯净物
石灰石(大理石)其主要成分是CaCO3
生石灰 其主要成分是CaO
赤铁矿 其主要成分是Fe2O3
——混合物
仅是物质的俗称:
是主要成分的:
关于物质的俗称判断混合物,纯净物的根据。
盐
正盐
(NaCl、CaCO3、CuSO4)
酸性盐
(NaHSO4 NaHCO3)
碱式盐
(Cu2(OH)2CO3)
碱
可溶性碱
(NaOH、KOH、Ba(OH)2)等等
微溶性碱
(Ca(OH)2)
不溶性碱
(Cu(OH)2、Fe(OH)3…)
无机物
酸
无氧酸
(HCl、H2S…)
含氧酸
(H2SO4、HNO3…)
化合物
氧化物
纯净物
按组成
元素是否相同
酸性氧化物
(CO2、SO2…)
碱性氧化物
(Na2O、BaO…)
两性氧化物
(Al2O3、ZnO)
不成盐氧化物
(CO、NO)
物质
按分子
是否相同
有机物 含碳的化合物
(除去CO、CO2、H2CO3、碳酸盐)
混合物
单质
金属
非金属
稀有气体
温度(℃)
t3 t1 t2
化学反应中进行结合成
化学反应中发生分裂成
得O发生氧化反应
失O发生还原反应
原子
分子
特例:
PAGE
4
同课章节目录
